葡萄糖酸锌是一种常用的补锌剂,可由葡萄糖酸钙与硫酸锌直接反应制得: 。回答下列问题:
。回答下列问题:
(1) 与氨能形成稳定的
与氨能形成稳定的 ,Zn-N化学键称为
,Zn-N化学键称为_______ 键,其电子对由_______ (填元素符号)提供。
(2) 的空间构型为
的空间构型为_______ ,写出一种与其互为等电子体的分子:_______ (填化学式)。
(3)葡萄糖酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为_______ ,葡萄糖酸易溶于水的主要原因是_______ ; 中元素的电负性由大到小的顺序为
中元素的电负性由大到小的顺序为_______ 。

 。回答下列问题:
。回答下列问题:(1)
 与氨能形成稳定的
与氨能形成稳定的 ,Zn-N化学键称为
,Zn-N化学键称为(2)
 的空间构型为
的空间构型为(3)葡萄糖酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为
 中元素的电负性由大到小的顺序为
中元素的电负性由大到小的顺序为
2023高三·全国·专题练习 查看更多[1]
(已下线)晶体结构与性质
更新时间:2023-12-16 23:20:47
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大。X的基态原子的最外层电子排布式为nsnnpn+1。Y、Z同主族且ZY2是导致酸雨的主要物质之一。R位于ds区且原子最外层只有一个电子。W原子次外层电子数为最外层电子数的7倍。回答下列问题:
(1)W在元素周期表中的位置是____ ,其基态原子的价电子排布图为____ 。
(2)Y的气态氢化物稳定性比Z的气态氢化物的稳定性____ (填“强”或“弱”)。Y的第一电离能比X的____ (填“大”或“小”)。
(3)X的最常见的气体氢化物分子的VSEPR模型为____ ,分子的空间构型是____ 。
(4)原子总数相同、价电子总数相同的分子或离子称为等电子体。分别写出一种与XO 互为等电子体的单质和化合物的化学式
互为等电子体的单质和化合物的化学式____ 、____ 。
(1)W在元素周期表中的位置是
(2)Y的气态氢化物稳定性比Z的气态氢化物的稳定性
(3)X的最常见的气体氢化物分子的VSEPR模型为
(4)原子总数相同、价电子总数相同的分子或离子称为等电子体。分别写出一种与XO
 互为等电子体的单质和化合物的化学式
互为等电子体的单质和化合物的化学式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)某元素原子基态核外电子有 14 种不同的运动状态,该元素名称是_______ ,在周期表中的位置_______ ,属于_______ 区,占据最高能级的电子云轮廓图为_______ 形。
(2)1~36号元素中基态原子核外电子排布中未成对电子数最多的元素的核外电子排布式是_______ ,其价电子轨道表示式为_______ 。
(3)价电子排布式为 3d54s2 的原子,其原子结构示意图为_______ ,其最高正价为_______ 价。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3 中,阴离子空间构型为_______ ,C 原子的杂化方式为_______ 。
(1)某元素原子基态核外电子有 14 种不同的运动状态,该元素名称是
(2)1~36号元素中基态原子核外电子排布中未成对电子数最多的元素的核外电子排布式是
(3)价电子排布式为 3d54s2 的原子,其原子结构示意图为
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3 中,阴离子空间构型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】I、钢铁中加入少量镍铬等元素可制成不锈钢,东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是______________________ 。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为_________ ,提供孤电子对的成键原子是________ 。
(2)铁元素有变价,试根据原子核外电子排布所遵循的原理解释Fe2+具有较强的还原性,易被氧化为Fe3+的原因______________________________ 。
(3)普鲁士蓝(Prussian Blue),即亚铁氰化铁,化学式Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有____________________ ;
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
II、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为2Mn2++5S2O82−+8H2O=2MnO4−+10SO42−+16H+
(4)写出基态锰原子的价电子排布的轨道表示式:________________ 。
(5)已知H2S2O8的结构如图:

①H2S2O8硫原子的轨道杂化方式为________________ 。
②上述反应每生成2 mol MnO4−,S2O82−断裂的共价键数目为_________ 。
③上述反应中被还原的元素为________________ 。
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为
(2)铁元素有变价,试根据原子核外电子排布所遵循的原理解释Fe2+具有较强的还原性,易被氧化为Fe3+的原因
(3)普鲁士蓝(Prussian Blue),即亚铁氰化铁,化学式Fe4[Fe(CN)6]3是一种配合物,其中含有的化学键有
a.共价键 b.离子键 c.配位键 d.金属键 e.氢键
II、钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为2Mn2++5S2O82−+8H2O=2MnO4−+10SO42−+16H+
(4)写出基态锰原子的价电子排布的轨道表示式:
(5)已知H2S2O8的结构如图:

①H2S2O8硫原子的轨道杂化方式为
②上述反应每生成2 mol MnO4−,S2O82−断裂的共价键数目为
③上述反应中被还原的元素为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】新冠肺炎疫情防控,消毒用品必不可少。试回答下列问题:
(1)过氧乙酸(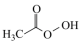 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有___________ ,分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。___________ ;基态氯原子的核外电子排布式为___________ ,最高能级的原子轨道电子云轮廓图形状为___________ 。
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于___________ 晶体。
③乙醇与甲醚(CH3OCH3)的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是___________ 。
(3)Na、K等活泼金属在O2中燃烧得到的Na2O2、KO2具有强氧化性,也常做消毒剂。已知KO2的晶胞如图所示:___________ g·cm-3 (用含a、NA的代数式表示)。
(1)过氧乙酸(
 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有 键和
键和 键的个数比为
键的个数比为(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。
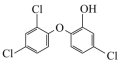
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于
③乙醇与甲醚(CH3OCH3)的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
(3)Na、K等活泼金属在O2中燃烧得到的Na2O2、KO2具有强氧化性,也常做消毒剂。已知KO2的晶胞如图所示:
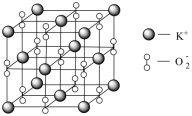
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等领域。
(1)基态Fe原子的价层电子的电子排布图为_______ ;其最外层电子的电子云形状为_______ 。
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为_______ 晶体。
(3)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其阴离子的立体构型名称为_______ 。写出一种与NH 互为等电子体的分子的电子式:
互为等电子体的分子的电子式:_______ 。
(4)Fe(CO)5)可用作催化剂、汽油抗爆剂等,其分子中 键和
键和 键的数目之比为
键的数目之比为_______ 。CO的沸点高于N2的原因是_______ 。
(5)据报道,工业上可电解熔融的FeO、Fe2O3冶炼高纯铁。Fe2O3的熔点_______ (填“高于”或“低于”)FeO的熔点,理由是_______ 。
(6)铁晶体有面心立方最密堆积和体心立方堆积两种晶体,这两种晶体铁原子的配位数之比为_______ 。
(7)某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为_______ 。若晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为_______ g/cm3(用含a、c和NA的式子表示并化到最简)。

(1)基态Fe原子的价层电子的电子排布图为
(2)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为
(3)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其阴离子的立体构型名称为
 互为等电子体的分子的电子式:
互为等电子体的分子的电子式:(4)Fe(CO)5)可用作催化剂、汽油抗爆剂等,其分子中
 键和
键和 键的数目之比为
键的数目之比为(5)据报道,工业上可电解熔融的FeO、Fe2O3冶炼高纯铁。Fe2O3的熔点
(6)铁晶体有面心立方最密堆积和体心立方堆积两种晶体,这两种晶体铁原子的配位数之比为
(7)某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】H、C、N、K、Zn、Fe等都是中学阶段常见元素,请用相关知识回答下列问题:
(1)N原子的价电子排布图为_______ 。NH3分子中N原子的杂化方式为_______ ,该分子的立体构型名称是_______ 。
(2)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为_______ 。
(3)K3[Fe(CN)6]可用来检验Fe2+,向硫酸亚铁溶液中加入几滴K3[Fe(CN)6],观察到的现象是_______ 。与CN-互为等电子体的的微粒有_______ (填化学式,写2种)。C、N、O三种元素第一电离能由大到小的顺序为_______ ,三种元素形成的简单氢化物分子中键角由大到小依次为_______ (用分子式表示)。
(4)已知Fe的相对原子质量为M,阿伏加德罗常数用NA表示,已知金属Fe为体心立方堆积,若Fe原子半径为acm,密度为dg/cm3。则M=_______ (用d、a、NA表达式表示)。
(1)N原子的价电子排布图为
(2)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为
(3)K3[Fe(CN)6]可用来检验Fe2+,向硫酸亚铁溶液中加入几滴K3[Fe(CN)6],观察到的现象是
(4)已知Fe的相对原子质量为M,阿伏加德罗常数用NA表示,已知金属Fe为体心立方堆积,若Fe原子半径为acm,密度为dg/cm3。则M=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】黄金是一种非常重要的金属。不仅是用于储备和投资的特殊通货,同时又是首饰业、电子业、现代通讯。航天航空业等部门的重要材料。
(1)金能溶解于王水中:Au+HNO3+4HCl=H[AuCl4]+NO(g)+2H2O,请分析H[AuCl4]中Au3+的配体是___________ ,配位数是___________ 。
(2)开采的金矿可用氰化法提取:先以氰化钠(NaCN)溶液处理粉碎的金矿石得到NaAu(CN)2,再用锌还原:Zn+2NaAu(CN)2=2Au+Na2[Zn(CN)4]。Zn与CN-形成的配离子为正四面体形,Au(+1价)与CN-形成的配离子为直线形。
①NaAu(CN)2中配合离子[Au(CN)2]-中σ键和π键个数之比是___________ ,配体CN-杂化方式是___________ 。
②写出 Zn的电子排布式___________ ,C、N、Na的第一电离能由大到小顺序为___________ 。
(3)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态还是气态,它都是以二聚体Au₂Cl6的形式存在。依据以上信息判断AuCl2晶体的结构属于___________ 晶体,写出Au2Cl6的结构式___________ 。
(4)某种铀氮化物的晶体结构与MgO相同。MgO的Bom-Haber循环如图所示。

①MgO晶格能为___________ kJ·mol-1。
②Al的第二电离能大于Mg的第二电离能,是由于Al+的半径较Mg+小、Al+的核电荷更高以及___________ 。
(5)另一种铀氮化物的晶胞如下图所示(白球-U原子,黑球-N原子),U“原子”作面心立方最密堆积。

①铀元素的化合价为___________
②U“原子”的配位数为___________ 。已知晶胞参数为a nm,则晶体的密度为___________ g/cm3(列出计算式)。
(1)金能溶解于王水中:Au+HNO3+4HCl=H[AuCl4]+NO(g)+2H2O,请分析H[AuCl4]中Au3+的配体是
(2)开采的金矿可用氰化法提取:先以氰化钠(NaCN)溶液处理粉碎的金矿石得到NaAu(CN)2,再用锌还原:Zn+2NaAu(CN)2=2Au+Na2[Zn(CN)4]。Zn与CN-形成的配离子为正四面体形,Au(+1价)与CN-形成的配离子为直线形。
①NaAu(CN)2中配合离子[Au(CN)2]-中σ键和π键个数之比是
②写出 Zn的电子排布式
(3)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态还是气态,它都是以二聚体Au₂Cl6的形式存在。依据以上信息判断AuCl2晶体的结构属于
(4)某种铀氮化物的晶体结构与MgO相同。MgO的Bom-Haber循环如图所示。

①MgO晶格能为
②Al的第二电离能大于Mg的第二电离能,是由于Al+的半径较Mg+小、Al+的核电荷更高以及
(5)另一种铀氮化物的晶胞如下图所示(白球-U原子,黑球-N原子),U“原子”作面心立方最密堆积。

①铀元素的化合价为
②U“原子”的配位数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验:
Ⅰ.利用如图装置可验证氯元素和碘元素非金属性的强弱。___________ ,仪器D的作用是___________ 。
(2)A中加浓盐酸,B中加 (
( 与浓盐酸常温下反应生成氯气)。
与浓盐酸常温下反应生成氯气)。
①C中加淀粉碘化钾混合溶液,观察到C中溶液有___________ 的现象,即可证明;
②从环境保护的观点考虑,此装置缺少尾气处理装置,可用___________ 溶液吸收尾气;
③ 与
与 的空间结构相似,其键角大小的关系是
的空间结构相似,其键角大小的关系是
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
Ⅱ.验证同周期元素性质变化规律
(3)将钠、镁、铝各 分别投入到足量的同浓度的盐酸中,试预测实验结果:
分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈,它的晶体堆积模型如图所示:
与盐酸反应最剧烈,它的晶体堆积模型如图所示:___________ 。以镁为例,发现随着反应时间的进行,化学反应速率是先加快后减慢,分析先加快的主要原因可能是(假设不考虑固体质量的减少对反应速率的影响,填序号)___________ 。
A.该反应是放热反应
B.该反应是吸热反应
C.温度升高速率加快对化学反应的影响,大于盐酸浓度降低速率减慢的影响
D.温度升高速率加快对化学反应的影响,小于盐酸浓度降低速率减慢的影响
(4)查阅有关氯化铝的一些资料,得到如下一些信息:①将氯化铝加热,在180℃时开始升华;②在 条件下,氯化铝的熔点为190℃;③在
条件下,氯化铝的熔点为190℃;③在 和
和 时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
请根据以上资料回答下列问题:
①根据资料猜测氯化铝是___________ (填“离子化合物”或“共价化合物”)。
②通过计算确定氯化铝含有配位键的结构式正确的是___________ 。___________ 。
Ⅰ.利用如图装置可验证氯元素和碘元素非金属性的强弱。

(2)A中加浓盐酸,B中加
 (
( 与浓盐酸常温下反应生成氯气)。
与浓盐酸常温下反应生成氯气)。①C中加淀粉碘化钾混合溶液,观察到C中溶液有
②从环境保护的观点考虑,此装置缺少尾气处理装置,可用
③
 与
与 的空间结构相似,其键角大小的关系是
的空间结构相似,其键角大小的关系是
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。Ⅱ.验证同周期元素性质变化规律
(3)将钠、镁、铝各
 分别投入到足量的同浓度的盐酸中,试预测实验结果:
分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈,它的晶体堆积模型如图所示:
与盐酸反应最剧烈,它的晶体堆积模型如图所示:
A.该反应是放热反应
B.该反应是吸热反应
C.温度升高速率加快对化学反应的影响,大于盐酸浓度降低速率减慢的影响
D.温度升高速率加快对化学反应的影响,小于盐酸浓度降低速率减慢的影响
(4)查阅有关氯化铝的一些资料,得到如下一些信息:①将氯化铝加热,在180℃时开始升华;②在
 条件下,氯化铝的熔点为190℃;③在
条件下,氯化铝的熔点为190℃;③在 和
和 时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。请根据以上资料回答下列问题:
①根据资料猜测氯化铝是
②通过计算确定氯化铝含有配位键的结构式正确的是
A.  B.
B. C.
C.
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.2016年7月8日,世界首款石墨烯基锂离子电池产品在北京发布。在石墨烯基锂离子电池中,由纯度在99%以上的单层石墨烯包覆的磷酸铁锂作正极材料,加强导电性,实现快速充电。
(1)碳原子的核外电子排布式为___________ 。
(2)石墨烯的结构如图所示,在石墨烯中碳原子的杂化方式为___________ 。

Ⅱ.Fe、Ni、Pt在周期表中同族,该族元素的化合物在科学研究和实际生产中有许多重要用途。
(1)①Fe在元素周期表中的位置为___________ 。
②铁有δ、γ、α三种晶型,各晶胞结构如图,则δ、α两种晶胞中铁原子的配位数之比为___________ 。γFe的晶胞边长为a pm,则Fe原子半径为___________ pm。
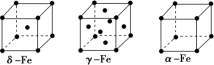
③已知FeO晶体晶胞结构为NaCl型,与O2-距离相等且最近的亚铁离子围成的空间构型为___________ 。
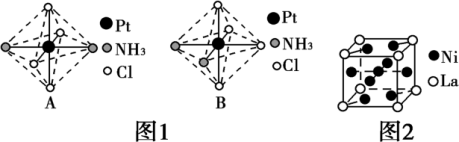
(2)铂可与不同的配体形成多种配合物。分子式为[Pt(NH3)2Cl4]的配合物的配体是___________ ;该配合物有两种不同的结构,其中呈橙黄色的物质的结构比较不稳定,在水中的溶解度大;呈亮黄色的物质的结构较稳定,在水中的溶解度小,图1所示的物质中呈亮黄色的是___________ (填“A”或“B”),理由是___________ 。
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图2所示。
①储氢原理为:镧镍合金吸附H2,H2解离为H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为___________ 。
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为___________ g·cm-3.(不必计算出结果)
(1)碳原子的核外电子排布式为
(2)石墨烯的结构如图所示,在石墨烯中碳原子的杂化方式为

Ⅱ.Fe、Ni、Pt在周期表中同族,该族元素的化合物在科学研究和实际生产中有许多重要用途。
(1)①Fe在元素周期表中的位置为
②铁有δ、γ、α三种晶型,各晶胞结构如图,则δ、α两种晶胞中铁原子的配位数之比为

③已知FeO晶体晶胞结构为NaCl型,与O2-距离相等且最近的亚铁离子围成的空间构型为
(2)铂可与不同的配体形成多种配合物。分子式为[Pt(NH3)2Cl4]的配合物的配体是

(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图2所示。
①储氢原理为:镧镍合金吸附H2,H2解离为H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为
您最近一年使用:0次
【推荐1】请回答下列问题。
(1)金属铝的卤化物熔点如下表:
请画出其中不属于分子晶体的卤化铝的电子式_______ ,加热分解某种铵盐X,可以1:3的物质的量比获得该卤化铝与一种离子化合物Y,Y的阳离子与阴离子具有相同的核外电子数,写出X的化学式_______ 。
(2)广义氢键理论认为除了与N、O、F原子形成氢键外,H原子还可以与很多带部分负电荷的原子形成氢键,请用广义氢键理论解释氮硼烷(H3N-BH3) 的沸点比乙烷(H3C-CH3)高285°C的原因________ 。
(1)金属铝的卤化物熔点如下表:
| 化学式 | AlF3 | AlCl3 | AlBr3 | AlI3 |
| 熔点/°C | 1290 | 180 | 97.5 | 188 |
请画出其中不属于分子晶体的卤化铝的电子式
(2)广义氢键理论认为除了与N、O、F原子形成氢键外,H原子还可以与很多带部分负电荷的原子形成氢键,请用广义氢键理论解释氮硼烷(H3N-BH3) 的沸点比乙烷(H3C-CH3)高285°C的原因
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】杂环化合物数量巨大、种类丰富、性能多样、应用广泛。
(1)由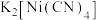 、
、 和吡嗪(
和吡嗪( 可用pyz表示)反应制得晶体,其化学式为
可用pyz表示)反应制得晶体,其化学式为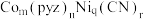 ,四方晶胞结构如图所示。基态Co原子的简化电子排布式为
,四方晶胞结构如图所示。基态Co原子的简化电子排布式为_______ ,C、N、O的第二电离能由大到小顺序为_______ ,晶体中 与
与 的配位数之比为
的配位数之比为_______ ,上述制得晶体的化学方程式为_______ 。 )分子中存在
)分子中存在 离域
离域 键,氮原子的杂化方式
键,氮原子的杂化方式_______ ;吡嗪的熔点_______ (填“大于”、“等于”、“小于”)哒嗪( );哒嗪在水中的溶解度大于苯的原因
);哒嗪在水中的溶解度大于苯的原因_______ 。
(3)休克尔规则可用于判断共轭结构的环状有机化合物是否有芳香性。若参与构成共轭 键电子的个数为
键电子的个数为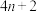 ,其中n为自然数,则此化合物就具有芳香性。下列物质中C、N、O均采用
,其中n为自然数,则此化合物就具有芳香性。下列物质中C、N、O均采用 杂化,其中具有芳香性的是
杂化,其中具有芳香性的是_______ 。
(1)由
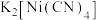 、
、 和吡嗪(
和吡嗪( 可用pyz表示)反应制得晶体,其化学式为
可用pyz表示)反应制得晶体,其化学式为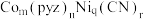 ,四方晶胞结构如图所示。基态Co原子的简化电子排布式为
,四方晶胞结构如图所示。基态Co原子的简化电子排布式为 与
与 的配位数之比为
的配位数之比为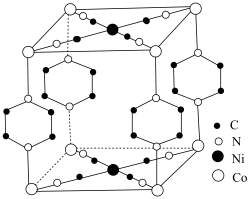
 )分子中存在
)分子中存在 离域
离域 键,氮原子的杂化方式
键,氮原子的杂化方式 );哒嗪在水中的溶解度大于苯的原因
);哒嗪在水中的溶解度大于苯的原因(3)休克尔规则可用于判断共轭结构的环状有机化合物是否有芳香性。若参与构成共轭
 键电子的个数为
键电子的个数为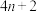 ,其中n为自然数,则此化合物就具有芳香性。下列物质中C、N、O均采用
,其中n为自然数,则此化合物就具有芳香性。下列物质中C、N、O均采用 杂化,其中具有芳香性的是
杂化,其中具有芳香性的是a. 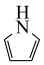 b.
b.  c.
c.  d.
d.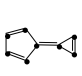
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】卤族元素形成的单质和化合物有很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的___________ 区。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的,使氢氟酸分子缔合的作用力是___________ 。
(3)根据下表提供的第一电离能数据判断, 卤素原子形成的简单阴离子还原性最强的是___________ (填化学式)。
(4)已知羧酸:①CF3COOH,②CH3COOH,③CH2FCOOH,④CH2ClCOOH,⑤CH3CH2COOH,其酸性由强到弱的顺序为___________ (填序号)。
(5)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应生成了一种三原子分子,写出反应的化学方程式___________ 。
(6)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图),则1mol H3BO3形成的晶体中有___________ mol氢键。___________ 。
(1)卤族元素位于元素周期表的
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的,使氢氟酸分子缔合的作用力是
(3)根据下表提供的第一电离能数据判断, 卤素原子形成的简单阴离子还原性最强的是
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能/(kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)已知羧酸:①CF3COOH,②CH3COOH,③CH2FCOOH,④CH2ClCOOH,⑤CH3CH2COOH,其酸性由强到弱的顺序为
(5)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应生成了一种三原子分子,写出反应的化学方程式
(6)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图),则1mol H3BO3形成的晶体中有


您最近一年使用:0次



