25℃时,下列说法不正确 的是
| A.稀释醋酸溶液,溶液中的H+和OH-数目都增大 |
B.某温度下纯水中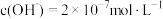 ,则该温度下0.1mol·L-1的盐酸的pH=1 ,则该温度下0.1mol·L-1的盐酸的pH=1 |
| C.pH相等的CH3COONa和NaOH溶液,水的电离程度相同 |
| D.已知CH3COONH4溶液显中性,常温下等浓度的NH4Cl和CH3COONa,若前者的pH=a,后者的pH=b,则a+b=14 |
更新时间:2023-12-20 11:42:45
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】25℃时,由水电离出c(OH-)=1×10-11mol/L 的溶液中,可能能大量共存的离子组是
| A.Al3+、Na+、SO42― 、AlO2- | B.Na+、CH3COO-、K+、Cu2+ |
| C.K+、I-、SO42―、Na+ | D.Fe2+、Cl-、Na+、HCO3― |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】水存在电离平衡:H2O H++OH-,常温下,Kw 的数值为 1×10-14.下列说法不正确的是
H++OH-,常温下,Kw 的数值为 1×10-14.下列说法不正确的是
 H++OH-,常温下,Kw 的数值为 1×10-14.下列说法不正确的是
H++OH-,常温下,Kw 的数值为 1×10-14.下列说法不正确的是| A.常温下,水电离出的 c(H+)=c(OH-)=10-7mol·L-1 |
| B.向水中加入NaCl,H+与 Cl-结合生成 HCl,使水的电离平衡向正反应方向移动 |
| C.向水中加入HCl或者NaOH,水的电离平衡都向逆反应方向移动 |
| D.改变温度,Kw 也会发生改变 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】NA是阿伏加德罗常数的值,下列说法正确的是
| A.20gD216O含中子数目为9NA |
| B.1molN2H4含极性键数目为4NA |
| C.50mL2mol/LCH3COONa溶液中,阴离子的数目小于0.1NA |
| D.2.24LCl2与足量NaOH溶液反应,转移电子的数目为0.2NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列各组离子在指定溶液中一定能大量共存的是
①pH=0的溶液:Na+、Cl-、MnO 、SO
、SO 、HCO
、HCO
②pH=11的溶液中:CO 、Na+、AlO
、Na+、AlO 、NO
、NO 、S2-、SO
、S2-、SO
③水电离的H+浓度c(H+)=10-12mol/L的溶液中:Cl-、CO 、NO
、NO 、NH
、NH 、SO
、SO
④加入Mg能放出H2的溶液中:Mg2+、NH 、Cl-、K+、SO
、Cl-、K+、SO
⑤使石蕊变红的溶液中:Fe2+、MnO 、NO
、NO 、Na+、SO
、Na+、SO
⑥中性溶液中:Fe3+、Al3+、NO 、I-、Cl-、S2-
、I-、Cl-、S2-
①pH=0的溶液:Na+、Cl-、MnO
 、SO
、SO 、HCO
、HCO
②pH=11的溶液中:CO
 、Na+、AlO
、Na+、AlO 、NO
、NO 、S2-、SO
、S2-、SO
③水电离的H+浓度c(H+)=10-12mol/L的溶液中:Cl-、CO
 、NO
、NO 、NH
、NH 、SO
、SO
④加入Mg能放出H2的溶液中:Mg2+、NH
 、Cl-、K+、SO
、Cl-、K+、SO
⑤使石蕊变红的溶液中:Fe2+、MnO
 、NO
、NO 、Na+、SO
、Na+、SO
⑥中性溶液中:Fe3+、Al3+、NO
 、I-、Cl-、S2-
、I-、Cl-、S2-| A.②④ | B.①③⑥ | C.①②⑤ | D.①②④ |
您最近一年使用:0次






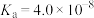
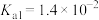

 溶液中通入过量
溶液中通入过量 :
: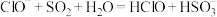
 :
: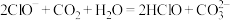
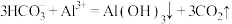
 溶液中加入少量
溶液中加入少量 溶液:
溶液:


