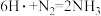甲醇和水蒸气在Cu/ZnO/Al2O3催化剂下发生重整制氢反应:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g) △H=+49.5kJ∙mol-1。下列说法正确的是
| A.正反应的活化能比逆反应的活化能低 |
| B.恒压条件下充入Ne,有利于提高甲醇平衡转化率 |
| C.增大CH3OH浓度使平衡正向移动,平衡常数增大 |
| D.当混合体系密度恒定时,反应达到平衡状态 |
更新时间:2024-01-22 15:35:22
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列有关说法正确的是
A.反应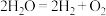 在任何条件下都不会自发进行 在任何条件下都不会自发进行 |
B.溶液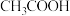 加水稀释后,溶液中 加水稀释后,溶液中 的值减小 的值减小 |
| C.温度升高,反应物的活化分子数增多,主要因素是分子的运动加快,反应速率加快 |
D. 液中加入少量 液中加入少量 固体, 固体,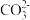 水解程度减小,溶液的pH减小 水解程度减小,溶液的pH减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法不正确的是( )
| A.增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增加 |
| B.有气体参加的化学反应,若增大压强(缩小反应容器的体积),可增大活化分子百分数,从而使反应速率增大 |
| C.升高温度能使化学反应速率增大的主要原因是增大了反应物分子中活化分子百分数 |
| D.催化剂能增大活化分子百分数,从而增大反应速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】在一个绝热的恒容密闭容器中通入A(g)和B(g),一定条件下发生反应aA(g)+bB(g) cC(g)+dD(g) △H,a+b=c+d。忽略其它副反应,该反应的正反应速率随时间的变化关系如图所示,下列说法正确的是
cC(g)+dD(g) △H,a+b=c+d。忽略其它副反应,该反应的正反应速率随时间的变化关系如图所示,下列说法正确的是

 cC(g)+dD(g) △H,a+b=c+d。忽略其它副反应,该反应的正反应速率随时间的变化关系如图所示,下列说法正确的是
cC(g)+dD(g) △H,a+b=c+d。忽略其它副反应,该反应的正反应速率随时间的变化关系如图所示,下列说法正确的是
| A.△H>0 | B.15秒时反应恰好达到平衡 |
| C.p点处容器内的压强最大 | D.10秒时C的物质的量浓度与20秒时不相等 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】一定条件下,向2 L恒容恒温密闭容器中充入1 mol CO2和2.8 mol H2,发生反应:CO2(g)+3H2(g)⇌ H2O(g)+CH3OH(g) ΔH=-53.7 kJ∙mol−1,I、Ⅱ是在两种不同催化剂作用下建立平衡过程中,CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确 的是


| A.活化能:过程I >过程Ⅱ |
| B.m点:正反应速率>逆反应速率 |
| C.n点时该反应的平衡常数K=200 |
| D.t2时刻改变的反应条件可能是升高温度 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.在高温、高压和催化剂条件下,密闭容器中2 g H2与足量N2反应,转移电子数为2NA |
| B.92 g NO2与N2O4的混合气体中含有的原于总数为6NA |
| C.4.5 g SiO2晶体中含有的硅氧键的数目为0.3NA |
| D.常温常压下,1.7 g NH3中含有共价键的数目为0.3NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
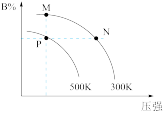
【推荐1】某实验室研究工业制硫酸的过程中发现,原理为 。原料体
。原料体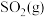 、
、 和
和 起始的物质的分数分别为
起始的物质的分数分别为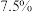 、
、 和
和 时,在
时,在 、
、 、
、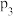 压强下,
压强下, 平衡转化率
平衡转化率 随温度的变化如图所示。下列说法不正确的是
随温度的变化如图所示。下列说法不正确的是

 。原料体
。原料体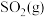 、
、 和
和 起始的物质的分数分别为
起始的物质的分数分别为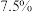 、
、 和
和 时,在
时,在 、
、 、
、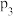 压强下,
压强下, 平衡转化率
平衡转化率 随温度的变化如图所示。下列说法不正确的是
随温度的变化如图所示。下列说法不正确的是
A. |
| B.该研究的原料气体可能是将硫在过量空气中燃烧后的气体 |
C.其他条件不变时,保持容器体积不变将 排出, 排出, 值会下降 值会下降 |
D.从图像可知,影响 的因素有压强和温度 的因素有压强和温度 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】可以利用 反应制备H2和CO,下列说法正确的是
反应制备H2和CO,下列说法正确的是
 反应制备H2和CO,下列说法正确的是
反应制备H2和CO,下列说法正确的是| A.该反应△S>0 |
B.反应的平衡常数表达式为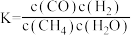 |
| C.上述反应中消耗1molCH4,转移电子的数目约为2×6.02×1023 |
| D.其他条件相同时,增大压强,可以提高CH4的平衡转化率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】下列实验中,依据实验操作及现象,得出的结论正确的是
| 操作 | 现象 | 结论 | |
| A | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| B | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2(g) N2O4(g);ΔH<0 N2O4(g);ΔH<0 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 上层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| D | 向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中一定含有CO32-或SO32- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图转化: 。该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反);k(正)和k(逆)分别称作正、逆反应速率常数,它们受温度和催化剂影响。下列说法正确的是
。该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反);k(正)和k(逆)分别称作正、逆反应速率常数,它们受温度和催化剂影响。下列说法正确的是
 。该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反);k(正)和k(逆)分别称作正、逆反应速率常数,它们受温度和催化剂影响。下列说法正确的是
。该反应的速率方程可表示为:v(正)=k(正)·c(顺)和v(逆)=k(逆)·c(反);k(正)和k(逆)分别称作正、逆反应速率常数,它们受温度和催化剂影响。下列说法正确的是A.某温度时,该反应的平衡常数可表示为 |
| B.正、逆反应速率常数改变,平衡常数也一定会随之改变 |
| C.若升高温度,平衡逆向移动,则说明正反应的活化能高于逆反应的活化能 |
| D.催化剂改变反应速率但不影响平衡,说明催化剂同等程度改变k(正)和k(逆) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

Ⅲ.
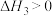
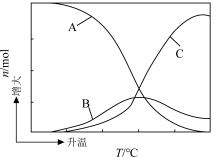
向恒压、密闭容器中通入1mol 和3mol
和3mol 发生上述反应,平衡时
发生上述反应,平衡时 、CO、
、CO、 的物质的量随温度的变化如图所示。下列说法正确的是
的物质的量随温度的变化如图所示。下列说法正确的是
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.


Ⅱ.


Ⅲ.

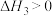
向恒压、密闭容器中通入1mol
 和3mol
和3mol 发生上述反应,平衡时
发生上述反应,平衡时 、CO、
、CO、 的物质的量随温度的变化如图所示。下列说法正确的是
的物质的量随温度的变化如图所示。下列说法正确的是
A.反应Ⅰ平衡常数可表示为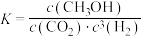 |
| B.图中曲线B表示CO的物质的量随温度的变化 |
C.某时刻 为a mol,CO为b mol,此时 为a mol,CO为b mol,此时 为 为 |
D.为提高 的平衡产率,需要选择低温、低压的反应条件 的平衡产率,需要选择低温、低压的反应条件 |
您最近一年使用:0次

 基催化剂表面,
基催化剂表面, 还原合成
还原合成 有以下两种途径,如图所示。下列说法
有以下两种途径,如图所示。下列说法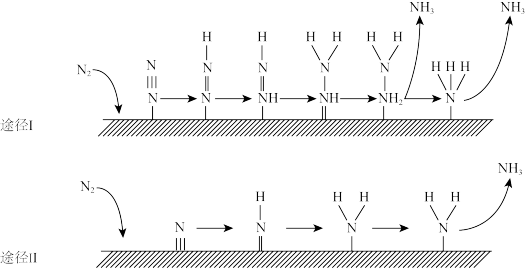
 键
键