探索 和
和 这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
I.CO可以与 反应制备合成天然气(SNG)。涉及反应如下:
反应制备合成天然气(SNG)。涉及反应如下:
 甲烷化:
甲烷化:
水煤气变换:
(1)反应 的
的
___________  。分别在
。分别在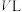 恒温密闭容器
恒温密闭容器 (恒容)、B(恒压,容积可变)中,加入
(恒容)、B(恒压,容积可变)中,加入 和
和 的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是
的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是___________ (填“A”或“B”)。
II. 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 。该反应达到平衡后,升高温度可使体系颜色加深。
。该反应达到平衡后,升高温度可使体系颜色加深。
(2)已知该反应的正反应速率方程为v正=k正·c2(NO2),逆反应速率方程为v逆=k逆c·(N2O4),其中k正、k逆分别为正、逆反应的速率常数。如图(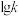 表示速率常数的对数:
表示速率常数的对数: 表示温度的倒数)所示①、②、③、④四条斜线中,
表示温度的倒数)所示①、②、③、④四条斜线中, 随
随 变化关系的是斜线③,则
变化关系的是斜线③,则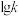 逆随
逆随 变化关系的是斜线
变化关系的是斜线___________ 。

(3)图中A、B、C、D点的纵坐标分别为 ,则
,则 温度时该反应的化学平衡常数
温度时该反应的化学平衡常数
___________  。已知
。已知 温度时,某时刻恒容密闭容器中
温度时,某时刻恒容密闭容器中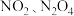 浓度均为
浓度均为 ,此时v正
,此时v正___________ v逆。(填“>”、“=”或“<”)
(4)工业上利用 溶液吸收
溶液吸收 气体,发生反应:
气体,发生反应: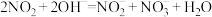 。
。 空间结构为
空间结构为___________ ,比较 与
与 的键角大小,并解释原因:
的键角大小,并解释原因:___________ 。
 和
和 这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:I.CO可以与
 反应制备合成天然气(SNG)。涉及反应如下:
反应制备合成天然气(SNG)。涉及反应如下: 甲烷化:
甲烷化:
水煤气变换:

(1)反应
 的
的
 。分别在
。分别在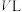 恒温密闭容器
恒温密闭容器 (恒容)、B(恒压,容积可变)中,加入
(恒容)、B(恒压,容积可变)中,加入 和
和 的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是
的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是II.
 可发生二聚反应生成
可发生二聚反应生成 ,化学方程式为
,化学方程式为 。该反应达到平衡后,升高温度可使体系颜色加深。
。该反应达到平衡后,升高温度可使体系颜色加深。(2)已知该反应的正反应速率方程为v正=k正·c2(NO2),逆反应速率方程为v逆=k逆c·(N2O4),其中k正、k逆分别为正、逆反应的速率常数。如图(
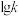 表示速率常数的对数:
表示速率常数的对数: 表示温度的倒数)所示①、②、③、④四条斜线中,
表示温度的倒数)所示①、②、③、④四条斜线中, 随
随 变化关系的是斜线③,则
变化关系的是斜线③,则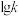 逆随
逆随 变化关系的是斜线
变化关系的是斜线
(3)图中A、B、C、D点的纵坐标分别为
 ,则
,则 温度时该反应的化学平衡常数
温度时该反应的化学平衡常数
 。已知
。已知 温度时,某时刻恒容密闭容器中
温度时,某时刻恒容密闭容器中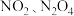 浓度均为
浓度均为 ,此时v正
,此时v正(4)工业上利用
 溶液吸收
溶液吸收 气体,发生反应:
气体,发生反应: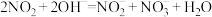 。
。 空间结构为
空间结构为 与
与 的键角大小,并解释原因:
的键角大小,并解释原因:
更新时间:2024-01-29 11:48:57
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】I、
(1)已知:
C(石墨,s)+O2(g)=CO2(g) ΔH1=-akJ∙mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-bkJ∙mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-ckJ∙mol-1
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成1molC2H2(g)反应的焓变ΔH=___________ (用含有a,b,c的式子表示)
II、一定温度下,向容积为2L的恒容密闭容器中加入等物质的量的H2和I2,发生反应H2(g)+I2(g)⇌2HI(g)ΔH<0.测得不同反应时间容器内H2的物质的量如表;
回答下列问题:
(2)0~20min内HI的平均反应速率为___________ 。
(3)反应达到化学平衡状态时,I2的转化率为___________ ,容器内HI的体积分数为___________ 。
(4)该条件下,能说明上述反应达到化学平衡状态的是___________。(填标号)
(5)该反应在三种不同情况下的化学反应速率分别为:①v(H2)=0.02mol·L-1·s-1,②v(I2)=0.32mol·L-1·min-1,③v(HI)=0.84mol·L-1·min-1.则反应进行的速率由快到慢的顺序为___________ 。
(1)已知:
C(石墨,s)+O2(g)=CO2(g) ΔH1=-akJ∙mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-bkJ∙mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-ckJ∙mol-1
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成1molC2H2(g)反应的焓变ΔH=
II、一定温度下,向容积为2L的恒容密闭容器中加入等物质的量的H2和I2,发生反应H2(g)+I2(g)⇌2HI(g)ΔH<0.测得不同反应时间容器内H2的物质的量如表;
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(H2)/mol | 1 | 0.75 | 0.65 | 0.6 | 0.6 |
(2)0~20min内HI的平均反应速率为
(3)反应达到化学平衡状态时,I2的转化率为
(4)该条件下,能说明上述反应达到化学平衡状态的是___________。(填标号)
| A.混合气体颜色不再改变 |
| B.容器内压强不再改变 |
| C.H2、I2、HI三种气体体积分数不再改变 |
| D.混合气体密度不再改变 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】(1)标准摩尔生成焓是指由稳态单质生成1mol该化合物的焓变,25℃时几种物质的标准生成焓如下:
ⅰ.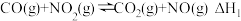
ⅱ.
①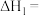
___________ ;CO还原 生成两种无污染的气态物质的热化学方程式为
生成两种无污染的气态物质的热化学方程式为___________ 。
②运用化学反应原理分析,反应过程中 的转化率随温度升高先增大后减小的原因是
的转化率随温度升高先增大后减小的原因是___________ 。
(2)在催化剂Rh表面CO还原NO基元反应机理路径如图a表示,两个N(s)结合生成的 称为
称为 ,
,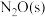 解离生成的
解离生成的 称为
称为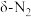 ,基元反应速率随温度的变化关系如图b所示。
,基元反应速率随温度的变化关系如图b所示。
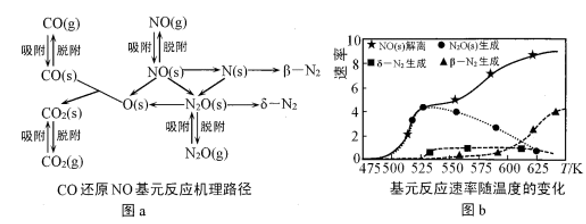
下列说法正确的是___________ (填字母)。
A.在催化剂表面NO的吸附并解离是反应发生的先决条件
B.在催化剂表面 的及时脱附有利于反应的进行
的及时脱附有利于反应的进行
C.当温度超过625K时,生成的 主要是由CO还原
主要是由CO还原 生成的
生成的
D.当温度低于530K时,发生的主要反应为
E.寻找低温下高效的催化剂控制汽车尾气的污染是未来研究的方向
(3)已知对于反应ⅱ: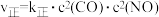 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
①既要加快NO的消除速率,又要消除更多的NO,可采取措施有___________ (写出其中一条即可)。
②达到平衡后,只升高温度, 增大的倍数
增大的倍数___________ (填“>”、“<”或“=”) 增大的倍数。若在1L恒容密闭容器中充入1molCO和1moLNO发生上述反应,在一定温度下反应达到平衡时,CO的转化率为40%,则
增大的倍数。若在1L恒容密闭容器中充入1molCO和1moLNO发生上述反应,在一定温度下反应达到平衡时,CO的转化率为40%,则
___________ (计算结果用分数表示)。
| 物质 |  | CO |  | NO |
| 标准生成焓(kJ/mol) | 33.1 | -110.5 | -183.6 | 90.3 |
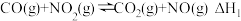
ⅱ.

①
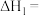
 生成两种无污染的气态物质的热化学方程式为
生成两种无污染的气态物质的热化学方程式为②运用化学反应原理分析,反应过程中
 的转化率随温度升高先增大后减小的原因是
的转化率随温度升高先增大后减小的原因是(2)在催化剂Rh表面CO还原NO基元反应机理路径如图a表示,两个N(s)结合生成的
 称为
称为 ,
,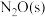 解离生成的
解离生成的 称为
称为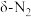 ,基元反应速率随温度的变化关系如图b所示。
,基元反应速率随温度的变化关系如图b所示。
下列说法正确的是
A.在催化剂表面NO的吸附并解离是反应发生的先决条件
B.在催化剂表面
 的及时脱附有利于反应的进行
的及时脱附有利于反应的进行C.当温度超过625K时,生成的
 主要是由CO还原
主要是由CO还原 生成的
生成的D.当温度低于530K时,发生的主要反应为

E.寻找低温下高效的催化剂控制汽车尾气的污染是未来研究的方向
(3)已知对于反应ⅱ:
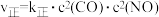 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。①既要加快NO的消除速率,又要消除更多的NO,可采取措施有
②达到平衡后,只升高温度,
 增大的倍数
增大的倍数 增大的倍数。若在1L恒容密闭容器中充入1molCO和1moLNO发生上述反应,在一定温度下反应达到平衡时,CO的转化率为40%,则
增大的倍数。若在1L恒容密闭容器中充入1molCO和1moLNO发生上述反应,在一定温度下反应达到平衡时,CO的转化率为40%,则
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】开发新能源是解决环境污染的重要举措,其中甲醇、乙醇、甲烷都是优质的清洁燃料,可制作燃料电池。
(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:______________________ 。
(2)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
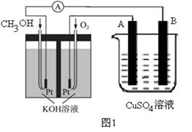
①写出燃料电池负极的电极反应式_________________ 。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是_______ 极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为________ L。
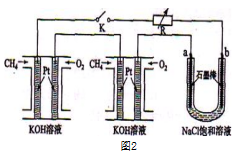
(3)某研究小组将两个甲烷燃料电池串联后如上图2作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量表达式为_____________ (法拉第常数F=9.65×l04C/ mol),最多能产生的氯气体积为_____ L(标准状况)。
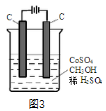
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+在阳极氧化成Co3+,生成的Co3+将甲醇氧化成CO2和H+(用石墨烯除去Co2+),现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为________________________ 除去甲醇的离子方程式为______________________________ 。
(1)已知:①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH1=-1366.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ/mol
③H2O(g)=H2O(l) ΔH3=-44 kJ/mol。
乙醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:
(2)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。

①写出燃料电池负极的电极反应式
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是
(3)某研究小组将两个甲烷燃料电池串联后如上图2作为电源,进行饱和氯化钠溶液电解实验若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量表达式为

(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+在阳极氧化成Co3+,生成的Co3+将甲醇氧化成CO2和H+(用石墨烯除去Co2+),现用如图3所示装置模拟上述过程,则Co2+在阳极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】我国力争于2030年前做到碳达峰,2060年前实现碳中和,因此CO2的综合利用是研究热点之一。
(1)以CO2为原料可制取甲醇。.
已知:①H2(g)、CH3OH(l)的燃烧热△H分别为-285.8kJ/mol和-726.5kJ/mol;
②CH3OH(l)=CH3OH(g)△H=+38kJ/mol;
③H2O(l)=H2O(g)△H=+44kJ/mol;
则反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的△H=
CH3OH(g)+H2O(g)的△H=____ kJ/mol。
(2)利用CO2与H2合成甲醇涉及的主要反应如下:
a.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
b.CO2(g)+H2(g) CO(g)+H2O(g)△H=+41kJ/mol
CO(g)+H2O(g)△H=+41kJ/mol
一定条件下向某刚性容器中充入物质的量之比为1:3的CO2和H2发生上述反应,在不同催化剂(Cat.1,Cat.2)下经相同反应时间,CO2的转化率和甲醇的选择性[甲醇的选择性= ×100%]随温度的变化如图所示:
×100%]随温度的变化如图所示:
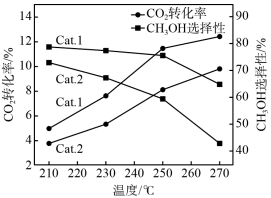
①由图可知,催化效果Cat.1____ Cat.2(填“>”“<”或“=”)。
②在210—270℃间,CH3OH的选择性随温度的升高而下降,可能原因为____ (写出一条即可)。
③某条件下,达到平衡时CO2的转化率为15%,CH3OH的选择性为80%,则H2的平衡转化率为___ ;反应b的平衡常数Kp=____ 。
(3)利用制备的甲醇可以催化制取丙烯,过程中发生如下反应:3CH3OH(g) C3H6(g)+3H2O(g)该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g)该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-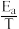 +C(Ea为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。则该反应的活化能Ea=
+C(Ea为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。则该反应的活化能Ea=___ kJ/mol。当改变外界条件时,实验数据如图中的曲线b所示,则实验可能改变的外界条件是____ ;此经验公式说明对于某个基元反应,当升高相同温度时,其活化能越大,反应速率增大的就____ (填“越多”或“越少”)。

(1)以CO2为原料可制取甲醇。.
已知:①H2(g)、CH3OH(l)的燃烧热△H分别为-285.8kJ/mol和-726.5kJ/mol;
②CH3OH(l)=CH3OH(g)△H=+38kJ/mol;
③H2O(l)=H2O(g)△H=+44kJ/mol;
则反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)的△H=
CH3OH(g)+H2O(g)的△H=(2)利用CO2与H2合成甲醇涉及的主要反应如下:
a.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△Hb.CO2(g)+H2(g)
 CO(g)+H2O(g)△H=+41kJ/mol
CO(g)+H2O(g)△H=+41kJ/mol一定条件下向某刚性容器中充入物质的量之比为1:3的CO2和H2发生上述反应,在不同催化剂(Cat.1,Cat.2)下经相同反应时间,CO2的转化率和甲醇的选择性[甲醇的选择性=
 ×100%]随温度的变化如图所示:
×100%]随温度的变化如图所示:
①由图可知,催化效果Cat.1
②在210—270℃间,CH3OH的选择性随温度的升高而下降,可能原因为
③某条件下,达到平衡时CO2的转化率为15%,CH3OH的选择性为80%,则H2的平衡转化率为
(3)利用制备的甲醇可以催化制取丙烯,过程中发生如下反应:3CH3OH(g)
 C3H6(g)+3H2O(g)该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g)该反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为Rlnk=-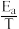 +C(Ea为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。则该反应的活化能Ea=
+C(Ea为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。则该反应的活化能Ea=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】CO2和CH4是两种重要的温室气体,将CH4和CO2作为原料制造更高价值化学品是目前的研究目标。现有以下几种利用方法:
(1)合成气法:200℃时,以镍合金为催化剂,向4 L容器中通入4 mol CO2、4 mol CH4发生如下反应: CO2(g)+CH4(g)⇌2CO(g)+2H2(g) ∆H=+247 k/mol。平衡体系中各组分体积分数如下表:
①此温度下该反应的平衡常数K=_______ 。
②为了探究反应CO2(g)+CH4(g) ⇌2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol/L,为探究速率与浓度的关系,根据相关数据,粗略地绘制出两条速率-浓度关系曲线(如图):
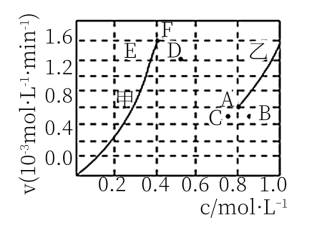
 正(CH4)-c(CH4)和
正(CH4)-c(CH4)和 逆(CO)-c(CO),则与
逆(CO)-c(CO),则与 正(CH4)-c(CH4)相对应的是图中
正(CH4)-c(CH4)相对应的是图中_______ 曲线(填“甲”或“乙”);该反应达到平衡后, 某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为_______ (填“D”“E”或“F”)。
③反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应又使积碳量减少,一定时间内积碳量和反应温度的关系如图。
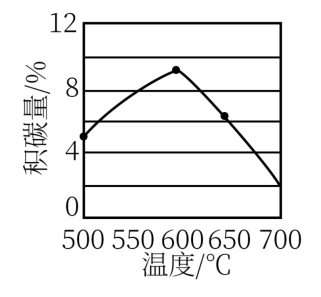
积碳反应:CH4(g)⇌C(s)+2H2(g) ∆H=+75 k/mol
消碳反应:CO2(g)+C(s)⇌2CO(g) ∆H =+172 k/mol
温度高于600°C,积碳量减少的可能原因为_______ 。
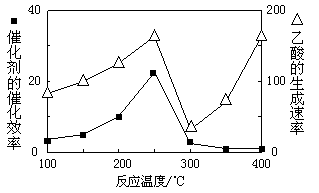
(2)直接转化法:以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。当温度在_______ 范围时,温度是乙酸生成速率的主要影响因素。
(3)吸收法:Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2,原理:在500℃,CO2与Li4SiO4接触后生成Li2CO3平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是_______ 。
(4)可燃冰置换法:一定条件下,CH4、CO2都能与H2O形成如图笼状结构的水合物晶体,相关参数见表。
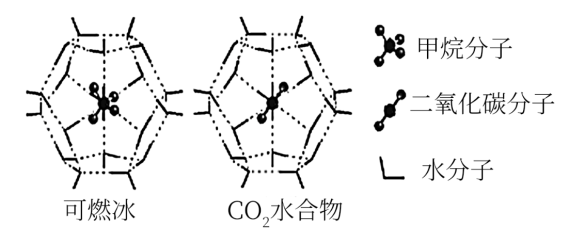
CH4与H2O形成的水合物晶体俗称“可燃冰”。为开采深海海底的“可燃冰”,科学家提出用CO2置换CH4的设想。已如图中笼状结构的空腔直径为0.586 nm,从物质结构及性质的角度分析,该设想的依据是_______ 。
(1)合成气法:200℃时,以镍合金为催化剂,向4 L容器中通入4 mol CO2、4 mol CH4发生如下反应: CO2(g)+CH4(g)⇌2CO(g)+2H2(g) ∆H=+247 k/mol。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.3 | 0.3 | 0.2 | 0.2 |
①此温度下该反应的平衡常数K=
②为了探究反应CO2(g)+CH4(g) ⇌2CO(g)+2H2(g)的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2与CH4,使其物质的量浓度均为1.0 mol/L,为探究速率与浓度的关系,根据相关数据,粗略地绘制出两条速率-浓度关系曲线(如图):

 正(CH4)-c(CH4)和
正(CH4)-c(CH4)和 逆(CO)-c(CO),则与
逆(CO)-c(CO),则与 正(CH4)-c(CH4)相对应的是图中
正(CH4)-c(CH4)相对应的是图中③反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应又使积碳量减少,一定时间内积碳量和反应温度的关系如图。

积碳反应:CH4(g)⇌C(s)+2H2(g) ∆H=+75 k/mol
消碳反应:CO2(g)+C(s)⇌2CO(g) ∆H =+172 k/mol
温度高于600°C,积碳量减少的可能原因为
(2)直接转化法:以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。当温度在

(3)吸收法:Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2,原理:在500℃,CO2与Li4SiO4接触后生成Li2CO3平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是
(4)可燃冰置换法:一定条件下,CH4、CO2都能与H2O形成如图笼状结构的水合物晶体,相关参数见表。

参数 分子 | 分子直径 | 分子与H2O的结合能(∆H/kJ/mol) |
| CH4 | 0.436 | -16.40 |
| CO2 | 0.512 | -29.91 |
CH4与H2O形成的水合物晶体俗称“可燃冰”。为开采深海海底的“可燃冰”,科学家提出用CO2置换CH4的设想。已如图中笼状结构的空腔直径为0.586 nm,从物质结构及性质的角度分析,该设想的依据是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】H2S的转化是资源利用和环境保护的重要研究课题。
(1)通过电化学循环法可将H2S转化为H2SO4和H2(如图1所示)。其中氧化过程发生如下两步反应:H2S+H2SO4=SO2↑+S↓+2H2O、S+O2=SO2。

①电极a上发生反应的电极反应式为_____ 。
②理论上1molH2S参加反应可产生H2的物质的量为_____ 。
(2)表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用图2表示。其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。

①图2中表示活性炭催化氧化H2S的机理可描述为,活性炭吸附喷淋的水后形成一层水膜,溶解在水膜中的O2在活性炭表面形成活性氧O;_____ 。
②适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是_____ 。
③若水膜过厚,H2S的氧化去除率减小的原因是_____ 。
(3)Fe2O3可用作脱除H2S气体的脱硫剂。H2S首先与表面的Fe2O3产生疏松多孔的产物FeS,随着反应的进行,Fe2O3不断减少,产物层不断加厚,可用图3所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。

①实验表明用Fe2O3脱除纯H2S反应一段时间后,因为产生的S单质将疏松FeS堵塞,反应速率明显减小。Fe2O3与H2S反应的化学方程式为_____ 。
②“再生”时若O2浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是_____ 。
(1)通过电化学循环法可将H2S转化为H2SO4和H2(如图1所示)。其中氧化过程发生如下两步反应:H2S+H2SO4=SO2↑+S↓+2H2O、S+O2=SO2。

①电极a上发生反应的电极反应式为
②理论上1molH2S参加反应可产生H2的物质的量为
(2)表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用图2表示。其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。

①图2中表示活性炭催化氧化H2S的机理可描述为,活性炭吸附喷淋的水后形成一层水膜,溶解在水膜中的O2在活性炭表面形成活性氧O;
②适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是
③若水膜过厚,H2S的氧化去除率减小的原因是
(3)Fe2O3可用作脱除H2S气体的脱硫剂。H2S首先与表面的Fe2O3产生疏松多孔的产物FeS,随着反应的进行,Fe2O3不断减少,产物层不断加厚,可用图3所示。失效的脱硫剂可在氧气中加热重新转化为Fe2O3实现“再生”。

①实验表明用Fe2O3脱除纯H2S反应一段时间后,因为产生的S单质将疏松FeS堵塞,反应速率明显减小。Fe2O3与H2S反应的化学方程式为
②“再生”时若O2浓度过大、反应温度过高,“再生”后的脱硫剂脱硫效果明显变差的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】党的二十大报告指出,要积极稳妥推进碳达峰、碳中和。二氧化碳的捕集、利用与封存(CCUS)已成为科学家研究的重要课题。
I.工业上用 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯:
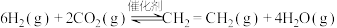

已知:
①
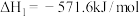
②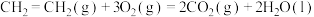
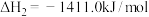
③
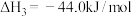
(1)
________ ,该反应能够自发进行的条件是________ (填“低温”、“高温”或“任何温度”)。
(2)恒温恒容下,向密闭容器按投料比 通入原料气,能判断该反应处于平衡状态的是________(填标号)。
通入原料气,能判断该反应处于平衡状态的是________(填标号)。
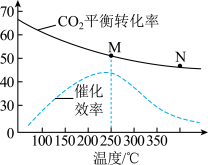
(3)向密闭容器按投料比 通入原料气,不同温度对
通入原料气,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强P(M)
的平衡转化率和催化剂催化效率的影响如图所示,则压强P(M)________ P(N),原因是:________ 。
II. 催化加氢可以直接合成二甲醚。涉及以下主要反应:
催化加氢可以直接合成二甲醚。涉及以下主要反应:
①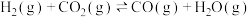

②

恒压条件下, 、起始量相等时,
、起始量相等时, 的平衡转化率和的选择性随温度变化如图所示。已知:的选择性
的平衡转化率和的选择性随温度变化如图所示。已知:的选择性
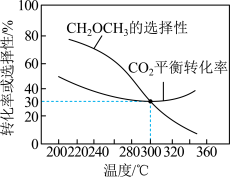
(4)300℃时,通入 、
、 各0.5mol,平衡时
各0.5mol,平衡时 的选择性、
的选择性、 的平衡转化率均为30%,则此温度下反应①的平衡常数
的平衡转化率均为30%,则此温度下反应①的平衡常数
________ (保留2位有效数字)。
(5)温度高于300℃, 的平衡转化率随温度升高而增大的原因可能是
的平衡转化率随温度升高而增大的原因可能是________ 。
III.电化学法也可还原二氧化碳制乙烯,原理如图所示。
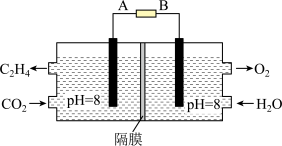
(6)该电池的阴极电极反应式为:________ 。
I.工业上用
 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: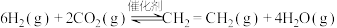

已知:
①

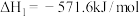
②
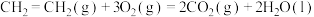
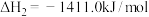
③

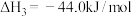
(1)

(2)恒温恒容下,向密闭容器按投料比
 通入原料气,能判断该反应处于平衡状态的是________(填标号)。
通入原料气,能判断该反应处于平衡状态的是________(填标号)。A. |
| B.混合气体的密度保持不变 |
| C.混合气体的平均相对分子质量保持不变 |
D.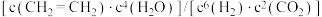 保持不变 保持不变 |
 通入原料气,不同温度对
通入原料气,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强P(M)
的平衡转化率和催化剂催化效率的影响如图所示,则压强P(M)
II.
 催化加氢可以直接合成二甲醚。涉及以下主要反应:
催化加氢可以直接合成二甲醚。涉及以下主要反应:①
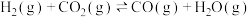

②


恒压条件下,
 、起始量相等时,
、起始量相等时, 的平衡转化率和的选择性随温度变化如图所示。已知:的选择性
的平衡转化率和的选择性随温度变化如图所示。已知:的选择性

(4)300℃时,通入
 、
、 各0.5mol,平衡时
各0.5mol,平衡时 的选择性、
的选择性、 的平衡转化率均为30%,则此温度下反应①的平衡常数
的平衡转化率均为30%,则此温度下反应①的平衡常数
(5)温度高于300℃,
 的平衡转化率随温度升高而增大的原因可能是
的平衡转化率随温度升高而增大的原因可能是III.电化学法也可还原二氧化碳制乙烯,原理如图所示。

(6)该电池的阴极电极反应式为:
您最近一年使用:0次
【推荐2】丙烯是一种重要的化工原料,但丙烯的产是仅通过石油的催化裂解反应无法满足工业生产需求。工业上,有如下方法制备丙烯:
Ⅰ.丙烷脱氢法制丙烯:
①丙烷无氧脱氢法: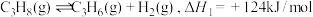
②丙烷氧化脱氢法: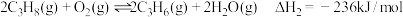
(1)反应②的正反应活化能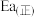
______ 逆反应活化能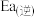 (填“>”或“<”)。
(填“>”或“<”)。
(2)不同压强下,向密闭容器中充入 气体发生反应①,丙烷平衡转化率随温度变化关系如图:在
气体发生反应①,丙烷平衡转化率随温度变化关系如图:在 、
、 条件下,若向密闭容器中充入
条件下,若向密闭容器中充入 和
和 的混合气体,则平衡时丙烷转化率
的混合气体,则平衡时丙烷转化率______ 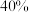 (填“>”或“=”或“<”)。
(填“>”或“=”或“<”)。
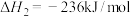 的机理,下列说法正确的是______(填字母)。
的机理,下列说法正确的是______(填字母)。
(4)丙烯是一种燃料,以熔融碳酸盐(用 表示)为电解质,丙烯——空气燃料电池的负极的电极反应式
表示)为电解质,丙烯——空气燃料电池的负极的电极反应式______ 。
Ⅱ.丁烯和乙烯的催化反应制丙烯:
主反应:
副反应: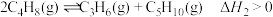
(5)乙烯的电子式为______ 。
(6)某温度下,保持体系总压强为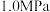 ,按
,按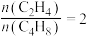 投料,达平衡状态时,
投料,达平衡状态时, 、
、 的转化率分别为
的转化率分别为 、
、 ,则平衡时
,则平衡时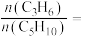
______ ;主反应的压强平衡常数
______ (保留一位小数)。
Ⅰ.丙烷脱氢法制丙烯:
①丙烷无氧脱氢法:
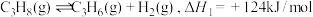
②丙烷氧化脱氢法:
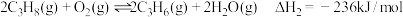
(1)反应②的正反应活化能
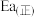
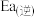 (填“>”或“<”)。
(填“>”或“<”)。(2)不同压强下,向密闭容器中充入
 气体发生反应①,丙烷平衡转化率随温度变化关系如图:在
气体发生反应①,丙烷平衡转化率随温度变化关系如图:在 、
、 条件下,若向密闭容器中充入
条件下,若向密闭容器中充入 和
和 的混合气体,则平衡时丙烷转化率
的混合气体,则平衡时丙烷转化率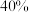 (填“>”或“=”或“<”)。
(填“>”或“=”或“<”)。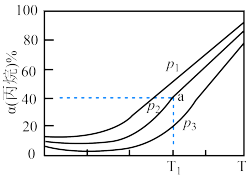

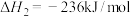 的机理,下列说法正确的是______(填字母)。
的机理,下列说法正确的是______(填字母)。
A.该机理中,有 键、 键、 键的断裂与形成 键的断裂与形成 |
B.若有 参与反应,最终 参与反应,最终 存在于羰基催化剂和 存在于羰基催化剂和 中 中 |
C.若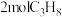 和 和 充分反应,则可制得 充分反应,则可制得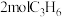 |
| D.为了提高反应的速率和反应物转化率,温度越高越好 |
(4)丙烯是一种燃料,以熔融碳酸盐(用
 表示)为电解质,丙烯——空气燃料电池的负极的电极反应式
表示)为电解质,丙烯——空气燃料电池的负极的电极反应式Ⅱ.丁烯和乙烯的催化反应制丙烯:
主反应:

副反应:
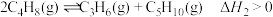
(5)乙烯的电子式为
(6)某温度下,保持体系总压强为
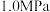 ,按
,按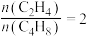 投料,达平衡状态时,
投料,达平衡状态时, 、
、 的转化率分别为
的转化率分别为 、
、 ,则平衡时
,则平衡时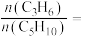

您最近一年使用:0次
【推荐3】甲醇是重要的有机化工原料,在能源紧张的今天,甲醇的需求也在增大。甲醇的一种合成方法是:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0
(1)①在恒温恒容的密闭容器中,能判断上述反应达到平衡状态的依据是___________ (填字母)。
a.CH3OH的浓度不再发生变化
b.生成CH3OH的速率与消耗CO的速率相等
c.氢气的体积分数保持不变
d.混合气体的密度不变
②反应达到平衡后,改变反应的某一个条件,下列变化能说明平衡一定向逆反应方向移动的是____ (填字母)。
a.正反应速率先增大后减小
b.逆反应速率先增大后减小
c.化学平衡常数K值减小
d.氢气的平衡转化率减小
(2)某温度下,将1.0molCO与2.0molH2充入2L的恒容密闭容器中发生反应,在第5min时达到平衡状态,此时甲醇的物质的量分数为10%。若在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化如图所示。从反应开始到5min内,生成甲醇的速率为_________ ,H2的平衡转化率α=_____ %。比较甲醇在7~8min、12~13min和25~27min内平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示]的大小_____ 。

(3)恒压条件下,将1.0molCO与2.0molH2充入2L的恒压密闭容器中发生反应,实验测得CO的平衡转化率与压强、温度的关系如图所示:

①由图象可知,a_____ (填“>”“<”或“=”)10。300℃、aMPa时用分压表示的平衡常数Kp=_____ (分压=总压×物质的量分数,用含a的式子表示)。
②在B点对反应容器降温的同时缩小容器体积,重新达到的平衡状态可能是图中A~E点中的_____ 点。
(1)①在恒温恒容的密闭容器中,能判断上述反应达到平衡状态的依据是
a.CH3OH的浓度不再发生变化
b.生成CH3OH的速率与消耗CO的速率相等
c.氢气的体积分数保持不变
d.混合气体的密度不变
②反应达到平衡后,改变反应的某一个条件,下列变化能说明平衡一定向逆反应方向移动的是
a.正反应速率先增大后减小
b.逆反应速率先增大后减小
c.化学平衡常数K值减小
d.氢气的平衡转化率减小
(2)某温度下,将1.0molCO与2.0molH2充入2L的恒容密闭容器中发生反应,在第5min时达到平衡状态,此时甲醇的物质的量分数为10%。若在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化如图所示。从反应开始到5min内,生成甲醇的速率为

(3)恒压条件下,将1.0molCO与2.0molH2充入2L的恒压密闭容器中发生反应,实验测得CO的平衡转化率与压强、温度的关系如图所示:

①由图象可知,a
②在B点对反应容器降温的同时缩小容器体积,重新达到的平衡状态可能是图中A~E点中的
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)基态C原子的空间运动状态有______ 个,其未成对电子对应的电子云形状为_______ 。
(2)金刚石和石墨是碳元素的两种常见单质,下列关于这两种单质的叙述中正确的是_______ 。
A.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化。
B.两种晶体中碳碳键的键长:金刚石<石墨
C.晶体中共价键的键角:金刚石>石墨
D.晶体的熔点:金刚石<石墨
E.金刚石中只存在共价键,而石墨晶体中除共价键外还存在离子键和范德华力
(3)CO2是碳的重要化合物之一,它的某一种等电子体(A离子),实验室常用来检验Fe3+离子,写出A离子的结构式_______ ;A离子中心原子的价层电子对数是_______ 对;它的另一种等电子体CS2是一种_______ 溶剂(填“极性”或“非极性”),请说出CS2的沸点高于CO2的原因是_______ 。
(4)碳酸铯与盐酸反应可得到CsCl,CsCl晶胞是中学常见晶胞。
①该晶胞类型为_______ 。
②已知该晶体中CsCl的键长为apm,阿伏加德罗常数为NA,CsCl的摩尔质量为Mg/mol,则该晶体的密度为_______ g/cm3(用含字母a的关系式表示)
(5)孔雀石[Cu2(OH)2CO3]是自然界中一种含碳元素的重要矿物质,加热分解得CuO,CuO溶于稀硫酸得蓝色溶液,再滴加乙二胺(NH2CH2CH2NH2)溶液,溶液变为紫色。
查阅资料:①Cu2+易形成配位数为4的配合离子。②H2O和乙二胺都能与过渡金属离子形成配合离子。
孔雀石[Cu2(OH)2CO3]中各非金属元素第一电离能从小到大排序为_______ 。写出Cu2+的价层电子排布式_______ 。紫色溶液中含有铜元素形成的配离子的化学式_______ ,其中配位原子在空间形成形状为_______ 。
(1)基态C原子的空间运动状态有
(2)金刚石和石墨是碳元素的两种常见单质,下列关于这两种单质的叙述中正确的是
A.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化。
B.两种晶体中碳碳键的键长:金刚石<石墨
C.晶体中共价键的键角:金刚石>石墨
D.晶体的熔点:金刚石<石墨
E.金刚石中只存在共价键,而石墨晶体中除共价键外还存在离子键和范德华力
(3)CO2是碳的重要化合物之一,它的某一种等电子体(A离子),实验室常用来检验Fe3+离子,写出A离子的结构式
(4)碳酸铯与盐酸反应可得到CsCl,CsCl晶胞是中学常见晶胞。
①该晶胞类型为
②已知该晶体中CsCl的键长为apm,阿伏加德罗常数为NA,CsCl的摩尔质量为Mg/mol,则该晶体的密度为
(5)孔雀石[Cu2(OH)2CO3]是自然界中一种含碳元素的重要矿物质,加热分解得CuO,CuO溶于稀硫酸得蓝色溶液,再滴加乙二胺(NH2CH2CH2NH2)溶液,溶液变为紫色。
查阅资料:①Cu2+易形成配位数为4的配合离子。②H2O和乙二胺都能与过渡金属离子形成配合离子。
孔雀石[Cu2(OH)2CO3]中各非金属元素第一电离能从小到大排序为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】氮、磷、砷等元素及其化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)基态氮原子电子占据最高能级的电子云轮廓图为___________ 形,下列有关表示基态氮原子的排布图中,仅违背洪特规则的是___________ 。
A.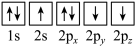 B.
B.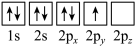
C.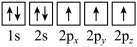 D.
D.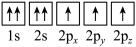
(2)肼是一种良好的火箭发射燃料,传统制备肼的方法是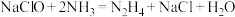 ,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
①氮、氧、钠三种元素的第一电离能由大到小的顺序为___________ 。
② 中氮原子的杂化轨道类型为
中氮原子的杂化轨道类型为___________ , 的分子构型为
的分子构型为___________ 。
⑤水分子中键角___________  中的键角(填“>”、“<”或“=”)
中的键角(填“>”、“<”或“=”)
(3)有“半导体贵族”之称的砷化镓晶体中,As、Ga原子最外电子层均达到8电子稳定结构,其晶胞如图所示,则该化合物的化学式为___________ 。该晶体中的化学键的类型有___________ 。
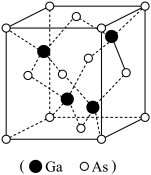
A.离子键 B.极性键 C.配位键 D.氢键
(1)基态氮原子电子占据最高能级的电子云轮廓图为
A.
 B.
B.
C.
 D.
D.
(2)肼是一种良好的火箭发射燃料,传统制备肼的方法是
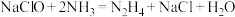 ,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。
,又知肼的熔点、沸点分别为1.4℃、113.5℃,氨气的熔点、沸点分别为-77.7℃、-33.5℃。①氮、氧、钠三种元素的第一电离能由大到小的顺序为
②
 中氮原子的杂化轨道类型为
中氮原子的杂化轨道类型为 的分子构型为
的分子构型为⑤水分子中键角
 中的键角(填“>”、“<”或“=”)
中的键角(填“>”、“<”或“=”) (3)有“半导体贵族”之称的砷化镓晶体中,As、Ga原子最外电子层均达到8电子稳定结构,其晶胞如图所示,则该化合物的化学式为

A.离子键 B.极性键 C.配位键 D.氢键
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】VA族元素原子核外电子排布有着特殊性,能与其他元素组成结构,性质各异的化合物。回答下列问题:
(1)氮原子可以提供孤电子对与氧原子形成配位键,基态氧原子的价层电子发生重排提供一个空轨道,则重排后的氧原子价电子排布图为___________ ,基态氧原子的价层电子不是重排结构,原因是不符合___________ (填“泡利不相容原理”或“洪特规则”)。
(2)沸点:
___________  (填“>”或“<”,下同),理由是:
(填“>”或“<”,下同),理由是:___________ 。键角:
___________  ,理由是:
,理由是:___________ 。
(3)As、Ge、Se三种元素的第一电离能由大到小的顺序是___________ 。
(4)基态As原子的最高能级组的电子排布式为___________ 。
(5) 晶胞中的少量Ti被Al代替后的立方晶胞结构如图所示。该晶胞中,距离Ti最近的Al有
晶胞中的少量Ti被Al代替后的立方晶胞结构如图所示。该晶胞中,距离Ti最近的Al有___________ 个;原子①与原子②的距离为___________ nm(已知晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。

(1)氮原子可以提供孤电子对与氧原子形成配位键,基态氧原子的价层电子发生重排提供一个空轨道,则重排后的氧原子价电子排布图为
(2)沸点:

 (填“>”或“<”,下同),理由是:
(填“>”或“<”,下同),理由是:
 ,理由是:
,理由是:(3)As、Ge、Se三种元素的第一电离能由大到小的顺序是
(4)基态As原子的最高能级组的电子排布式为
(5)
 晶胞中的少量Ti被Al代替后的立方晶胞结构如图所示。该晶胞中,距离Ti最近的Al有
晶胞中的少量Ti被Al代替后的立方晶胞结构如图所示。该晶胞中,距离Ti最近的Al有 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次



