工业上利用赤铁矿渣(主要成分为Zn、 、CuO和
、CuO和 ,还含有少量的Ga和In)获得Ga和In单质的流程如下:
,还含有少量的Ga和In)获得Ga和In单质的流程如下:
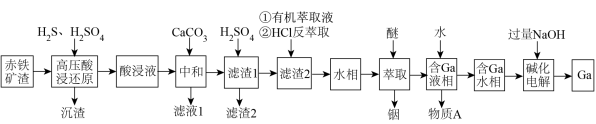
已知:①Ga、In与Al同族,化学性质相似。
② 比
比 在醚中的溶解度更高。
在醚中的溶解度更高。
③ 和
和 在酸性条件下不易被
在酸性条件下不易被 沉淀,但
沉淀,但 和
和 可以被
可以被 沉淀。
沉淀。
④当离子浓度小于或等于 时认为该离子沉淀完全。
时认为该离子沉淀完全。
⑤部分物质的 如下表:
如下表:
回答下列问题:
(1)“高压酸浸还原”时,CuO发生反应的总的化学方程式为___________ 。“沉渣”中除了含有含铜元素的物质和S,还主要含有___________ (填化学式)。
(2)“滤液2”中含有的离子主要是___________ 。
(3)若“滤液1”中只有浓度均为 的
的 和
和 ,中和时,加入
,中和时,加入 调节pH的范围是
调节pH的范围是___________ (结果保留至小数点后一位)。
(4)“碱化电解”前“含Ga水相”需要加入NaOH溶液调节溶液呈碱性,___________ (填“能”或“不能”)用氨水代替NaOH溶液,原因是___________ 。为探究 在氨水中能否溶解,计算反应
在氨水中能否溶解,计算反应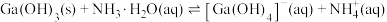 的平衡常数K=
的平衡常数K=___________ {已知: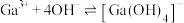 ,
,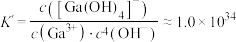 ;
;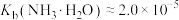 }。
}。
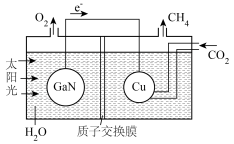
(5)氮化镓与铜组装成的人工光合系统的电池工作原理如图所示。电池工作时 向
向___________ (填“左”或“右”)池移动;当电路中转移1.6mol电子时,电池中液体的质量减小了___________ g。
 、CuO和
、CuO和 ,还含有少量的Ga和In)获得Ga和In单质的流程如下:
,还含有少量的Ga和In)获得Ga和In单质的流程如下:
已知:①Ga、In与Al同族,化学性质相似。
②
 比
比 在醚中的溶解度更高。
在醚中的溶解度更高。③
 和
和 在酸性条件下不易被
在酸性条件下不易被 沉淀,但
沉淀,但 和
和 可以被
可以被 沉淀。
沉淀。④当离子浓度小于或等于
 时认为该离子沉淀完全。
时认为该离子沉淀完全。⑤部分物质的
 如下表:
如下表:| 物质 |  |  |  |  |
 |  | 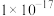 |  | 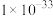 |
(1)“高压酸浸还原”时,CuO发生反应的总的化学方程式为
(2)“滤液2”中含有的离子主要是
(3)若“滤液1”中只有浓度均为
 的
的 和
和 ,中和时,加入
,中和时,加入 调节pH的范围是
调节pH的范围是(4)“碱化电解”前“含Ga水相”需要加入NaOH溶液调节溶液呈碱性,
 在氨水中能否溶解,计算反应
在氨水中能否溶解,计算反应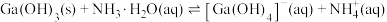 的平衡常数K=
的平衡常数K=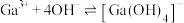 ,
,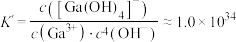 ;
;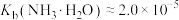 }。
}。(5)氮化镓与铜组装成的人工光合系统的电池工作原理如图所示。电池工作时
 向
向
更新时间:2024-03-12 18:08:28
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
Ⅰ.直接作燃料
已知:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol, 2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为__________________________________ 。
Ⅱ.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:
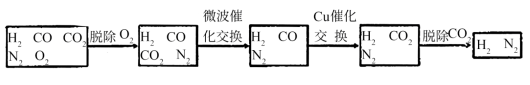
在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4 CO+H2CO+H2O
CO+H2CO+H2O CO2+H2
CO2+H2
(2) 气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原
因:________________________ 。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)=______________________ 。
Ⅲ.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该研究小组在恒温条件下,向2L恒容密闭容器这加入0.2molNO和0.1molCl2,发生如下反应:2NO(g)+Cl2(g) 2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=
2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=___________ mol。
设此时NO的转化率为ɑ1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为ɑ2,则ɑ1_________ ɑ2(填“>”、“<”或“=”);平衡常数K_______ (填“增大”“减小”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为__________________________ 。
Ⅳ.一种用高岭土矿(主要成分为SiO2、Al2O3,含少量Fe2O3)为原料制备铝铵矾[NH4Al(SO4)2·12H2O]的工艺流程如图所示。回答下列问题:
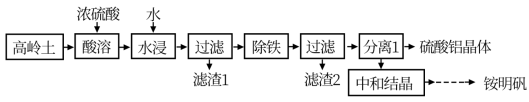
(6)当“酸溶”时间超过40min时,溶液中的Al2(SO4)3会与SiO2反应生成Al2O3·nSiO2,导致铝的溶出率降低,该反应的化学方程式为________________________ 。
(7)检验“除铁”过程中铁是否除尽的方法是_________________________ 。
(8)“中和”时,需控制条件为20℃和pH=2.8,其原因是__________________________ 。
Ⅰ.直接作燃料
已知:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol, 2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为
Ⅱ.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:

在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:
CO2+CH4
 CO+H2CO+H2O
CO+H2CO+H2O CO2+H2
CO2+H2(2) 气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原
因:
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)=
Ⅲ.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该研究小组在恒温条件下,向2L恒容密闭容器这加入0.2molNO和0.1molCl2,发生如下反应:2NO(g)+Cl2(g)
 2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=
2ClNO(g) △H<0。10min 时反应达平衡,测得10min内v (ClNO)=7.5×10-3mol/(L·min),则平衡后n(Cl2)=设此时NO的转化率为ɑ1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO的转化率为ɑ2,则ɑ1
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为
Ⅳ.一种用高岭土矿(主要成分为SiO2、Al2O3,含少量Fe2O3)为原料制备铝铵矾[NH4Al(SO4)2·12H2O]的工艺流程如图所示。回答下列问题:

(6)当“酸溶”时间超过40min时,溶液中的Al2(SO4)3会与SiO2反应生成Al2O3·nSiO2,导致铝的溶出率降低,该反应的化学方程式为
(7)检验“除铁”过程中铁是否除尽的方法是
(8)“中和”时,需控制条件为20℃和pH=2.8,其原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】氧化铈(CeO2)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示:
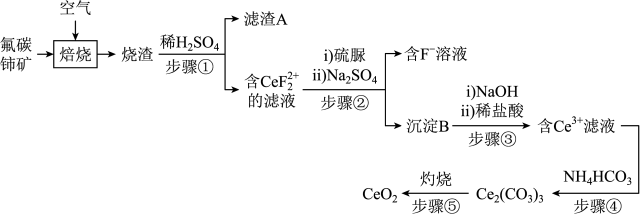
已知:①稀土离子易与 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应:Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
发生反应:Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
②硫脲: 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是_____ (填写化学式)。
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式_____ 。
(3)加入硫脲的目的是将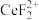 还原为Ce3+,反应的离子方程式为
还原为Ce3+,反应的离子方程式为_____ 。
(4)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为_____ 。
(5)下列关于步骤④的说法正确的是_____(填字母)。
(6)若常温下,Ka2(H2CO3)=5.0×10−11,Ksp[Ce2(CO3)3]=1.0×10−28,Ce3+恰好沉淀完全c(Ce3+)=1.0×10−5mol∙L−1,此时测得溶液的pH=5,则溶液中c( )=
)=_____ mol∙L−1。

已知:①稀土离子易与
 形成复盐沉淀,Ce3+和
形成复盐沉淀,Ce3+和 发生反应:Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;
发生反应:Ce2(SO4)3+Na2SO4+nH2O=Ce2(SO4)3·Na2SO4·nH2O↓;②硫脲:
 具有还原性,酸性条件下易被氧化为(SCN2H3)2;
具有还原性,酸性条件下易被氧化为(SCN2H3)2;③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀;
④Ce2(CO3)3为白色粉末,难溶于水。
回答下列问题:
(1)滤渣A的主要成分是
(2)在另一种生产工艺中,在氟碳铈矿矿石粉中加入碳酸氢钠同时通入氧气焙烧,焙烧得到NaF和CeO2两种固体以及两种高温下的气态物质,请写出焙烧过程中相应的化学方程式
(3)加入硫脲的目的是将
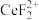 还原为Ce3+,反应的离子方程式为
还原为Ce3+,反应的离子方程式为(4)步骤③加入盐酸后,通常还需加入另一种化学试剂X,根据题中信息推测,加入X的作用为
(5)下列关于步骤④的说法正确的是_____(填字母)。
| A.过滤后的滤液中仍含有较多Ce3+,需要将滤液循环以提高产率 |
| B.可以用Na2CO3溶液代替NH4HCO3溶液,不影响产品纯度 |
| C.过滤时选择减压过滤能够大大提高过滤效率 |
D.该步骤发生的反应是2Ce3++6 =Ce2(CO3)3↓+3CO2↑+3H2O =Ce2(CO3)3↓+3CO2↑+3H2O |
(6)若常温下,Ka2(H2CO3)=5.0×10−11,Ksp[Ce2(CO3)3]=1.0×10−28,Ce3+恰好沉淀完全c(Ce3+)=1.0×10−5mol∙L−1,此时测得溶液的pH=5,则溶液中c(
 )=
)=
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】化合物X由三种元素组成,某学习小组按如下流程进行实验:
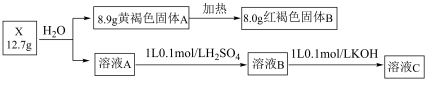
已知:黄褐色固体A的式量小于100,溶液C是单一溶质盐溶液。
(1)X的组成元素是___________ ,X的化学式是___________ 。
(2)写出B溶液与 溶液恰好完全沉淀时的离子反应方程式:
溶液恰好完全沉淀时的离子反应方程式:___________ 。
(3)固体A是一种良好的脱硫剂,请写出常温下固体A在 氛围中与
氛围中与 反应的化学反应方程式:
反应的化学反应方程式:___________ 。
(4)设计实验检验溶液B中的阳离子:___________ 。

已知:黄褐色固体A的式量小于100,溶液C是单一溶质盐溶液。
(1)X的组成元素是
(2)写出B溶液与
 溶液恰好完全沉淀时的离子反应方程式:
溶液恰好完全沉淀时的离子反应方程式:(3)固体A是一种良好的脱硫剂,请写出常温下固体A在
 氛围中与
氛围中与 反应的化学反应方程式:
反应的化学反应方程式:(4)设计实验检验溶液B中的阳离子:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】甲烷的直接转化具有较高的经济价值,因此备受科学家关注。回答下列问题:
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
I.CH4(g)+ O2(g)
O2(g) CH3OH(g) △H1=-126.4kJ•mol-1
CH3OH(g) △H1=-126.4kJ•mol-1
II.CH4(g)+H2O(g) CH3OH(g)+H2(g) △H2
CH3OH(g)+H2(g) △H2
已知:H2的标准燃烧热为285.8kJ/mol;H2O(l)=H2O(g) △H=+44kJ•mol-1。计算△H2=______ kJ/mol。
(2)若采用方法I生产甲醇。在200℃下,向恒容为5L的密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。

①下列措施可提高CH4的平衡转化率的是______ (填标号)。
A.升高温度 B.初始总压强不变,提高CH4的分压
C.投料比不变,增大反应物浓度 D.反应达到平衡后,再充入一定量He
②在200℃下,方法I的标准压力平衡常数K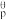 =
=______ (可保留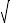 )。
)。
已知:2A(g) B(g)的标准平衡常数K
B(g)的标准平衡常数K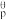 =
=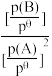 ,其中pθ为标准压强(100kPa),p(A)和p(B)为平衡分压(某成分的物质的量分数×总压)。
,其中pθ为标准压强(100kPa),p(A)和p(B)为平衡分压(某成分的物质的量分数×总压)。
③若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率将______ (填:变大、变小或不变)。
(3)为提高生产效率,利用方法II进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸不会导致体系温度的变化。

①通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是______ 。
②从反应速率的角度分析,通入CH4后维持200℃的原因______ (不考虑催化剂失活)。
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
I.CH4(g)+
 O2(g)
O2(g) CH3OH(g) △H1=-126.4kJ•mol-1
CH3OH(g) △H1=-126.4kJ•mol-1II.CH4(g)+H2O(g)
 CH3OH(g)+H2(g) △H2
CH3OH(g)+H2(g) △H2已知:H2的标准燃烧热为285.8kJ/mol;H2O(l)=H2O(g) △H=+44kJ•mol-1。计算△H2=
(2)若采用方法I生产甲醇。在200℃下,向恒容为5L的密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。

①下列措施可提高CH4的平衡转化率的是
A.升高温度 B.初始总压强不变,提高CH4的分压
C.投料比不变,增大反应物浓度 D.反应达到平衡后,再充入一定量He
②在200℃下,方法I的标准压力平衡常数K
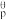 =
= )。
)。已知:2A(g)
 B(g)的标准平衡常数K
B(g)的标准平衡常数K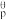 =
=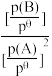 ,其中pθ为标准压强(100kPa),p(A)和p(B)为平衡分压(某成分的物质的量分数×总压)。
,其中pθ为标准压强(100kPa),p(A)和p(B)为平衡分压(某成分的物质的量分数×总压)。③若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率将
(3)为提高生产效率,利用方法II进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸不会导致体系温度的变化。

①通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是
②从反应速率的角度分析,通入CH4后维持200℃的原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】2021年8月23日,第31个全国节能宣传周主题为“节能降碳,绿色发展”。“碳”这一概念稳居C位,碳达峰、碳中和、碳交易、碳固定等概念被多次提及。当前,二氧化碳的捕集、利用与封存已成为我国能源领域的一个重要战略方向。 和
和 在一定条件下可制取甲醇,反应如下:
在一定条件下可制取甲醇,反应如下:
 。
。
(1)在体积为1L的密闭容器中,充入 和
和 ,发生上述反应,若10分钟后,容器内压强为原来的0.625倍,则0到10分钟,氢气的平均反应速率为
,发生上述反应,若10分钟后,容器内压强为原来的0.625倍,则0到10分钟,氢气的平均反应速率为___________ mol/(L·min),下列措施能加快该反应速率的是___________ 。
A.恒压时充入He B.恒容时充入He
C.及时分离出 D.恒容时充入
D.恒容时充入
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①由表中数据判断
___________ 0(填“>”、“<”或“=”)。
②若容器容积不变,下列措施不能提高该反应中 转化率的是
转化率的是___________ 。
A.充入 ,使体系总压强增大 B.将
,使体系总压强增大 B.将 从体系中分离
从体系中分离
C.充入 D.原料气循环使用
D.原料气循环使用
③将混合气体充入恒温恒容密闭容器中,发生上述反应,下列事实能说明反应已达到平衡状态的是___________ 。
A. 和
和 的物质的量之比保持不变 B.混合气体的平均相对分子质量不变
的物质的量之比保持不变 B.混合气体的平均相对分子质量不变
C.该反应的平衡常数保持不变 D.密度保持不变
④该反应的平衡常数K的表达式为___________ ;已知80℃时,测得容器中 、
、 ,此时,该反应化学反应速率
,此时,该反应化学反应速率
___________  (选填“>”、“<”或“=”),说明原因
(选填“>”、“<”或“=”),说明原因___________ 。
 和
和 在一定条件下可制取甲醇,反应如下:
在一定条件下可制取甲醇,反应如下:
 。
。(1)在体积为1L的密闭容器中,充入
 和
和 ,发生上述反应,若10分钟后,容器内压强为原来的0.625倍,则0到10分钟,氢气的平均反应速率为
,发生上述反应,若10分钟后,容器内压强为原来的0.625倍,则0到10分钟,氢气的平均反应速率为A.恒压时充入He B.恒容时充入He
C.及时分离出
 D.恒容时充入
D.恒容时充入
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 80℃ | 250℃ | 300℃ | 350℃ |
| K | 5.3 | 2.041 | 0.270 | 0.012 |
①由表中数据判断

②若容器容积不变,下列措施不能提高该反应中
 转化率的是
转化率的是A.充入
 ,使体系总压强增大 B.将
,使体系总压强增大 B.将 从体系中分离
从体系中分离C.充入
 D.原料气循环使用
D.原料气循环使用③将混合气体充入恒温恒容密闭容器中,发生上述反应,下列事实能说明反应已达到平衡状态的是
A.
 和
和 的物质的量之比保持不变 B.混合气体的平均相对分子质量不变
的物质的量之比保持不变 B.混合气体的平均相对分子质量不变C.该反应的平衡常数保持不变 D.密度保持不变
④该反应的平衡常数K的表达式为
 、
、 ,此时,该反应化学反应速率
,此时,该反应化学反应速率
 (选填“>”、“<”或“=”),说明原因
(选填“>”、“<”或“=”),说明原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】为了如期完成“碳达峰、碳中和”的计划。研发二氧化碳利用技术,降低空气中二氧化碳含量成为当今研究热点。
(1)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g) CO(g)+H2O(g) ΔH1=+41 kJ/mol
CO(g)+H2O(g) ΔH1=+41 kJ/mol
反应2:CO(g)+2H2(g) CH3OH(g) ΔH2=—90 kJ/mol
CH3OH(g) ΔH2=—90 kJ/mol
①反应1中的活化能Ea(正)___________ Ea(逆)(填“>”或“<”)。
②温度为T,压强为P0的恒压密闭容器中,通入1 mol CO2和3mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,则该温度下反应1的压强平衡常数Kp=___________ (用含a、b的代数式表示),若温度不变,改为恒容容器,反应建立平衡后,反应1的Kp___________ (填“增大”“减小”或“不变”,下同),反应体系中CH3OH(g)的产率将___________ 。
(2)将CO2和H2初始投料分别按1.0 mol/L和4.0 mol/L充入恒容容器中,现研究温度及容器壁是否使用3A分子筛膜(该膜主要吸附水分子)对甲醇平衡产率的影响如图所示:
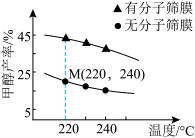
①220℃时,经过3 min达到M点,此时测得H2O的产率为50%,则该条件下0—3 min内的H2的平均消耗速率v(H2)=___________ 。
②相同温度下,甲醇的平衡产率在有3A分子筛膜时总是较高的原因是___________ 。
(3)利用Al—CO2电池(工作原理如图所示)能有效地将CO2转化成化工原料草酸铝。
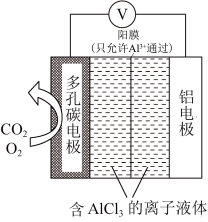
①电池的正极反应式;2CO2+2e-= (草酸根),正极反应过程中,O2是催化剂,催化过程可表示为:i.O2+2e-=
(草酸根),正极反应过程中,O2是催化剂,催化过程可表示为:i.O2+2e-= ,ii.
,ii. ___________ 。
②若有1 mol O2循环一次后,负极室中Al3+物质的量变化量为___________ 。
(1)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH1=+41 kJ/mol
CO(g)+H2O(g) ΔH1=+41 kJ/mol反应2:CO(g)+2H2(g)
 CH3OH(g) ΔH2=—90 kJ/mol
CH3OH(g) ΔH2=—90 kJ/mol①反应1中的活化能Ea(正)
②温度为T,压强为P0的恒压密闭容器中,通入1 mol CO2和3mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,则该温度下反应1的压强平衡常数Kp=
(2)将CO2和H2初始投料分别按1.0 mol/L和4.0 mol/L充入恒容容器中,现研究温度及容器壁是否使用3A分子筛膜(该膜主要吸附水分子)对甲醇平衡产率的影响如图所示:

①220℃时,经过3 min达到M点,此时测得H2O的产率为50%,则该条件下0—3 min内的H2的平均消耗速率v(H2)=
②相同温度下,甲醇的平衡产率在有3A分子筛膜时总是较高的原因是
(3)利用Al—CO2电池(工作原理如图所示)能有效地将CO2转化成化工原料草酸铝。

①电池的正极反应式;2CO2+2e-=
 (草酸根),正极反应过程中,O2是催化剂,催化过程可表示为:i.O2+2e-=
(草酸根),正极反应过程中,O2是催化剂,催化过程可表示为:i.O2+2e-= ,ii.
,ii. ②若有1 mol O2循环一次后,负极室中Al3+物质的量变化量为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
I、铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是_________ (用离子方程式表示);如硫酸铝常作泡沫灭火器原料之一,其原理是________________ (用离子方程式表示)。
Ⅱ、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①____________________________ ;②____________________________ ;③____________________________ 。
(2)溶液中共有__________ 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01mol·L-1的是__________ ,浓度为0.002mol·L-1的是____________ 。
(4)__________ 和__________ 两种粒子物质的量之和等于0.01mol。
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红。试回答有关问题:
①该溶液中HSO 的电离程度
的电离程度_________ (填“大于”、“小于”或“等于”)HSO 的水解程度。
的水解程度。
②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为__________ 。
Ⅲ、含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10-3mol·L﹣1的Cr2O72﹣.为了使废水的排放达标,进行如下处理:

(1)绿矾为FeSO4·7H2O,反应(Ⅰ)中FeSO4与Cr2O72﹣ 的物质的量之比为_________ .
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的pH=______ .(Ksp[Cr(OH)3]=6.0×10﹣31)
I、铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是
Ⅱ、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①
(2)溶液中共有
(3)在这些粒子中,浓度为0.01mol·L-1的是
(4)
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红。试回答有关问题:
①该溶液中HSO
 的电离程度
的电离程度 的水解程度。
的水解程度。②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为
Ⅲ、含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10-3mol·L﹣1的Cr2O72﹣.为了使废水的排放达标,进行如下处理:

(1)绿矾为FeSO4·7H2O,反应(Ⅰ)中FeSO4与Cr2O72﹣ 的物质的量之比为
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的pH=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】铜阳极泥(含有Cu2S、Se、Ag2Se、Au等)是粗铜电解精炼的副产品,常用作提取稀有元素和贵金属的重要原料。
(1)向阳极泥中加入硫酸溶液,再逐渐加入MnO2(MnO2在酸性条件下被还原为Mn2+)至过量。Cu、Se、Ag、S元素充分浸出,以Cu2+、SeO 、SeO
、SeO 、Ag+、SO
、Ag+、SO 形式存在于浸出液中,其他元素在浸出渣中。
形式存在于浸出液中,其他元素在浸出渣中。
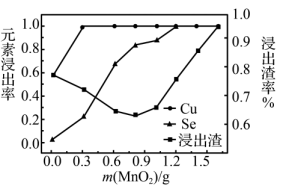
①写出Cu2S溶解的离子方程式:____ 。
②在铜阳极泥质量、硫酸用量和反应时间一定时,研究人员测得Cu元素浸出率、Se元素浸出率和浸出渣率[浸出渣率= ×100%]随MnO2质量的变化情况如图所示。当0.8g<m(MnO2)<1.2g时,Se元素浸出率继续增加。浸出渣率不减反增的原因是
×100%]随MnO2质量的变化情况如图所示。当0.8g<m(MnO2)<1.2g时,Se元素浸出率继续增加。浸出渣率不减反增的原因是____ 。
(2)向(1)所得浸出液中加入NaCl,可将Ag+转化为AgCl,再用硫代硫酸盐溶液浸出银元素。
已知:①AgCl+2S2O
 Ag(S2O3)
Ag(S2O3) +Cl— K=6.66×103;
+Cl— K=6.66×103;
②Ag++2S2O
 Ag(S2O3)
Ag(S2O3) 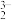 K=3.7×1013。
K=3.7×1013。
加入NaCl,溶液中c(Cl—)>____ mol·L-1时,可使(1)所得浸出液中c(Ag+)<10-5mol·L-1。
(3)研究发现,硫代硫酸盐浸出金的过程是电化学催化腐蚀过程,催化机理模型如图所示:
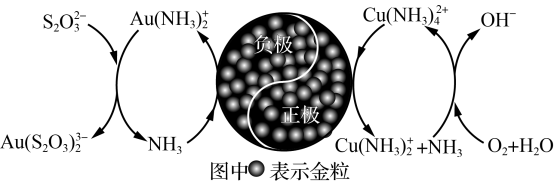
负极的电极反应式为____ 。O2参与反应步骤的离子方程式____ 。
(1)向阳极泥中加入硫酸溶液,再逐渐加入MnO2(MnO2在酸性条件下被还原为Mn2+)至过量。Cu、Se、Ag、S元素充分浸出,以Cu2+、SeO
 、SeO
、SeO 、Ag+、SO
、Ag+、SO 形式存在于浸出液中,其他元素在浸出渣中。
形式存在于浸出液中,其他元素在浸出渣中。①写出Cu2S溶解的离子方程式:
②在铜阳极泥质量、硫酸用量和反应时间一定时,研究人员测得Cu元素浸出率、Se元素浸出率和浸出渣率[浸出渣率=
 ×100%]随MnO2质量的变化情况如图所示。当0.8g<m(MnO2)<1.2g时,Se元素浸出率继续增加。浸出渣率不减反增的原因是
×100%]随MnO2质量的变化情况如图所示。当0.8g<m(MnO2)<1.2g时,Se元素浸出率继续增加。浸出渣率不减反增的原因是
(2)向(1)所得浸出液中加入NaCl,可将Ag+转化为AgCl,再用硫代硫酸盐溶液浸出银元素。
已知:①AgCl+2S2O

 Ag(S2O3)
Ag(S2O3)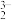 +Cl— K=6.66×103;
+Cl— K=6.66×103;②Ag++2S2O

 Ag(S2O3)
Ag(S2O3) 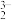 K=3.7×1013。
K=3.7×1013。加入NaCl,溶液中c(Cl—)>
(3)研究发现,硫代硫酸盐浸出金的过程是电化学催化腐蚀过程,催化机理模型如图所示:

负极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】工业上常用钛铁矿作原料,制取二氧化钛和颜料铁红,其生产流程如图:

已知:①TiO2+易水解,只能存在于强酸性溶液中。
②钛铁矿主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质。
(1)化合物FeTiO3中铁元素的化合价是______ ;溶液A中加入铁粉的作用是______ 。
(2)为了从溶液B中获取纯净的FeSO4·7H2O,II中应采取的操作是______ 、______ 、过滤、洗涤、干燥。如何检验提取FeSO4·7H2O的溶液中存在Fe2+______ 。
(3)溶液C中加入NH4HCO3,发生反应的离子方程式是______ 。
(4)FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5 mol/L。请通过计算判断所得FeCO3固体中是否混有Fe(OH)2______ (已知:Ksp[Fe(OH)2] = 4.9×10-17)
(5)用氧化还原滴定法测定产品TiO2的纯度:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2纯度为______ (用代数式表示)。

已知:①TiO2+易水解,只能存在于强酸性溶液中。
②钛铁矿主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质。
(1)化合物FeTiO3中铁元素的化合价是
(2)为了从溶液B中获取纯净的FeSO4·7H2O,II中应采取的操作是
(3)溶液C中加入NH4HCO3,发生反应的离子方程式是
(4)FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5 mol/L。请通过计算判断所得FeCO3固体中是否混有Fe(OH)2
(5)用氧化还原滴定法测定产品TiO2的纯度:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2纯度为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】氢气在工业合成中广泛应用。
(1)通过下列反应可以制备甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH=-90.8kJ/mol,
CH3OH(g) ΔH=-90.8kJ/mol,
CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.3kJ/mol
CO(g)+H2O(g) ΔH=+41.3kJ/mol
请写出由CO2和H2制取甲醇的热化学方程式______________ 。
(2)已知合成氨的反应为:N2+3H2 2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
①图中代表反应在恒容绝热容器中进行的曲线是________ (用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=_____________ 。
③b容器中M点,v(正)________ v(逆)(填“大于”、“小于”或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为________ ;标准状况下,当阴极收集到11.2LN2时,理论上消耗NH3的体积为_____________ 。
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中c(NH4+)____ c(HCO3-) (填“>”、“<”或“=”);反应NH4++HCO3-+H2O NH3•H2O+H2CO3的平衡常数K=
NH3•H2O+H2CO3的平衡常数K=_______ 。
(已知常温下NH3•H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7, K2=4×10-11)
(1)通过下列反应可以制备甲醇:
CO(g)+2H2(g)
 CH3OH(g) ΔH=-90.8kJ/mol,
CH3OH(g) ΔH=-90.8kJ/mol,CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.3kJ/mol
CO(g)+H2O(g) ΔH=+41.3kJ/mol请写出由CO2和H2制取甲醇的热化学方程式
(2)已知合成氨的反应为:N2+3H2
 2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H<0。某温度度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题: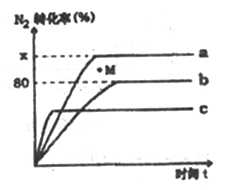
①图中代表反应在恒容绝热容器中进行的曲线是
②曲线a条件下该反应的平衡常数K=
③b容器中M点,v(正)
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为
(4)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中c(NH4+)
 NH3•H2O+H2CO3的平衡常数K=
NH3•H2O+H2CO3的平衡常数K=(已知常温下NH3•H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7, K2=4×10-11)
您最近一年使用:0次
【推荐2】某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是_______ 。
②电极反应式:
ⅰ.氧化反应:2Cl--2e-=Cl2↑
ⅱ.还原反应:_______ 。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
ⅰ.随c(Cl-)降低,Cl-还原性减弱或Cl2的氧化性增强。
ⅱ.随c(H+)降低或c(Mn2+)浓度升高,_______ 。
④补充实验证实了③中的分析(下面表格)。
a是_______ ,b是_______ 。
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是_______ 。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是_______ 。
(4)综合上述,可以得到物质氧化性和还原性变化的一般规律:氧化剂(还原剂)的浓度越大,其氧化性(还原性)越强;还原产物(氧化产物)的浓度越大,氧化剂(还原剂)的氧化性(还原性)越小。据此,小组分别利用电解池(图1)和原电池(图2)装置,成功实现了铜与稀硫酸制氢气。
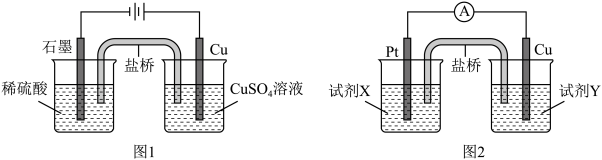
结合上述的探究结论,图2中试剂X是_______ ,试剂Y是_______ 。(限选试剂:稀硫酸、Na2SO4溶液、NaOH溶液、NaNO3溶液、CuSO4溶液,浓度均为1.0 mol·L-1)
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是
②电极反应式:
ⅰ.氧化反应:2Cl--2e-=Cl2↑
ⅱ.还原反应:
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
ⅰ.随c(Cl-)降低,Cl-还原性减弱或Cl2的氧化性增强。
ⅱ.随c(H+)降低或c(Mn2+)浓度升高,
④补充实验证实了③中的分析(下面表格)。
| 实验操作 | 试剂 | 产物 | |
| Ⅰ |  | 较浓H2SO4 | 有氯气 |
| Ⅱ | a | 有氯气 | |
| Ⅲ | a+b | 无氯气 |
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是
(4)综合上述,可以得到物质氧化性和还原性变化的一般规律:氧化剂(还原剂)的浓度越大,其氧化性(还原性)越强;还原产物(氧化产物)的浓度越大,氧化剂(还原剂)的氧化性(还原性)越小。据此,小组分别利用电解池(图1)和原电池(图2)装置,成功实现了铜与稀硫酸制氢气。

结合上述的探究结论,图2中试剂X是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增,A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素,请回答下列问题:
(1)C在元素周期表中的位置为___________ 。
(2)D与E按原子个数比 形成化合物甲,其电子式为
形成化合物甲,其电子式为___________ ,所含化学键类型为___________ ,向甲中滴加足量水时发生反应的离子方程式是___________ 。
(3)E、F、G三种元素形成的简单离子,半径由大到小的顺序是________ (用离子符号表示)。
(4)在短周期中,B元素的同主族元素对应的氧化物被氢氟酸腐蚀的反应化学方程式为_____ 。
(5)用 、
、 和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入
和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入 气体,b极通入
气体,b极通入 气体,则a极是该电池的
气体,则a极是该电池的_______ 极,该电极的电极反应式为_______ ,若线路中转移2mol电子,则消耗的 在标准状况下的体积为
在标准状况下的体积为___________ L。
(1)C在元素周期表中的位置为
(2)D与E按原子个数比
 形成化合物甲,其电子式为
形成化合物甲,其电子式为(3)E、F、G三种元素形成的简单离子,半径由大到小的顺序是
(4)在短周期中,B元素的同主族元素对应的氧化物被氢氟酸腐蚀的反应化学方程式为
(5)用
 、
、 和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入
和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入 气体,b极通入
气体,b极通入 气体,则a极是该电池的
气体,则a极是该电池的 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次



