某化学小组欲定量探究含I-对H2O2溶液发生分解时化学反应速率的影响,该小组先取10mL0.40mol•L-1H2O2溶液利用如图装置进行实验,得到了如表数据:

说明:①表中V(O2)是折合成标准状况下O2的体积:
②假设反应过程中溶液体积的变化忽略不计。
(1)检查该装置气密性的操作为_______ 。
(2)0~6min的平均反应速率:v(H2O2)=_______ (保留两位有效数字),0~6min的平均反应速率_______ 10min的平均反应速率(填“>”“<”或“=”)
(3)已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,在含少量I-的溶液中,H2O2的分解机理为:
①H2O2+I-→H2O+IO- 慢
②H2O2+IO-→H2O+O2+I- 快
下列说法错误的是_______ (填标号)。
A.该反应活化能等于98kJ•mol-1
B.IO-是该反应的催化剂
C.反应速率与I-的浓度有关
D.2v(H2O2)=2v(H2O)=v(O2)
E.反应①的活化能高于反应②
(4)对于H2O2的分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图所示的实验,发现滴加FeCl3溶液的试管产生的气泡史剧烈,研究小组得出了“Fe3+的催化效果一定比Cu2+更好”的结论,你认为利用该现象得出的该结论_______ (填“合理”或“不合理”),原因是_______ 。某同学将0.1mol•L-1CuSO4溶液改为0.15mol•L-1CuCl2溶液进行实验,现象与上述实验一致,故研究小组得出了“Fe3+催化效果更好”的结论,其理由是_______ 。


| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
②假设反应过程中溶液体积的变化忽略不计。
(1)检查该装置气密性的操作为
(2)0~6min的平均反应速率:v(H2O2)=
(3)已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ•mol-1,在含少量I-的溶液中,H2O2的分解机理为:
①H2O2+I-→H2O+IO- 慢
②H2O2+IO-→H2O+O2+I- 快
下列说法错误的是
A.该反应活化能等于98kJ•mol-1
B.IO-是该反应的催化剂
C.反应速率与I-的浓度有关
D.2v(H2O2)=2v(H2O)=v(O2)
E.反应①的活化能高于反应②
(4)对于H2O2的分解反应,Cu2+也有一定的催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,研究小组的同学设计了如图所示的实验,发现滴加FeCl3溶液的试管产生的气泡史剧烈,研究小组得出了“Fe3+的催化效果一定比Cu2+更好”的结论,你认为利用该现象得出的该结论

更新时间:2024-03-17 13:04:00
|
相似题推荐
填空题
|
较易
(0.85)
【推荐1】一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:

(1)从反应开始到10s时,用Z表示的反应速率为________ ,X的物质的量浓度减少了________ ,Y的转化率为________ 。
(2)该反应的化学方程式为__________ 。
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是________ 。
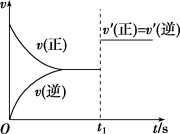
A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂

(1)从反应开始到10s时,用Z表示的反应速率为
(2)该反应的化学方程式为
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是

A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】Ⅰ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应达到平衡时,NO的转化率是___ 。
(2)用O2表示从0~2s内该反应的平均速率v=___ 。
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___ (填选项)。
A.2v生(NH3)=v耗(CO2)
B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变
D.密闭容器中总压强保持不变
E.形成6个N—H键的同时有2C=O键断裂
(2)能使该反应的反应速率增大的是___ (选项)。
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___ (填“大于”“等于”或“小于”)形成生成物中化学键放出的能量。

 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)用O2表示从0~2s内该反应的平均速率v=
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。(1)下列不能判断该分解反应已经达到化学平衡状态的是
A.2v生(NH3)=v耗(CO2)
B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变
D.密闭容器中总压强保持不变
E.形成6个N—H键的同时有2C=O键断裂
(2)能使该反应的反应速率增大的是
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)如图所示,上述反应中断开反应物中化学键吸收的能量

您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】综合利用CO2、CO对构建低碳社会有重要意义。
(1)H2和CO合成甲醇反应为:CO(g)+2H2(g) CH3OH(g) ΔH<0。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为
CH3OH(g) ΔH<0。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______ ;10min内用H2表示的化学反应速率为_______ ;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有_______ (填一种合理的措施)。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g) CH3OH(g) +H2O(g) ΔH
CH3OH(g) +H2O(g) ΔH
①该反应的平衡常数表达式为K=________ 。
②在恒容密闭容器中使CO2和H2(物质的量之比为1∶3),发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如下图所示,则 ΔH_________ 0(填“大于”或“小于”)

(3) 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用。请说明该转化的2个优点_____________ 。若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________ mol C(碳)。

(1)H2和CO合成甲醇反应为:CO(g)+2H2(g)
 CH3OH(g) ΔH<0。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为
CH3OH(g) ΔH<0。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) ΔH
CH3OH(g) +H2O(g) ΔH ①该反应的平衡常数表达式为K=
②在恒容密闭容器中使CO2和H2(物质的量之比为1∶3),发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如下图所示,则 ΔH

(3) 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用。请说明该转化的2个优点

您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
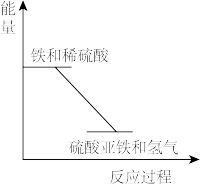
(1)该反应为_____ 反应(填“吸热”或“放热”).
(2)若要使该反应的反应速率加快,下列措施可行的是_____ (填字母).
a.改铁片为铁粉
b.改稀硫酸为98%的浓硫酸
c.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_____ 极(填“正”或“负”).该极上发生的电极反应式为_____ ,外电路中电子由_____ 极(填“正”或“负”,下同)向_____ 极移动。

(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是
a.改铁片为铁粉
b.改稀硫酸为98%的浓硫酸
c.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】将物质的量均为3mol的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(s) xC(g)+2D(g),经5min后反应达到平衡,此时测得C的浓度为0.5mol·L-1,D的平均反应速率是0.1mol/(L·min),按要求填空:
xC(g)+2D(g),经5min后反应达到平衡,此时测得C的浓度为0.5mol·L-1,D的平均反应速率是0.1mol/(L·min),按要求填空:
(1)A的平均反应速率为___________
(2)x的值为___________
(3)平衡后A的物质的量浓度为___________
(4)下列措施能明显加快反应速率的是___________
A.升高温度 B.将产物及时分离
C.向密闭容器中充入一定的惰性气体 D.将密闭容器的体积变为1L
 xC(g)+2D(g),经5min后反应达到平衡,此时测得C的浓度为0.5mol·L-1,D的平均反应速率是0.1mol/(L·min),按要求填空:
xC(g)+2D(g),经5min后反应达到平衡,此时测得C的浓度为0.5mol·L-1,D的平均反应速率是0.1mol/(L·min),按要求填空:(1)A的平均反应速率为
(2)x的值为
(3)平衡后A的物质的量浓度为
(4)下列措施能明显加快反应速率的是
A.升高温度 B.将产物及时分离
C.向密闭容器中充入一定的惰性气体 D.将密闭容器的体积变为1L
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g),在一容积可变的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率_________ (填“增大”“不变”或“减小”,下同),平衡________ 移动(填“不”“向正反应方向”或“向逆反应方向”,下同)。
(2)将容器的体积缩小一半,其正反应速率________ ,平衡________ 移动。
(3)保持体积不变,充入N2使体系压强增大,其正反应速率________ ,平衡____________ 移动。
(4)保持体积不变,充入水蒸气,其正反应速率________ ,平衡____________ 移动。
 Fe3O4(s)+4H2(g),在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g),在一容积可变的密闭容器中进行,试回答:(1)增加Fe的量,其正反应速率
(2)将容器的体积缩小一半,其正反应速率
(3)保持体积不变,充入N2使体系压强增大,其正反应速率
(4)保持体积不变,充入水蒸气,其正反应速率
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】按下面的实验过程填空:

写出上述反应的化学方程式:
(1)______________________________________________;
(2)______________________________________________;
(3)______________________________________________。

写出上述反应的化学方程式:
(1)______________________________________________;
(2)______________________________________________;
(3)______________________________________________。
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】从某铝镁合金片上剪下一小块(质量为1.0g),立即投入到盛有10mL10mol/LNaOH溶液的小烧杯中。
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是________________________________ 。后来的反应速率相当快的原因是___________________________________ 。
(3)写出所形成的原电池的负极材料名称:________________________________
电极反应式:____________________________________
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据:_______________________ (请逐一写出)
(1)自反应开始到反应结束,从小烧杯中可观察到的主要现象。(请依次写出)
(2)开始时产生气泡的速率较慢的原因是
(3)写出所形成的原电池的负极材料名称:
电极反应式:
(4)欲利用该反应来测定合金中铝的含量,还应测定的数据:
您最近一年使用:0次




