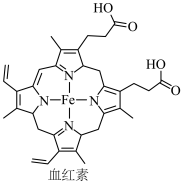
铁被誉为“工业之母”,铁也是人体必须的痕量元素之一,人体血液中血红蛋白中血红素结构如图。 )的基态价电子排布式是
)的基态价电子排布式是___________ 。
(2)血红素中C、N、O的第一电离能大小顺序为___________ 。
(3)血红素结构中含有吡咯( )单元。吡咯能与盐酸反应,从结构角度解释原因
)单元。吡咯能与盐酸反应,从结构角度解释原因___________ 。吡咯(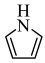 )的沸点高于噻吩(
)的沸点高于噻吩(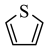 )的原因是
)的原因是___________ 。
(4) 的中毒是由于
的中毒是由于 与血红蛋白(Hb)发生配位反应,其反应方程式可表示为:
与血红蛋白(Hb)发生配位反应,其反应方程式可表示为: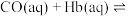
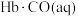 。已知
。已知 、
、 与血红素(Hb)的配位常数如下表:
与血红素(Hb)的配位常数如下表:
①写出一种与 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式___________ 。
②反应 的平衡常数
的平衡常数
___________ 。
③实验表明,当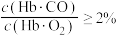 ,即可造成人的神经损伤。则吸入肺部的
,即可造成人的神经损伤。则吸入肺部的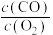 的必须低于
的必须低于___________ 。
(5)奥氏体是碳无序地分布在 中的间隙固溶体。
中的间隙固溶体。 晶胞结构如图,平均7个晶胞含有1个碳原子,则奥氏体中碳的质量分数约为
晶胞结构如图,平均7个晶胞含有1个碳原子,则奥氏体中碳的质量分数约为___________ (列计算式)。
 )的基态价电子排布式是
)的基态价电子排布式是(2)血红素中C、N、O的第一电离能大小顺序为
(3)血红素结构中含有吡咯(
 )单元。吡咯能与盐酸反应,从结构角度解释原因
)单元。吡咯能与盐酸反应,从结构角度解释原因 )的沸点高于噻吩(
)的沸点高于噻吩( )的原因是
)的原因是(4)
 的中毒是由于
的中毒是由于 与血红蛋白(Hb)发生配位反应,其反应方程式可表示为:
与血红蛋白(Hb)发生配位反应,其反应方程式可表示为: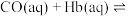
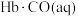 。已知
。已知 、
、 与血红素(Hb)的配位常数如下表:
与血红素(Hb)的配位常数如下表: |  | |
| 配位常数K | 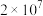 | 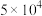 |
 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式②反应
 的平衡常数
的平衡常数
③实验表明,当
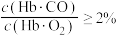 ,即可造成人的神经损伤。则吸入肺部的
,即可造成人的神经损伤。则吸入肺部的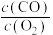 的必须低于
的必须低于(5)奥氏体是碳无序地分布在
 中的间隙固溶体。
中的间隙固溶体。 晶胞结构如图,平均7个晶胞含有1个碳原子,则奥氏体中碳的质量分数约为
晶胞结构如图,平均7个晶胞含有1个碳原子,则奥氏体中碳的质量分数约为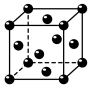
2024·福建福州·二模 查看更多[2]
更新时间:2024-04-05 16:14:49
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】二氧化碳的捕集、创新利用是世界能源领域的一个重要战略方向。
(1)用稀氨水喷雾捕集CO2。常温下,用氨水吸收CO2可得到NH4HCO3溶液。已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11。在NH4HCO3溶液中,c(NH4+)___________ (填“>”“<”或“=”)c(HCO3-);NH4HCO3溶液中物料守恒表达式为________ 。
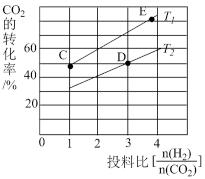
(2)CO2经催化加氢可合成低碳烯烃,合成乙烯的反应为2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) △H。向1 L恒容密闭容器中充入2 mol CO2(g)和n mol H2(g),在一定条件下发生该反应。CO2的转化率与温度、投料比[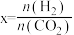 ]的关系如图所示:
]的关系如图所示:

①该反应的△H_______ 0(填“>”“<“或“=”)。
②图中x1________ (填“<”“>”或“=”)x2。
③若图中B点的投料比为2,则500℃时的平衡常数KB=________ 。
(3)工业上用CO2生产甲醇燃料,进一步可合成二甲醚。已知:298K和101kPa条件下,
反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(l) △H=—a kJ·mol-1
反应II:2H2(g)+O2(g)⇌2H2O(1) △H=-b kJ·mol-1
反应III:CH3OH(g)⇌CH3OH(l) △H=-c kJ·mol-1
①CH3OH(l)燃烧热的热化学方程式为_________ 。
②合成二甲醚的总反应为2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H=-130.8 kJ·mol-1。在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=______________ 。
(1)用稀氨水喷雾捕集CO2。常温下,用氨水吸收CO2可得到NH4HCO3溶液。已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11。在NH4HCO3溶液中,c(NH4+)
(2)CO2经催化加氢可合成低碳烯烃,合成乙烯的反应为2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) △H。向1 L恒容密闭容器中充入2 mol CO2(g)和n mol H2(g),在一定条件下发生该反应。CO2的转化率与温度、投料比[
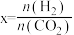 ]的关系如图所示:
]的关系如图所示:
①该反应的△H
②图中x1
③若图中B点的投料比为2,则500℃时的平衡常数KB=
(3)工业上用CO2生产甲醇燃料,进一步可合成二甲醚。已知:298K和101kPa条件下,
反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(l) △H=—a kJ·mol-1
反应II:2H2(g)+O2(g)⇌2H2O(1) △H=-b kJ·mol-1
反应III:CH3OH(g)⇌CH3OH(l) △H=-c kJ·mol-1
①CH3OH(l)燃烧热的热化学方程式为
②合成二甲醚的总反应为2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H=-130.8 kJ·mol-1。在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】我国力争于2030年前做到碳达峰,CO2和CH4催化重整制备合成气(主要成分为CO、H2)是CO2利用的研究热点之一,其中部分反应如下:
反应Ⅰ积碳反应:CH4(g) C(s)+2H2(g) ΔH1=+74.8kJ/mol
C(s)+2H2(g) ΔH1=+74.8kJ/mol
反应Ⅱ消碳反应:C(s)+CO2(g) 2CO(g) ΔH2=+172kJ/mol
2CO(g) ΔH2=+172kJ/mol
回答下列问题:
(1)催化重整反应CO2(g)+CH4(g) 2CO(g)+2H2(g) ΔH=
2CO(g)+2H2(g) ΔH=_________ 。
(2)催化重整反应中催化剂的活性会因积碳而降低,消碳反应则使积碳量减少。
①投料比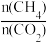
___________ (填“增大”或“减小”)有助于减少积碳。
②使用不同催化剂时,反应Ⅰ、Ⅱ活化能如下表所示:
由表中数据判断,使用催化剂___________ (填“X”或“Y”)催化重整反应速率较快。
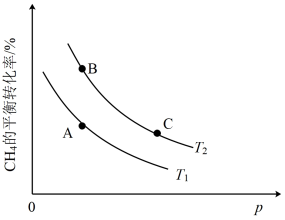
(3)一定条件下,催化重整反应CO2(g)+CH4(g) 2CO(g)+2H2(g)中CH4的平衡转化率与温度、压强的关系如图所示(不考虑副反应),则T1
2CO(g)+2H2(g)中CH4的平衡转化率与温度、压强的关系如图所示(不考虑副反应),则T1___________ T2(填“大于,小于或等于”);A、B、C三点对应的平衡常数KA、KB、KC的大小关系为___________ 。
(4)恒温下,往2L密闭容器中加入2molCH4、2molCO2进行该催化重整反应。
①2min后测得CO2的转化率为40%,则2min内平均反应速率v(CH4)=___________ mol·L-1·min-1。
②下列叙述能说明该反应达到平衡状态的是___________ (填序号)。
A.容器中混合气体的密度保持不变
B.容器中混合气体的压强保持不变
C.v正(CO2)=2v逆(CO)
D.断裂2mol C-H键的同时断裂1mol H-H键
(5)在恒温、体系总压恒定为P0kPa下,往密闭容器中加入2molCH4、2molCO2进行该催化重整反应,达到平衡状态时,CO2的转化率为50%。已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则该温度下的平衡常数Kp=___________ (kPa)2(用含P0的代数式表示)。
反应Ⅰ积碳反应:CH4(g)
 C(s)+2H2(g) ΔH1=+74.8kJ/mol
C(s)+2H2(g) ΔH1=+74.8kJ/mol 反应Ⅱ消碳反应:C(s)+CO2(g)
 2CO(g) ΔH2=+172kJ/mol
2CO(g) ΔH2=+172kJ/mol回答下列问题:
(1)催化重整反应CO2(g)+CH4(g)
 2CO(g)+2H2(g) ΔH=
2CO(g)+2H2(g) ΔH=(2)催化重整反应中催化剂的活性会因积碳而降低,消碳反应则使积碳量减少。
①投料比
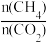
②使用不同催化剂时,反应Ⅰ、Ⅱ活化能如下表所示:
反应 | Ⅰ | Ⅱ |
催化剂X 活化能/kJ/mol | 33 | 91 |
催化剂Y活化能/kJ/mol | 43 | 72 |
(3)一定条件下,催化重整反应CO2(g)+CH4(g)
 2CO(g)+2H2(g)中CH4的平衡转化率与温度、压强的关系如图所示(不考虑副反应),则T1
2CO(g)+2H2(g)中CH4的平衡转化率与温度、压强的关系如图所示(不考虑副反应),则T1
(4)恒温下,往2L密闭容器中加入2molCH4、2molCO2进行该催化重整反应。
①2min后测得CO2的转化率为40%,则2min内平均反应速率v(CH4)=
②下列叙述能说明该反应达到平衡状态的是
A.容器中混合气体的密度保持不变
B.容器中混合气体的压强保持不变
C.v正(CO2)=2v逆(CO)
D.断裂2mol C-H键的同时断裂1mol H-H键
(5)在恒温、体系总压恒定为P0kPa下,往密闭容器中加入2molCH4、2molCO2进行该催化重整反应,达到平衡状态时,CO2的转化率为50%。已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则该温度下的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】采用催化剂存在下臭氧氧化—碱吸收法同时脱除SO2和NO。氧化过程中反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g) NO2(g)+O2(g) ΔH1=-200.9 kJ/mol Ea1=3.2 kJ/mol
NO2(g)+O2(g) ΔH1=-200.9 kJ/mol Ea1=3.2 kJ/mol
反应Ⅱ:SO2(g)+O3(g) SO3(g)+O2(g) ΔH2=-241.6 kJ/mol Ea2=56 kJ/mol
SO3(g)+O2(g) ΔH2=-241.6 kJ/mol Ea2=56 kJ/mol
已知该体系中臭氧会发生分解反应2O3(g) 3O2(g)。一定条件下,向容积为2 L的反应器充入2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,升高温度,体系中NO和SO2的转化率随温度T变化如图所示。
3O2(g)。一定条件下,向容积为2 L的反应器充入2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,升高温度,体系中NO和SO2的转化率随温度T变化如图所示。

(1)由图像可知,相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因:________ 。
(2)Q点发生分解反应的臭氧占充入臭氧总量的10%,则此时体系中剩余的O3物质的量是________ mol,反应Ⅱ在此温度下的平衡常数为________ (保留小数点后2位)。
反应Ⅰ:NO(g)+O3(g)
 NO2(g)+O2(g) ΔH1=-200.9 kJ/mol Ea1=3.2 kJ/mol
NO2(g)+O2(g) ΔH1=-200.9 kJ/mol Ea1=3.2 kJ/mol反应Ⅱ:SO2(g)+O3(g)
 SO3(g)+O2(g) ΔH2=-241.6 kJ/mol Ea2=56 kJ/mol
SO3(g)+O2(g) ΔH2=-241.6 kJ/mol Ea2=56 kJ/mol已知该体系中臭氧会发生分解反应2O3(g)
 3O2(g)。一定条件下,向容积为2 L的反应器充入2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,升高温度,体系中NO和SO2的转化率随温度T变化如图所示。
3O2(g)。一定条件下,向容积为2 L的反应器充入2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,升高温度,体系中NO和SO2的转化率随温度T变化如图所示。
(1)由图像可知,相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因:
(2)Q点发生分解反应的臭氧占充入臭氧总量的10%,则此时体系中剩余的O3物质的量是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: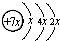 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E元素的正三价离子的3d亚层为半充满.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E元素的正三价离子的3d亚层为半充满.回答下列问题:
(1)写出下列元素的名称:A________ , B________ , C________ ,D________ 。
(2)用元素符号表示D所在周期第一电离能最大的元素是__________ ,电负性最大的元素是__________ 。
(3)D的氢化物比C的氢化物的沸点__________ (填“高“或“低“),原因__________ 。
(4)E元素的正三价离子的电子排布式为________________________ 。E元素在周期表中的位置是_________ 。
(5)用电子式表示B的硫化物的形成过程:_____________________________________ 。
(6)写出A的最高价氧化物与B的最高价氧化物的水化物反应的离子方程式________ 。
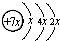 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E元素的正三价离子的3d亚层为半充满.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E元素的正三价离子的3d亚层为半充满.回答下列问题:(1)写出下列元素的名称:A
(2)用元素符号表示D所在周期第一电离能最大的元素是
(3)D的氢化物比C的氢化物的沸点
(4)E元素的正三价离子的电子排布式为
(5)用电子式表示B的硫化物的形成过程:
(6)写出A的最高价氧化物与B的最高价氧化物的水化物反应的离子方程式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。

请回答下列问题:
(1)A、B、C、D四种元素中,电负性最大的是___ (填元素符号)。
(2)B的氢化物的沸点远高于A的氢化物的主要原因是___ 。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为____ 。
(4)E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有___ 。
(5)最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为___ ;该晶体的化学式为___ 。

请回答下列问题:
(1)A、B、C、D四种元素中,电负性最大的是
(2)B的氢化物的沸点远高于A的氢化物的主要原因是
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为
(4)E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有
(5)最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】溴化铜(Ⅱ)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:

(1)铜元素位于周期表中第___ 族___ 区,基态Cu2+的核外电子排布式为______________ 。
(2)与NH4+互为等电子体的阴离子为__________________ 。
(3)MIm中碳原子杂化轨道类型为____________ ;1molMIm中含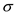 键数目为
键数目为________ mol。
(4)一种铜的溴化物晶胞结构如图所示。
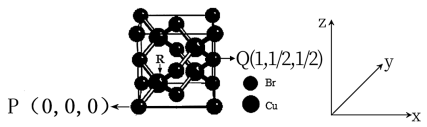
有关说法正确的是____________ (填序号)。
a.该化合物的化学式为CuBr2 b.铜的配位数为8
c.与每个Br紧邻的Br有12个
d.由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为(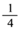 ,
,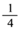 ,
,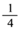 )
)

(1)铜元素位于周期表中第
(2)与NH4+互为等电子体的阴离子为
(3)MIm中碳原子杂化轨道类型为
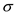 键数目为
键数目为(4)一种铜的溴化物晶胞结构如图所示。

有关说法正确的是
a.该化合物的化学式为CuBr2 b.铜的配位数为8
c.与每个Br紧邻的Br有12个
d.由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为(
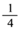 ,
,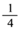 ,
,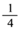 )
)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】磷锆晶体在离子交换、质子传导、催化、光化学等领域有潜在的应用前景,因而引发了大量的研究工作。已知磷锆晶体是一种典型的阳离子型层状化合物,结构如图所示。请回答:
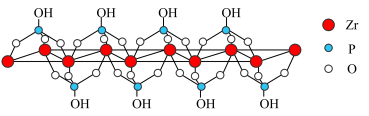
(1)测定磷锆晶体结构的方法(即获得如图)是______ 。
(2) 的中心原子的杂化方式为
的中心原子的杂化方式为______ ,离子的空间结构为______ 。
(3)已知基态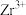 的电子排布式为
的电子排布式为 ,则基态
,则基态 原子的价层电子排布式为
原子的价层电子排布式为______ 。
(4)磷酸基团的 可在层内空间自由扩散,磷锆晶体在燃料电池中可以作
可在层内空间自由扩散,磷锆晶体在燃料电池中可以作______ 。
(5)利用磷锆晶体实现对大气中低浓度氨气选择性吸附,其吸附效率受 的影响,
的影响, 过低或过高,吸附率均不高的原因是
过低或过高,吸附率均不高的原因是______ 。
(6)磷锆晶体属于______ 晶体(填晶体类型名称),该晶体的化学式为______ 。

(1)测定磷锆晶体结构的方法(即获得如图)是
(2)
 的中心原子的杂化方式为
的中心原子的杂化方式为(3)已知基态
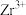 的电子排布式为
的电子排布式为 ,则基态
,则基态 原子的价层电子排布式为
原子的价层电子排布式为(4)磷酸基团的
 可在层内空间自由扩散,磷锆晶体在燃料电池中可以作
可在层内空间自由扩散,磷锆晶体在燃料电池中可以作(5)利用磷锆晶体实现对大气中低浓度氨气选择性吸附,其吸附效率受
 的影响,
的影响, 过低或过高,吸附率均不高的原因是
过低或过高,吸附率均不高的原因是(6)磷锆晶体属于
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】请回答下列问题。
(1)基态铁原子的价层电子排布式为_______ 。
(2)元素原子的第一电离能I1随原子序数呈周期性变化,请解释:
① Na的第一电离能小于Li,从原子结构的角度解释其原因_______ 。
② S的第一电离能小于P,解释其原因_______ 。
(3)33As、34Se、35Br三种非金属元素的电负性由大到小的顺序为_______ ;Br可与第三周期Cl元素形成化合物BrCl,其中显正价的元素为_______ ,原因是_______ 。
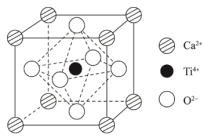
(4)钛酸钙是最典型的钙钛矿型化合物,该类化合物具有特殊的理化性质。钛酸钙的晶胞如下图所示,1个晶胞中含有O2-的个数是_______ ,离子半径Ca2+大于Ti4+,理由是_______ 。
(5)钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。
①已知钛酸钙晶胞的棱长为a pm,则钛酸钙晶体密度ρ=_______ g·cm-3(列出计算式)。
②若忽略离子替代时的体积变化,下列钙钛矿型化合物中,密度大于钛酸钙的是_______ (填字母序号)。
a. BaTiO3 b. MgTiO3 c. BaZrO3
(1)基态铁原子的价层电子排布式为
(2)元素原子的第一电离能I1随原子序数呈周期性变化,请解释:
① Na的第一电离能小于Li,从原子结构的角度解释其原因
② S的第一电离能小于P,解释其原因
(3)33As、34Se、35Br三种非金属元素的电负性由大到小的顺序为
(4)钛酸钙是最典型的钙钛矿型化合物,该类化合物具有特殊的理化性质。钛酸钙的晶胞如下图所示,1个晶胞中含有O2-的个数是

(5)钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。
①已知钛酸钙晶胞的棱长为a pm,则钛酸钙晶体密度ρ=
②若忽略离子替代时的体积变化,下列钙钛矿型化合物中,密度大于钛酸钙的是
a. BaTiO3 b. MgTiO3 c. BaZrO3
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】C、N、P、S及其化合物在医药化工领域应用十分广泛。请回答:
(1)①基态磷原子核外电子共有___________ 种运动状态。磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,写出该激发态磷原子的核外电子排布式___________ 。
②沸点:
___________  (填“>、<、=”),分析其原因
(填“>、<、=”),分析其原因___________ 。
(2)氨硼烷 (分子中N和B最外层均满足8电子),与水反应的离子方程式为:
(分子中N和B最外层均满足8电子),与水反应的离子方程式为: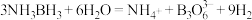 ,
, 的结构为
的结构为 。下列说法正确的是___________。
。下列说法正确的是___________。
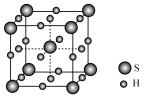
(3)单质硫和氢气一定条件下可形成一种新材料,其晶胞如图,晶胞边长为anm, 表示阿伏加德罗常数的值,晶体密度为
表示阿伏加德罗常数的值,晶体密度为___________  。
。
(1)①基态磷原子核外电子共有
②沸点:

 (填“>、<、=”),分析其原因
(填“>、<、=”),分析其原因(2)氨硼烷
 (分子中N和B最外层均满足8电子),与水反应的离子方程式为:
(分子中N和B最外层均满足8电子),与水反应的离子方程式为: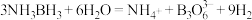 ,
, 的结构为
的结构为 。下列说法正确的是___________。
。下列说法正确的是___________。A. 中存在配位键,N原子提供孤电子对 中存在配位键,N原子提供孤电子对 |
B.该反应中,氧化剂是 |
C.第一电离能大小: |
D.该反应中,B原子的杂化轨道类型由 变为 变为 |
 表示阿伏加德罗常数的值,晶体密度为
表示阿伏加德罗常数的值,晶体密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式________________________ 。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为_______ 个、_______ 个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂, 常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为______________ 、_______ (各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图所示。
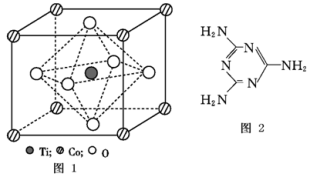
三聚氰胺分子中氮原子轨道杂化类型是______ ,1 mol三聚氰胺分子中σ键的数目为_______ 。
(1)写出基态Mn原子的核外电子排布式
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂, 常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为
(4)三聚氰胺是一种含氮化合物,其结构简式如图所示。

三聚氰胺分子中氮原子轨道杂化类型是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________ 区;溴的价电子排布式为_________ ;
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2 形式存在的。使氢氟酸分子缔合的作用力是________ ;
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图 I、 II 所示:
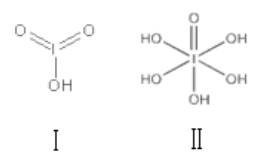
请比较二者酸性强弱: HIO3_____ (填“>”、“<”或“=”)H5IO6;
(4)已知 ClO2- 为 V 形结构,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________ ,写出一个ClO2-的等电子体_________ ;
(5)如图为碘晶体晶胞结构。有关说法中正确的是_____________ 。
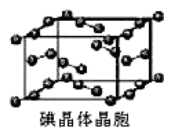
A.碘分子排列有2 种不同取向,2 种取向不同的碘分子以4 配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有 4 个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(6)已知 CaF2 晶体(如图)的密度为 ρg/cm3, NA为阿伏伽德罗常数,棱上相邻的两个 Ca2+的核间距为 a cm,则CaF2 的相对分子质量可以表示为___________ 。

(1)卤族元素位于元素周期表的
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2 形式存在的。使氢氟酸分子缔合的作用力是
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图 I、 II 所示:

请比较二者酸性强弱: HIO3
(4)已知 ClO2- 为 V 形结构,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为
(5)如图为碘晶体晶胞结构。有关说法中正确的是

A.碘分子排列有2 种不同取向,2 种取向不同的碘分子以4 配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有 4 个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(6)已知 CaF2 晶体(如图)的密度为 ρg/cm3, NA为阿伏伽德罗常数,棱上相邻的两个 Ca2+的核间距为 a cm,则CaF2 的相对分子质量可以表示为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】请回答:
(1)路易斯酸碱电子理论认为,凡是能给出电子对的物质叫做碱;凡是能接受电子对的物质叫做酸。则BF3属于_______ (选填“酸”或“碱”),理由是:_______ 。
(2)科学家成功地在高压下将CO2转化为具有类似SiO2的共价晶体,则两种共价晶体的熔点:SiO2_______ CO2(选填“>”或“<”),理由是:_______ 。
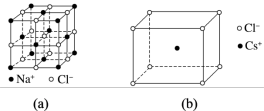
(3)金属铯(Cs)位于元素周期表中第六周期第ⅠA族,氯化钠与氯化铯晶体中离子的排列方式如图(a)、(b)所示。造成两种化合物晶体结构不同的原因是_______ 。
(4)磷化硼晶体的晶胞如图(c)所示。
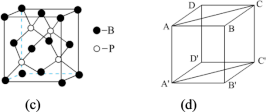
①磷化硼(BP)晶体中“一般共价键”与配位键的数目之比为_______ 。
②根据图(c),图(d)中矩形ACC’A’是沿晶胞对角面取得的截图。晶胞中各原子在矩形ACC’A’的位置为_______ (填标号)。
A. B.
B.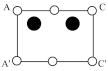 C.
C.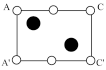 D.
D.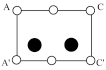
③若最近的B和P的距离为a pm,阿伏加德罗常数的值为NA,晶体的密度为_______ (列出计算表达式,不要求化简)。
(1)路易斯酸碱电子理论认为,凡是能给出电子对的物质叫做碱;凡是能接受电子对的物质叫做酸。则BF3属于
(2)科学家成功地在高压下将CO2转化为具有类似SiO2的共价晶体,则两种共价晶体的熔点:SiO2
(3)金属铯(Cs)位于元素周期表中第六周期第ⅠA族,氯化钠与氯化铯晶体中离子的排列方式如图(a)、(b)所示。造成两种化合物晶体结构不同的原因是

(4)磷化硼晶体的晶胞如图(c)所示。

①磷化硼(BP)晶体中“一般共价键”与配位键的数目之比为
②根据图(c),图(d)中矩形ACC’A’是沿晶胞对角面取得的截图。晶胞中各原子在矩形ACC’A’的位置为
A.
 B.
B. C.
C. D.
D.
③若最近的B和P的距离为a pm,阿伏加德罗常数的值为NA,晶体的密度为
您最近一年使用:0次



