 是一种重要的化工品,一定温度下发生分解反应:
是一种重要的化工品,一定温度下发生分解反应:①


②
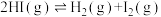
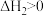
③
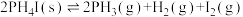

回答下列问题:
(1)

 和
和 的式子表示),
的式子表示),
(2)向一恒温恒容密闭容器中投入足量
 (s),只发生反应①,下列叙述正确的是
(s),只发生反应①,下列叙述正确的是A.平衡后,再充入少量
 ,
, 质量增大
质量增大B.
 体积分数不变时,该反应达到平衡状态
体积分数不变时,该反应达到平衡状态C.再投入一定量的
 (s),反应速率明显增大
(s),反应速率明显增大(3)
 的速率方程为
的速率方程为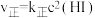 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。①某温度下,K=15,
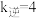 ,则
,则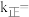
②已知:
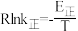 (R为常数,
(R为常数, 的单位为
的单位为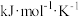 ,温度T的单位为K,E的单位为
,温度T的单位为K,E的单位为 )速率常数
)速率常数 与活化能(
与活化能(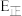 )、温度(T)的关系如图所示(Cat1、Cat2为催化剂)。
)、温度(T)的关系如图所示(Cat1、Cat2为催化剂)。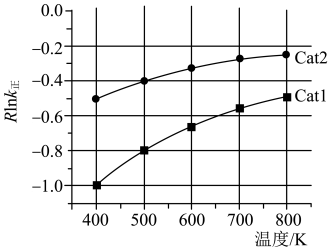
 。
。(4)一定温度下,向一体积为1L的恒容密闭容器中充入足量
 (s),达到平衡时测得生成1mol
(s),达到平衡时测得生成1mol  (g)和0.4mol
(g)和0.4mol  ,则
,则 的平衡常数K=
的平衡常数K=
更新时间:2024-04-28 08:35:32
|
相似题推荐
【推荐1】“低碳生活,绿色出行”已经成为很多人的生活理念。CO2的捕捉和利用也成为了科学家们积极探索的热门领域。回答下列问题:
(1)用CO2催化加氢可制取乙烯,其能量关系如图,写出该反应的热化学方程式_______ 。

(2)以硫酸作电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图。则A为电池的_______ 极,N极的电极反应式为_______ 。

(3)用 CO2催化加氢制取二甲醚的反应为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)在恒容密闭容器中,均充入2molCO2和6molH2,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率a(CO2)随反应温度的变化情况下图所示:
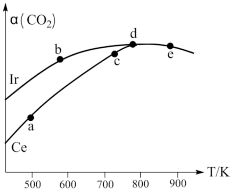
①用Ir和Ce作催化剂时,反应的活化能更低的是_______ 。
②a、b、c、d和e五种状态,反应一定达到平衡状态的是_______ ,反应的△H_______ 0.(填 “>”、“=”、“<”)
③从状态a到c,CO2转化率不断增大的原因是_______ 。
④ 状态e时,a(CO2)=50%,若保持容器容积为10L,则此时的平衡常数K=_______
(1)用CO2催化加氢可制取乙烯,其能量关系如图,写出该反应的热化学方程式

(2)以硫酸作电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图。则A为电池的

(3)用 CO2催化加氢制取二甲醚的反应为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)在恒容密闭容器中,均充入2molCO2和6molH2,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率a(CO2)随反应温度的变化情况下图所示:

①用Ir和Ce作催化剂时,反应的活化能更低的是
②a、b、c、d和e五种状态,反应一定达到平衡状态的是
③从状态a到c,CO2转化率不断增大的原因是
④ 状态e时,a(CO2)=50%,若保持容器容积为10L,则此时的平衡常数K=
您最近一年使用:0次
【推荐2】 .
. 的转化和利用是实现碳中和的有效途径。
的转化和利用是实现碳中和的有效途径。
(1)在298K、100kPa时,已知:
C(s,石墨)

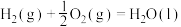



在298K时由C(s,石墨)和 (g)反应生成1mol
(g)反应生成1mol  (g)的热化学方程式为
(g)的热化学方程式为___________ 。
 .
. 转化为
转化为 被认为是实现最可能利用的路径,该路径涉及反应如下:
被认为是实现最可能利用的路径,该路径涉及反应如下:
主反应:

副反应:
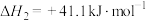
(2)工业合成甲醇通常控制温度为400℃左右,请从反应速率与化学平衡的角度分析其主要原因是___________ 。
(3)在恒温恒压(1.8MPa,400℃)下, 和
和 按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
已知:i.分子筛膜催化反应器(B)具有催化反应、分离出部分水蒸气的双重功能;
ii. 的选择性=
的选择性= 。
。
①在普通反应器(A)中,下列能作为反应(主反应和副反应)达到平衡状态的判据是___________ (填序号)。
A.气体压强不再变化 B.气体的密度不再改变
C. D.各物质浓度比不再改变
D.各物质浓度比不再改变
②在反应器(B)中, 的平衡转化率明显高于反应器(A),可能的原因是
的平衡转化率明显高于反应器(A),可能的原因是___________ 。
③若普通反应器(A)中初始时 ,主反应从开始到平衡态的平均反应速率
,主反应从开始到平衡态的平均反应速率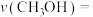
___________  ;副反应的化学平衡常数
;副反应的化学平衡常数
___________ (用最简的分数表示)。
 .近年来,有研究人员用
.近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示。
的回收利用,其工作原理如图所示。___________ ;若Cu电极上只生成0.15mol  和0.3mol
和0.3mol  ,则Pt电极上产生
,则Pt电极上产生 的物质的量
的物质的量___________ mol。
 .
. 的转化和利用是实现碳中和的有效途径。
的转化和利用是实现碳中和的有效途径。(1)在298K、100kPa时,已知:
C(s,石墨)


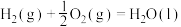



在298K时由C(s,石墨)和
 (g)反应生成1mol
(g)反应生成1mol  (g)的热化学方程式为
(g)的热化学方程式为 .
. 转化为
转化为 被认为是实现最可能利用的路径,该路径涉及反应如下:
被认为是实现最可能利用的路径,该路径涉及反应如下:主反应:


副反应:

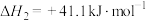
(2)工业合成甲醇通常控制温度为400℃左右,请从反应速率与化学平衡的角度分析其主要原因是
(3)在恒温恒压(1.8MPa,400℃)下,
 和
和 按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。
按体积比1∶3分别在普通反应器(A)和分子筛膜催化反应器(B)中反应,测得相关数据如下表。| 反应器 |  平衡转化率 平衡转化率 | 甲醇的选择性 | 达到平衡时间/s |
| 普通反应器(A) | 25.0% | 80.0% | 10.0 |
| 分子筛膜催化反应器(B) | a>25.0% | 100.0% | 8.0 |
ii.
 的选择性=
的选择性= 。
。①在普通反应器(A)中,下列能作为反应(主反应和副反应)达到平衡状态的判据是
A.气体压强不再变化 B.气体的密度不再改变
C.
 D.各物质浓度比不再改变
D.各物质浓度比不再改变②在反应器(B)中,
 的平衡转化率明显高于反应器(A),可能的原因是
的平衡转化率明显高于反应器(A),可能的原因是③若普通反应器(A)中初始时
 ,主反应从开始到平衡态的平均反应速率
,主反应从开始到平衡态的平均反应速率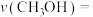
 ;副反应的化学平衡常数
;副反应的化学平衡常数
 .近年来,有研究人员用
.近年来,有研究人员用 通过电催化生成多种燃料,实现
通过电催化生成多种燃料,实现 的回收利用,其工作原理如图所示。
的回收利用,其工作原理如图所示。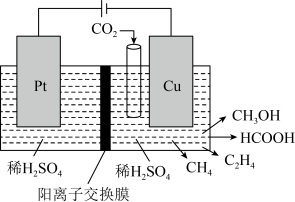
 和0.3mol
和0.3mol  ,则Pt电极上产生
,则Pt电极上产生 的物质的量
的物质的量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氮及其化合物在生产生活中有广泛应用,请回答下列问题。

(1)N4气态分子结构如图1所示,已知断裂1molN—N吸收l67kJ的热量,生成lmol N N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式
N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式______________ 。
(2)盐N2H6Cl2是离子化合物,性质与NH4Cl类似,其水溶液呈弱酸性。写出足量金属镁加入N2H6Cl2溶液中所发生反应的化学方程式________________ 。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN)且生成N2。若有8.4 g N2生成,则转移电子数为_______ 。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为_____________ ;若最终得到1mol Y产品,则理论上需要消耗标准状况下O2的体积为__________ L。


(1)N4气态分子结构如图1所示,已知断裂1molN—N吸收l67kJ的热量,生成lmol N
 N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式
N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式(2)盐N2H6Cl2是离子化合物,性质与NH4Cl类似,其水溶液呈弱酸性。写出足量金属镁加入N2H6Cl2溶液中所发生反应的化学方程式
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN)且生成N2。若有8.4 g N2生成,则转移电子数为
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】研究二氧化碳合成甲醇对实现“碳中和”具有重要意义,二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H平衡常数K,该反应一般认为通过如下步骤来实现,反应进程与体系能量变化关系如图所示:
CH3OH(g)+H2O(g) ∆H平衡常数K,该反应一般认为通过如下步骤来实现,反应进程与体系能量变化关系如图所示:

①CO2(g)+H2(g) CO(g)+H2O(g) ∆H1=akJ/mol 平衡常数K1
CO(g)+H2O(g) ∆H1=akJ/mol 平衡常数K1
②2H2(g)+CO(g) CH3OH(g) ∆H2=-bkJ/mol 平衡常数K2
CH3OH(g) ∆H2=-bkJ/mol 平衡常数K2
回答下列问题:
(1)∆H=___________ (用含a、b的代数式表示)
(2)二氧化碳加氢制甲醇的总反应的化学平衡常数表达式为:K=___________ 。
(3)对于合成甲醇的总反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。达到平衡后,要加快其反应速率并提高H2的转化率,可采取的措施有
CH3OH(g)+H2O(g)。达到平衡后,要加快其反应速率并提高H2的转化率,可采取的措施有___________ (填字母)。
A.缩小反应容器的容积
B.使用合适的催化剂
C.从平衡体系中及时分离出CH3OH
D.升高温度
E.再充入一定量的CO2气体
(4)一定温度下,将CO2和H2以物质的量之比为1:1充入盛有催化剂的恒容密闭容器中,发生合成甲醇的总反应:某时刻t1,当下列量不再变化时,一定能说明该反应处于平衡状态的是___________ (填字母)
A.平衡常数K不再变化
B.CH3OH的体积分数不再变化
C.CO2和H2物质的量之比
D.反应的焓变∆H不再变化
E.混合气体的密度
F.密闭容器中的压强
(5)已知:500℃时,K1=2.5,K2=1.0。对于合成甲醇总反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)某一时刻测得容器内各物质的物质的量浓度分别为:CO2为2mol/L,H2为1.5mol/L,CH3OH为1mol/L,H2O为3mol/L,则此时反应向
CH3OH(g)+H2O(g)某一时刻测得容器内各物质的物质的量浓度分别为:CO2为2mol/L,H2为1.5mol/L,CH3OH为1mol/L,H2O为3mol/L,则此时反应向___________ (填“正反应方向”或“逆反应方向”)进行。
(6)甲醇燃料电池工作原理如图所示:

通入a气体的电极为原电池的___________ (填“正”或“负”)极,其电极反应式为___________ 。
 CH3OH(g)+H2O(g) ∆H平衡常数K,该反应一般认为通过如下步骤来实现,反应进程与体系能量变化关系如图所示:
CH3OH(g)+H2O(g) ∆H平衡常数K,该反应一般认为通过如下步骤来实现,反应进程与体系能量变化关系如图所示:
①CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H1=akJ/mol 平衡常数K1
CO(g)+H2O(g) ∆H1=akJ/mol 平衡常数K1②2H2(g)+CO(g)
 CH3OH(g) ∆H2=-bkJ/mol 平衡常数K2
CH3OH(g) ∆H2=-bkJ/mol 平衡常数K2回答下列问题:
(1)∆H=
(2)二氧化碳加氢制甲醇的总反应的化学平衡常数表达式为:K=
(3)对于合成甲醇的总反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。达到平衡后,要加快其反应速率并提高H2的转化率,可采取的措施有
CH3OH(g)+H2O(g)。达到平衡后,要加快其反应速率并提高H2的转化率,可采取的措施有A.缩小反应容器的容积
B.使用合适的催化剂
C.从平衡体系中及时分离出CH3OH
D.升高温度
E.再充入一定量的CO2气体
(4)一定温度下,将CO2和H2以物质的量之比为1:1充入盛有催化剂的恒容密闭容器中,发生合成甲醇的总反应:某时刻t1,当下列量不再变化时,一定能说明该反应处于平衡状态的是
A.平衡常数K不再变化
B.CH3OH的体积分数不再变化
C.CO2和H2物质的量之比
D.反应的焓变∆H不再变化
E.混合气体的密度
F.密闭容器中的压强
(5)已知:500℃时,K1=2.5,K2=1.0。对于合成甲醇总反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)某一时刻测得容器内各物质的物质的量浓度分别为:CO2为2mol/L,H2为1.5mol/L,CH3OH为1mol/L,H2O为3mol/L,则此时反应向
CH3OH(g)+H2O(g)某一时刻测得容器内各物质的物质的量浓度分别为:CO2为2mol/L,H2为1.5mol/L,CH3OH为1mol/L,H2O为3mol/L,则此时反应向(6)甲醇燃料电池工作原理如图所示:

通入a气体的电极为原电池的
您最近一年使用:0次
【推荐2】近年来我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年头现“碳达峰”,2060年实现“碳中和”。因此将 转化为高附加值化学品成为科学家研究的重要课题。
转化为高附加值化学品成为科学家研究的重要课题。
工业上在Cu-ZnO催化下利用 发生如下反应ⅰ来生产甲醇,同时伴有反应ⅱ发生。
发生如下反应ⅰ来生产甲醇,同时伴有反应ⅱ发生。
反应ⅰ:

反应ⅱ:
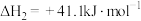
(1)反应 的
的
_______  。
。
(2)恒温下, 和
和 在恒容密闭容器发生反应ⅰ、ⅱ,下列能表明上述反应已达到平衡状态的有_______(填标号)。
在恒容密闭容器发生反应ⅰ、ⅱ,下列能表明上述反应已达到平衡状态的有_______(填标号)。
(3)不同条件下,按照 投料,
投料, 的平衡转化率如下图所示。
的平衡转化率如下图所示。
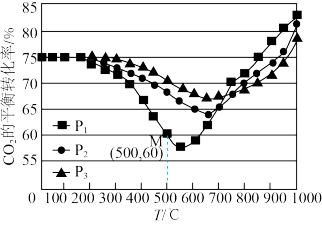
①压强P1、P2、P3由大到小的顺序是_______ 。压强为P1时,温度高于570℃之后,随着温度升高 平衡转化率增大的原因是
平衡转化率增大的原因是_______ 。
②图中点M(500,60),此时压强P1为0.2MPa, 的选择性为
的选择性为 (选择性:生成
(选择性:生成 所消耗的
所消耗的 占全部转化的
占全部转化的 的比)。则该温度时反应ⅰ的平衡常数
的比)。则该温度时反应ⅰ的平衡常数
_______  (分压=总压×物质的量分数)。
(分压=总压×物质的量分数)。
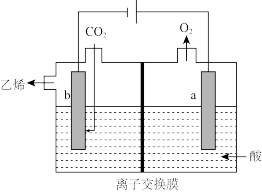
Ⅱ.电化学法还原二氧化碳制乙烯
(4)在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示,阴极电极反应式为_______ ,该装置中使用的是_______ (填“阴”或“阳”)离子交换膜。
 转化为高附加值化学品成为科学家研究的重要课题。
转化为高附加值化学品成为科学家研究的重要课题。工业上在Cu-ZnO催化下利用
 发生如下反应ⅰ来生产甲醇,同时伴有反应ⅱ发生。
发生如下反应ⅰ来生产甲醇,同时伴有反应ⅱ发生。反应ⅰ:


反应ⅱ:

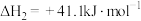
(1)反应
 的
的
 。
。(2)恒温下,
 和
和 在恒容密闭容器发生反应ⅰ、ⅱ,下列能表明上述反应已达到平衡状态的有_______(填标号)。
在恒容密闭容器发生反应ⅰ、ⅱ,下列能表明上述反应已达到平衡状态的有_______(填标号)。| A.每断裂1mol H-H键,同时生成1mol O-H键 |
B.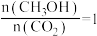 |
| C.混合气体的平均相对分子质量不变 |
| D.混合气体的压强不变 |
 投料,
投料, 的平衡转化率如下图所示。
的平衡转化率如下图所示。
①压强P1、P2、P3由大到小的顺序是
 平衡转化率增大的原因是
平衡转化率增大的原因是②图中点M(500,60),此时压强P1为0.2MPa,
 的选择性为
的选择性为 (选择性:生成
(选择性:生成 所消耗的
所消耗的 占全部转化的
占全部转化的 的比)。则该温度时反应ⅰ的平衡常数
的比)。则该温度时反应ⅰ的平衡常数
 (分压=总压×物质的量分数)。
(分压=总压×物质的量分数)。Ⅱ.电化学法还原二氧化碳制乙烯
(4)在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示,阴极电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式:2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的
___ 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=_____________ 。
(3)计算4s时NO的转化率为____________ 。
(4)下列措施能提高NO和CO转变成CO2和N2的反应速率的是______ (填序号)。
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)由上表数据可知,该反应在第______ s达到化学平衡状态。假如上述反应在密闭恒容容器中进行,判断该反应是否达到平衡的依据为________ (填序号)。
A.压强不随时间改变B.气体的密度不随时间改变
C.c(NO)不随时间改变D.单位时间里消耗NO和CO的物质的量相等
(6)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
①请在上表格中填入剩余的实验条件数据_____ 、_____ 、______ 、______ 、______ 。
 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) /mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) /mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的

(2)前2s内的平均反应速率v(N2)=
(3)计算4s时NO的转化率为
(4)下列措施能提高NO和CO转变成CO2和N2的反应速率的是
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)由上表数据可知,该反应在第
A.压强不随时间改变B.气体的密度不随时间改变
C.c(NO)不随时间改变D.单位时间里消耗NO和CO的物质的量相等
(6)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2·g-1 |
| Ⅰ | 280 | 1.20×10-3 | 82 | |
| Ⅱ | 5.80×10-3 | 124 | ||
| Ⅲ | 350 | 124 |
①请在上表格中填入剩余的实验条件数据
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】二氧化碳加氢制甲醇和甲烷重整对碳资源利用具有重要的战略意义。回答下列问题:
(1) 加氢选择合成甲醇的主要反应如下:
加氢选择合成甲醇的主要反应如下:
反应ⅰ: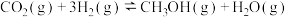

反应ⅱ: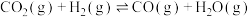
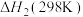
反应ⅲ:
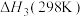
①在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,下表为298K时几种物质的标准摩尔生成焓( )。
)。
有利于反应ⅰ自发进行的条件是___________ (填“高温”或“低温”);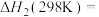
___________  。
。
②反应ⅱ的反应速率 ,其中
,其中 、
、 分别为正、逆反应速率常数。该反应的平衡常数
分别为正、逆反应速率常数。该反应的平衡常数 ,则m=
,则m=___________ ,升高温度时,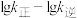
___________ (填“增大”、“减小”或“不变”)。
(2)甲烷重整工艺主要包括甲烷三重整制氢、甲烷二氧化碳重整制氢等。
甲烷三重整制氢的逆反应为 。将
。将 与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为
与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为 ,在
,在 条件下
条件下 与p的关系、在
与p的关系、在 条件下
条件下 与t的关系如图所示:
与t的关系如图所示:
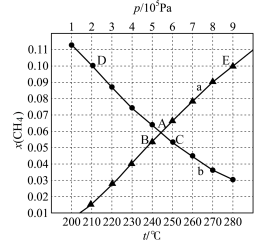
①当CO的平衡转化率为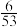 时,反应条件可能是
时,反应条件可能是___________ ;图中能表示相同状态下、相同平衡状态的点是___________ 。
②210℃时,甲烷三重整制氢反应的标准平衡常数
___________ 。(已知:分压=总压×该组分物质的量分数,对于反应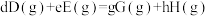 ,
, ,其中
,其中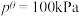 ,
,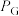 、
、 、
、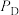 、
、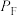 为各组分的平衡分压)
为各组分的平衡分压)
(1)
 加氢选择合成甲醇的主要反应如下:
加氢选择合成甲醇的主要反应如下:反应ⅰ:
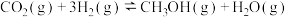

反应ⅱ:
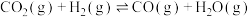
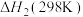
反应ⅲ:

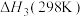
①在一定温度下,由最稳定单质生成1mol某物质的焓变叫做该物质的标准摩尔生成焓,下表为298K时几种物质的标准摩尔生成焓(
 )。
)。| 物质 |  |  |  |  |  |  |
 | 0 | 0 | -110.5 | -393.5 | -241.8 | -201.2 |
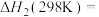
 。
。②反应ⅱ的反应速率
 ,其中
,其中 、
、 分别为正、逆反应速率常数。该反应的平衡常数
分别为正、逆反应速率常数。该反应的平衡常数 ,则m=
,则m=
(2)甲烷重整工艺主要包括甲烷三重整制氢、甲烷二氧化碳重整制氢等。
甲烷三重整制氢的逆反应为
 。将
。将 与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为
与CO按物质的量之比3∶1加入反应装置,在不同条件下达到平衡时甲烷的物质的量分数为 ,在
,在 条件下
条件下 与p的关系、在
与p的关系、在 条件下
条件下 与t的关系如图所示:
与t的关系如图所示:
①当CO的平衡转化率为
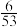 时,反应条件可能是
时,反应条件可能是②210℃时,甲烷三重整制氢反应的标准平衡常数

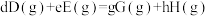 ,
, ,其中
,其中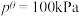 ,
, 、
、 、
、 、
、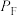 为各组分的平衡分压)
为各组分的平衡分压)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铟是一种稀有贵金属,广泛应用于航空航天、太阳能电池等高科技领域。从铜烟灰酸浸渣(主要含PbO、 、
、 、
、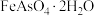 )中提取铟的工艺如图所示:
)中提取铟的工艺如图所示:
(1)铟(In)分布在元素周期表__________ 区,基态铟原子简化的核外电子排布式为__________ 。
(2)①“水浸”工艺中的滤渣除 外,还含有
外,还含有__________ 。
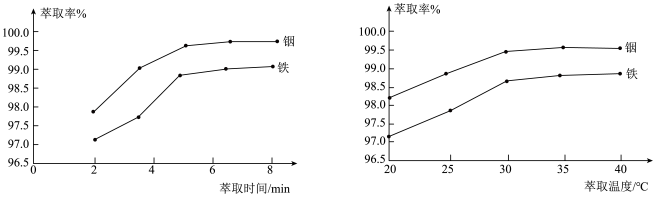
②在其他条件一定时,“水浸”铟、铁的萃取率结果如图所示,则萃取所采用的最佳条件为:萃取时间__________ ,萃取温度__________ 。__________ 。
(4)通过萃取除铁、反萃取、置换等过程,可制备金属铟。已知 能被有机萃取剂P204(简称
能被有机萃取剂P204(简称 )萃取,其萃取原理可表示为
)萃取,其萃取原理可表示为 ,平衡常数为K.已知
,平衡常数为K.已知 与萃取率(E%)的关系符合公式:
与萃取率(E%)的关系符合公式: 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=__________ ( ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。
(5)一种铜铟硒晶体(化学式为 )的晶胞结构如图所示,晶胞中In和Se未标明,用A或者B代替。推断In是
)的晶胞结构如图所示,晶胞中In和Se未标明,用A或者B代替。推断In是__________ (填“A”或“B”),晶体中1mol Cu周围与它最近且等距离的A粒子的数目为__________ 。
 、
、 、
、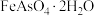 )中提取铟的工艺如图所示:
)中提取铟的工艺如图所示: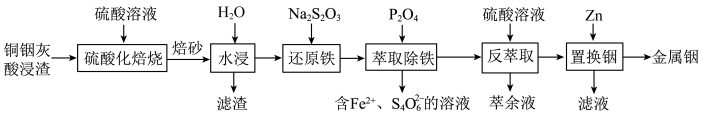
(1)铟(In)分布在元素周期表
(2)①“水浸”工艺中的滤渣除
 外,还含有
外,还含有②在其他条件一定时,“水浸”铟、铁的萃取率结果如图所示,则萃取所采用的最佳条件为:萃取时间
(4)通过萃取除铁、反萃取、置换等过程,可制备金属铟。已知
 能被有机萃取剂P204(简称
能被有机萃取剂P204(简称 )萃取,其萃取原理可表示为
)萃取,其萃取原理可表示为 ,平衡常数为K.已知
,平衡常数为K.已知 与萃取率(E%)的关系符合公式:
与萃取率(E%)的关系符合公式: 。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%,若将萃取率提升到95%,应调节溶液的pH= ,忽略萃取剂浓度的变化,结果保留三位有效数字)。
,忽略萃取剂浓度的变化,结果保留三位有效数字)。(5)一种铜铟硒晶体(化学式为
 )的晶胞结构如图所示,晶胞中In和Se未标明,用A或者B代替。推断In是
)的晶胞结构如图所示,晶胞中In和Se未标明,用A或者B代替。推断In是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在一个容积不变的密闭容器中发生如下反应:CO(g)+H2O(g)  CO2(g)+ H2(g),其平衡常数(K)和温度(t)的关系如下表所示。
CO2(g)+ H2(g),其平衡常数(K)和温度(t)的关系如下表所示。
请填写下列空白。
(1)该反应的平衡常数表达式为K=___________ ;该反应为___________ 反应。(填“吸热”或“放热”)
(2)在700℃时,向容器中充入1 mol CO、3 mol H2O,保持温度不变,反应达到平衡后,其平衡常数___________ 1.67(填“大于”“小于”或“等于”)。
(3)800℃时,某时刻反应混合物中CO、H2O、CO2、H2的浓度分别为1mol/L、1mol/L、2mol/L、 2mol/L。此时上述反应平衡移动方向为___________ 。(填“正反应方向” “逆反应方向”或“不移动”)
(4)若题(3)的体系达平衡状态时,CO的物质的浓度为___________ mol/L
 CO2(g)+ H2(g),其平衡常数(K)和温度(t)的关系如下表所示。
CO2(g)+ H2(g),其平衡常数(K)和温度(t)的关系如下表所示。| t/℃ | 700 | 800 | 1000 | 1200 |
| K | 1.67 | 1.0 | 0.58 | 0.38 |
请填写下列空白。
(1)该反应的平衡常数表达式为K=
(2)在700℃时,向容器中充入1 mol CO、3 mol H2O,保持温度不变,反应达到平衡后,其平衡常数
(3)800℃时,某时刻反应混合物中CO、H2O、CO2、H2的浓度分别为1mol/L、1mol/L、2mol/L、 2mol/L。此时上述反应平衡移动方向为
(4)若题(3)的体系达平衡状态时,CO的物质的浓度为
您最近一年使用:0次



