下列关于浓度均为 的
的 溶液和
溶液和 溶液的说法
溶液的说法不正确 的是
 的
的 溶液和
溶液和 溶液的说法
溶液的说法A.溶液 : : |
| B.两种溶液中粒子种类不相同 |
C.均能与 反应产生沉淀 反应产生沉淀 |
D.溶液中均存在: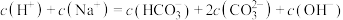 |
2024·北京东城·二模 查看更多[2]
更新时间:2024-05-21 21:48:00
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】用 表示阿伏加德罗常数的值,下列叙述中正确的是
表示阿伏加德罗常数的值,下列叙述中正确的是
 表示阿伏加德罗常数的值,下列叙述中正确的是
表示阿伏加德罗常数的值,下列叙述中正确的是A.常温常压下,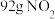 和 和 的混合气体含有的原子数为 的混合气体含有的原子数为 |
B.将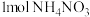 固体溶于一定浓度氨水中,溶液呈中性,溶液中 固体溶于一定浓度氨水中,溶液呈中性,溶液中 数目为 数目为 |
C.向 溶液中通入适量 溶液中通入适量 ,当有 ,当有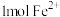 被氧化时,共转移电子的数目为 被氧化时,共转移电子的数目为 |
D. 中含有 中含有 键的数目为 键的数目为 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】下列关系的表述中,正确的是
A.0.1mol∙L﹣1NaHSO4溶液中:c( )+c( )+c(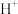 )=c( )=c( )+c( )+c(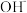 ) ) |
B.0.1mol∙L﹣1NaHCO3溶液中:c( )>c( )>c( )>c( )>c( )>c(H2CO3) )>c(H2CO3) |
| C.中和浓度和体积都相同的盐酸和醋酸,消耗同浓度的NaOH溶液的体积之比为1:1 |
| D.pH=3的盐酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】常温下, 某一元酸(
某一元酸( )溶液中
)溶液中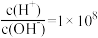 ,下列叙述
,下列叙述不正确 的是
 某一元酸(
某一元酸( )溶液中
)溶液中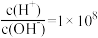 ,下列叙述
,下列叙述A.该溶液与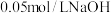 溶液等体积混合后: 溶液等体积混合后: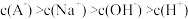 |
B.常温下 的电离平衡常数约为 的电离平衡常数约为 |
C.该溶液中水电离出的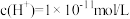 |
D.向该溶液中加入一定量水稀释,溶液中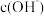 增大 增大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】已知在常温下测得浓度均为 的三种溶液的pH如下:
的三种溶液的pH如下:
下列说法正确的是( )
 的三种溶液的pH如下:
的三种溶液的pH如下:| 溶液 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 |
| pH | 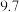 | 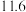 | 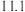 |
A.其溶液中阳离子的物质的量浓度之和: |
B.相同条件下的酸性: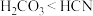 |
C.将NaCN溶液稀释为原来的10倍溶液的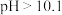 |
D.升高 溶液的温度, 溶液的温度,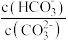 减小 减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐3】常温下,0.1 mol·L-1某一元酸(HA)溶液的pH=3.下列叙述正确的是( )
| A.该溶液中:2c (H+)= c(A-)+c(OH-) |
| B.由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| C.浓度均为0.1 mol·L-1的HA和NaA溶液等体积混合,所得溶液显酸性,则:c(A-)>c(HA)>c(Na+)>c(OH-)>c(H+) |
| D.0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)==c(A-)+2c(OH-) |
您最近一年使用:0次

 H++B2-。在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是
H++B2-。在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是

