焦锑酸钠 可用于制作电视机显像管玻壳、纺织品阻燃剂和搪瓷乳白剂。以某含锑净渣(主要成分是SbOCl,还含有少量Cu、As等元素)为原料制备焦锑酸钠的工艺流程如下图所示。
可用于制作电视机显像管玻壳、纺织品阻燃剂和搪瓷乳白剂。以某含锑净渣(主要成分是SbOCl,还含有少量Cu、As等元素)为原料制备焦锑酸钠的工艺流程如下图所示。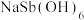 难溶于水。
难溶于水。
②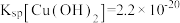 ,
, 。
。
回答下列问题:
(1)含锑净渣需进行粉碎研磨,其目的是_______ ,“浸渣”的主要成分是_______ (填“ ”或“CuS”)。
”或“CuS”)。
(2)“碱溶”时SbOCl转化为Na3SbS3,转化的化学方程式为_______ 。
(3)“氧化”时,溶液中的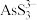 转化为易溶于水的Na3AsO4与锑分离,同时生成S,写出该反应的离子方程式
转化为易溶于水的Na3AsO4与锑分离,同时生成S,写出该反应的离子方程式_______ 。
(4)“滤液”的主要成分是_______ 。
(5)产品纯度测定:称取1.30gNaSb(OH)6样品,酸溶后加入适量硫酸肼固体配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.0500mol·L-1Ce(SO4)2标准液滴定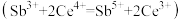 ,平均消耗标准液20.00mL。
,平均消耗标准液20.00mL。
①硫酸肼的作用是_______ 。
②产品的纯度为_______ [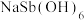 的摩尔质量为247g·mol-1]。
的摩尔质量为247g·mol-1]。
 可用于制作电视机显像管玻壳、纺织品阻燃剂和搪瓷乳白剂。以某含锑净渣(主要成分是SbOCl,还含有少量Cu、As等元素)为原料制备焦锑酸钠的工艺流程如下图所示。
可用于制作电视机显像管玻壳、纺织品阻燃剂和搪瓷乳白剂。以某含锑净渣(主要成分是SbOCl,还含有少量Cu、As等元素)为原料制备焦锑酸钠的工艺流程如下图所示。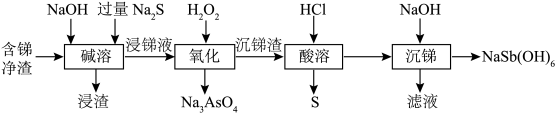
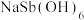 难溶于水。
难溶于水。②
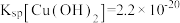 ,
, 。
。回答下列问题:
(1)含锑净渣需进行粉碎研磨,其目的是
 ”或“CuS”)。
”或“CuS”)。(2)“碱溶”时SbOCl转化为Na3SbS3,转化的化学方程式为
(3)“氧化”时,溶液中的
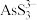 转化为易溶于水的Na3AsO4与锑分离,同时生成S,写出该反应的离子方程式
转化为易溶于水的Na3AsO4与锑分离,同时生成S,写出该反应的离子方程式(4)“滤液”的主要成分是
(5)产品纯度测定:称取1.30gNaSb(OH)6样品,酸溶后加入适量硫酸肼固体配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.0500mol·L-1Ce(SO4)2标准液滴定
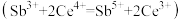 ,平均消耗标准液20.00mL。
,平均消耗标准液20.00mL。①硫酸肼的作用是
②产品的纯度为
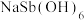 的摩尔质量为247g·mol-1]。
的摩尔质量为247g·mol-1]。
更新时间:2024-05-16 15:39:19
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】锡(Sn)是第IVA族元素,其常见的氯化物有SnCl4和SnCl2。SnCl4常温下为液体,遇水极易发生水解反应;SnCl2常温下为固体,具有还原性,可被空气中的氧气氧化。某化学实验小组制备SnCl4的装置如图(加热与夹持装置省略)。
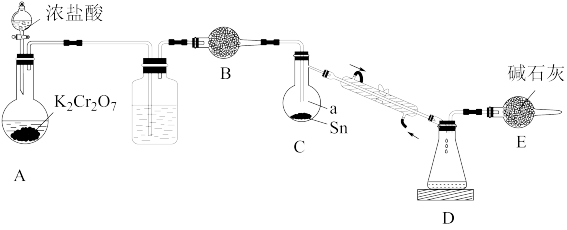
回答下列问题:
(1)仪器a的名称是_______ ;装置B中盛放的试剂是_______ 。
(2)制取SnCl4的操作步骤为:①连接好装置;②_______ ;③添加药品、滴加浓盐酸;④待装置D_______ 后,加热装置C;⑤收集SnCl4。请补充上述实验步骤。已知装置A中反应的还原产物为 ,写出该反应的离子方程式
,写出该反应的离子方程式_______ 。
(3)装置E的作用是_______ 。
(4)经测定发现实验所得SnCl4,样品中含有少量的SnCl2,测定样品纯度的方案如下:
取ag样品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用 碘酸钾标准溶液滴定至终点,消耗标准液
碘酸钾标准溶液滴定至终点,消耗标准液 。滴定过程中先后发生的反应为:
。滴定过程中先后发生的反应为:
i.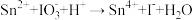
ii. (均未配平)
(均未配平)
则SnCl4样品的纯度为_______ %;若滴定时间过长,会使测量结果_______ (填“偏大”、“偏小”或“无影响”)。

回答下列问题:
(1)仪器a的名称是
(2)制取SnCl4的操作步骤为:①连接好装置;②
 ,写出该反应的离子方程式
,写出该反应的离子方程式(3)装置E的作用是
(4)经测定发现实验所得SnCl4,样品中含有少量的SnCl2,测定样品纯度的方案如下:
取ag样品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用
 碘酸钾标准溶液滴定至终点,消耗标准液
碘酸钾标准溶液滴定至终点,消耗标准液 。滴定过程中先后发生的反应为:
。滴定过程中先后发生的反应为:i.

ii.
 (均未配平)
(均未配平)则SnCl4样品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
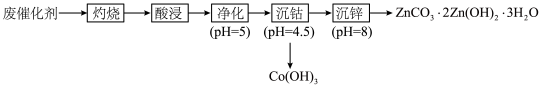
【推荐2】工业上,从有机催化剂(主要含钴和锌)回收金属的简易流程如下:
回答下列问题:
(1)“灼烧”的目的是___________________ 。“酸浸”时加入稀硫酸,浸出液含有Co2+、Zn2+、Mn2+、Fe3+、Fe2+等,检验Fe3+的试剂是____________________ (填化学式)。
(2)“净化”中加入KMnO4,生成Fe(OH)3和MnO2。配平下列方程式:________ +________Fe2++________H2O=________ MnO2+________ Fe(OH)3+________H+。
+________Fe2++________H2O=________ MnO2+________ Fe(OH)3+________H+。___________
(3)1mol (NH4)2S2O8中含1mol过氧键(—O—O—),“沉钴”中加入(NH4)2S2O8,还原产物为 。Co2+转化成1mol Co(OH)3,理论上消耗
。Co2+转化成1mol Co(OH)3,理论上消耗__________________ mol (NH4)2S2O8。
(4)“沉钴”中,依次用稀硫酸、水洗涤,“水洗”目的是_________ ,“沉钴”的pH不能太高,原因是_______ 。
(5)“沉锌”加入NH4HCO3,沉锌的温度不能太高,原因是_________ 。
(6)“沉钴”中,pH=4.5时c(Co3+)=1×10-15mol/L,Ksp[Co(OH)3]的数量级为____________ 。

回答下列问题:
(1)“灼烧”的目的是
(2)“净化”中加入KMnO4,生成Fe(OH)3和MnO2。配平下列方程式:________
 +________Fe2++________H2O=________ MnO2+________ Fe(OH)3+________H+。
+________Fe2++________H2O=________ MnO2+________ Fe(OH)3+________H+。(3)1mol (NH4)2S2O8中含1mol过氧键(—O—O—),“沉钴”中加入(NH4)2S2O8,还原产物为
 。Co2+转化成1mol Co(OH)3,理论上消耗
。Co2+转化成1mol Co(OH)3,理论上消耗(4)“沉钴”中,依次用稀硫酸、水洗涤,“水洗”目的是
(5)“沉锌”加入NH4HCO3,沉锌的温度不能太高,原因是
(6)“沉钴”中,pH=4.5时c(Co3+)=1×10-15mol/L,Ksp[Co(OH)3]的数量级为
您最近一年使用:0次
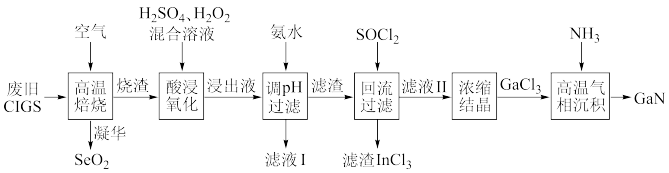
【推荐3】废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2。某探究小组回收处理流程如图:
回答下列问题:
(1)硒(Se)为第四周期与硫为同族元素,Se的原子序数为___________ ; 镓(Ga)和铟(In)位于元素周期表第IIIA族,CuIn0.5Ga0.5Se2中Cu的化合价为___________ 。
(2)“酸浸氧化”发生的主要氧化还原反应的离子方程式为___________ 。
(3)已知: 25℃, Kb(NH3·H2O)≈2.0×10-5, Ksp[Ga(OH)3]≈1.0×10-35, Ksp[In(OH)3]=1.0×10-33。当金属阳离子浓度小于1.0× 10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为___________ (保留一位小数);为探究Ga(OH)3在氨水中能否溶解,计算反应Ga(OH)3(s)+NH3·H2O [Ga(OH)4]-+NH
[Ga(OH)4]-+NH 的平衡常数K=
的平衡常数K=___________ 。(已知: Ga3++4OH- [Ga(OH)4]- K'=
[Ga(OH)4]- K'=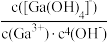 ≈1.0×1034)
≈1.0×1034)
(4)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中NH 是否洗净的试剂和用品是
是否洗净的试剂和用品是___________ ; “回流过滤”中加入的SOCl2是一种液态化合物,极易与水反应,写出SOCl2与水反应的化学反应方程式___________ ;SOCl2的作用是将氢氧化物转化为氯化物和___________ 。
(5)“高温气相沉积”过程中发生的化学反应方程式为___________ 。

回答下列问题:
(1)硒(Se)为第四周期与硫为同族元素,Se的原子序数为
(2)“酸浸氧化”发生的主要氧化还原反应的离子方程式为
(3)已知: 25℃, Kb(NH3·H2O)≈2.0×10-5, Ksp[Ga(OH)3]≈1.0×10-35, Ksp[In(OH)3]=1.0×10-33。当金属阳离子浓度小于1.0× 10-5mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为
 [Ga(OH)4]-+NH
[Ga(OH)4]-+NH 的平衡常数K=
的平衡常数K= [Ga(OH)4]- K'=
[Ga(OH)4]- K'=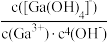 ≈1.0×1034)
≈1.0×1034)(4)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中NH
 是否洗净的试剂和用品是
是否洗净的试剂和用品是(5)“高温气相沉积”过程中发生的化学反应方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某活动小组利用废铁屑(含少量S等元素)为原料制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4 ·6H2O](M=392g/mol),设计如图所示装置(夹持仪器略去)。
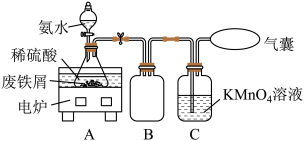
称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50 ~60°C热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)在实验中选择50~60℃热水浴的原因是___________________ 。
(2)装置B的作用是_______________________________ 。
(3)检验制得的(NH4)2SO4·FeSO4·6H2O中是否含有Fe3+的方法:将硫酸亚铁铵晶体用加热煮沸过的蒸馏水溶解,然后滴加________________ (填化学式)。
(4)产品中杂质Fe3+的定量分析:
①配制Fe3+浓度为0.1 mg/mL的标准溶液100mL。称取________ (精确到0.1)mg高纯度的硫酸铁铵[(NH4)Fe(SO4)2·12H2O],加入20.00 mL经处理的去离子水。振荡溶解后,加入2 mol·L-1HBr溶液1mL和1mol·L-1KSCN溶液0.5mL,加水配成100mL溶液。
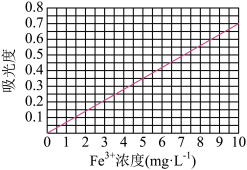
②将上述溶液稀释成浓度分别为0.2、1.0、 3.0、5.0、 7.0、 10.0(单位: mg·L-1)的溶液。分别测定不同浓度溶液对光的吸收程度(吸光度),并将测定结果绘制成如图所示曲线。取硫酸亚铁铵产品,按步骤①配得产品硫酸亚铁铵溶液10mL,稀释至100mL,然后测定稀释后溶液的吸光度,两次测得的吸光度分别为0.590、0.610,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为_______ mg·L-1。
(5)称取mg产品,将产品用加热煮沸的蒸馏水溶解,配成250mL溶液,取出100mL放入锥形瓶中,用c mol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为___________ (用含c、V、m的代数式表示,化简)。滴定时,下列滴定方式中,最合理的是___________ (填字母)。
A.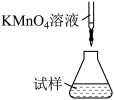 B.
B.  C.
C. 
若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果将会_________ (填“偏大”“偏小”或“无影响”。)

称取一定量的废铁屑于锥形瓶中,加入适量的稀硫酸,在通风橱中置于50 ~60°C热水浴中加热充分反应。待锥形瓶中溶液冷却至室温后加入氨水,使其反应完全,制得浅绿色悬浊液。
(1)在实验中选择50~60℃热水浴的原因是
(2)装置B的作用是
(3)检验制得的(NH4)2SO4·FeSO4·6H2O中是否含有Fe3+的方法:将硫酸亚铁铵晶体用加热煮沸过的蒸馏水溶解,然后滴加
(4)产品中杂质Fe3+的定量分析:
①配制Fe3+浓度为0.1 mg/mL的标准溶液100mL。称取
②将上述溶液稀释成浓度分别为0.2、1.0、 3.0、5.0、 7.0、 10.0(单位: mg·L-1)的溶液。分别测定不同浓度溶液对光的吸收程度(吸光度),并将测定结果绘制成如图所示曲线。取硫酸亚铁铵产品,按步骤①配得产品硫酸亚铁铵溶液10mL,稀释至100mL,然后测定稀释后溶液的吸光度,两次测得的吸光度分别为0.590、0.610,则该兴趣小组所配产品硫酸亚铁铵溶液中所含Fe3+浓度为

(5)称取mg产品,将产品用加热煮沸的蒸馏水溶解,配成250mL溶液,取出100mL放入锥形瓶中,用c mol·L-1KMnO4溶液滴定,消耗KMnO4溶液VmL,则硫酸亚铁铵晶体的纯度为
A.
 B.
B.  C.
C. 
若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,实验结果将会
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】三氯化铬( )在工业上主要用作媒染剂和催化剂,
)在工业上主要用作媒染剂和催化剂, 常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以
常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以 为原料制备
为原料制备 和
和 。
。
(1)制备 。取一定质量的
。取一定质量的 和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。
①上述反应的化学方程式为_______ 。
②上述反应中的乙醇与 投料的物质的量比例大约为3:8,原因是
投料的物质的量比例大约为3:8,原因是_______ 。
(2)测定 的质量分数。
的质量分数。
Ⅰ.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬完全以
;再加入过量KI固体加塞摇匀,使铬完全以 的形式存在。
的形式存在。
Ⅲ.加入1mL淀粉溶液,用0.0250 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。
已知反应:
 (未配平)
(未配平)
 (未配平)
(未配平)
①滴定终点的现象是_______ 。
②计算 的质量分数(写出计算过程)
的质量分数(写出计算过程)_______ 。
(3)制备 。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。

请补充完整由 溶液制备
溶液制备 的实验方案:取适量
的实验方案:取适量 溶液,
溶液,_______ ,低温烘干,得到 晶体(实验中须使用的试剂:1
晶体(实验中须使用的试剂:1 NaOH溶液、0.1
NaOH溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、蒸馏水)。
溶液、蒸馏水)。
 )在工业上主要用作媒染剂和催化剂,
)在工业上主要用作媒染剂和催化剂, 常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以
常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以 为原料制备
为原料制备 和
和 。
。(1)制备
 。取一定质量的
。取一定质量的 和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。①上述反应的化学方程式为
②上述反应中的乙醇与
 投料的物质的量比例大约为3:8,原因是
投料的物质的量比例大约为3:8,原因是(2)测定
 的质量分数。
的质量分数。Ⅰ.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的
 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬完全以
;再加入过量KI固体加塞摇匀,使铬完全以 的形式存在。
的形式存在。Ⅲ.加入1mL淀粉溶液,用0.0250
 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。已知反应:
 (未配平)
(未配平) (未配平)
(未配平)①滴定终点的现象是
②计算
 的质量分数(写出计算过程)
的质量分数(写出计算过程)(3)制备
 。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
请补充完整由
 溶液制备
溶液制备 的实验方案:取适量
的实验方案:取适量 溶液,
溶液, 晶体(实验中须使用的试剂:1
晶体(实验中须使用的试剂:1 NaOH溶液、0.1
NaOH溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、蒸馏水)。
溶液、蒸馏水)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某实验小组模拟工业制备碘酸钾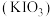 并测定
并测定 纯度的过程如下:
纯度的过程如下:
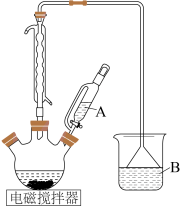
I.制备碘酸钾[实验装置如图(夹持装置已省略)]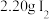 、
、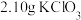 和
和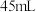 水,向仪器A中加入
水,向仪器A中加入 盐酸,充分反应直至反应结束。
盐酸,充分反应直至反应结束。
步骤2:将步骤1所得溶液转入 烧杯中,加30%的
烧杯中,加30%的 溶液调节pH至10,通过一系列操作后得到含
溶液调节pH至10,通过一系列操作后得到含 的产品。
的产品。
回答下列问题:
(1)仪器A的名称为___________ 。
(2)反应结束后,三颈烧瓶中的产物是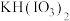 和
和 等,则步骤1反应的化学方程式为
等,则步骤1反应的化学方程式为___________ 。
(3)B装置的作用是___________ 。
(4)当观察到三颈烧瓶中溶液的___________ 色褪去时,可判断步骤1的反应结束。
Ⅱ.测定产品中的纯度
(5)测定方案:准确称取a g产品,配制成 溶液作为待测液,取
溶液作为待测液,取 该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化后,盖紧瓶塞,置于避光处
该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化后,盖紧瓶塞,置于避光处 ,当溶液呈淡黄色时,加入少许指示剂,用
,当溶液呈淡黄色时,加入少许指示剂,用 的硫代硫酸钠标准溶液滴定,滴定到溶液呈无色,即达到滴定终点。记录相关数据,可计算产品中
的硫代硫酸钠标准溶液滴定,滴定到溶液呈无色,即达到滴定终点。记录相关数据,可计算产品中 的纯度。已知:
的纯度。已知: 。
。
①滴定前,下列有关滴定管的操作顺序依次为___________ (填字母)。。
a.装入滴定液至零刻度线以上 b.用蒸馏水洗涤
c.调整滴定液液面至零刻度线或零刻度线以下 d.检查是否漏水
e.排除气泡 f.用滴定液润洗2~3次
g.记录起始读数,开始滴定
②测定方案中的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞的主要目的是___________ 。
③若平行滴定三次,达到滴定终点时消耗 标准溶液的平均体积为V mL,产品中碘酸钾的纯度为
标准溶液的平均体积为V mL,产品中碘酸钾的纯度为___________ (用含a、c、V的表达式表示)。
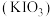 并测定
并测定 纯度的过程如下:
纯度的过程如下:I.制备碘酸钾[实验装置如图(夹持装置已省略)]
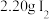 、
、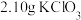 和
和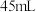 水,向仪器A中加入
水,向仪器A中加入 盐酸,充分反应直至反应结束。
盐酸,充分反应直至反应结束。步骤2:将步骤1所得溶液转入
 烧杯中,加30%的
烧杯中,加30%的 溶液调节pH至10,通过一系列操作后得到含
溶液调节pH至10,通过一系列操作后得到含 的产品。
的产品。回答下列问题:
(1)仪器A的名称为
(2)反应结束后,三颈烧瓶中的产物是
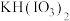 和
和 等,则步骤1反应的化学方程式为
等,则步骤1反应的化学方程式为(3)B装置的作用是
(4)当观察到三颈烧瓶中溶液的
Ⅱ.测定产品中的纯度
(5)测定方案:准确称取a g产品,配制成
 溶液作为待测液,取
溶液作为待测液,取 该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化后,盖紧瓶塞,置于避光处
该溶液于碘量瓶中,加入稍过量的碘化钾,用适量的盐酸酸化后,盖紧瓶塞,置于避光处 ,当溶液呈淡黄色时,加入少许指示剂,用
,当溶液呈淡黄色时,加入少许指示剂,用 的硫代硫酸钠标准溶液滴定,滴定到溶液呈无色,即达到滴定终点。记录相关数据,可计算产品中
的硫代硫酸钠标准溶液滴定,滴定到溶液呈无色,即达到滴定终点。记录相关数据,可计算产品中 的纯度。已知:
的纯度。已知: 。
。①滴定前,下列有关滴定管的操作顺序依次为
a.装入滴定液至零刻度线以上 b.用蒸馏水洗涤
c.调整滴定液液面至零刻度线或零刻度线以下 d.检查是否漏水
e.排除气泡 f.用滴定液润洗2~3次
g.记录起始读数,开始滴定
②测定方案中的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞的主要目的是
③若平行滴定三次,达到滴定终点时消耗
 标准溶液的平均体积为V mL,产品中碘酸钾的纯度为
标准溶液的平均体积为V mL,产品中碘酸钾的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
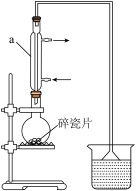
【推荐1】醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备1-溴丁烷的反应和实验装置如下:
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚, 被浓硫酸氧化为
被浓硫酸氧化为 等。由1-丁醇制备1-溴丁烷的流程和实验装置如下图:
等。由1-丁醇制备1-溴丁烷的流程和实验装置如下图:
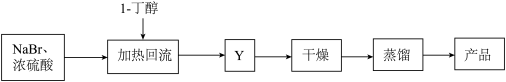
(1)仪器a的名称___________ ;圆底烧瓶中碎瓷片的作用是___________ 。
(2)写出氢溴酸与1-丁醇在加热时反应的化学方程式:___________ 。
(3)制备操作中,加入水的目的是对浓硫酸进行适当稀释,下列说法不属于其作用的是___________。
(4)实验得到的溴乙烷粗品中含有少量乙醇,可将粗品用蒸馏水洗涤,分液后向有机相加入无水 经干燥、
经干燥、___________ 操作后再蒸馏实现精制。
(5)若烧瓶内获得的有机物呈棕黄色,除去其中的杂质最佳的试剂是___________(填序号)。
(6)已知溴乙烷可以与钠发生反应: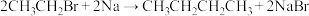 。应用该反应原理,只用一个分子
。应用该反应原理,只用一个分子___________ (填名称)可以与钠反应合成环丁烷。
(7)某实验小组制取1-溴丁烷时,向圆底烧瓶中加入14.8g 1-丁醇,23.0gNaBr和足量的浓硫酸,最终制得1-溴丁烷16.5g,则1-溴丁烷的产率是___________ 。(保留2位有效数字)。

可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,
 被浓硫酸氧化为
被浓硫酸氧化为 等。由1-丁醇制备1-溴丁烷的流程和实验装置如下图:
等。由1-丁醇制备1-溴丁烷的流程和实验装置如下图:
(1)仪器a的名称
(2)写出氢溴酸与1-丁醇在加热时反应的化学方程式:
(3)制备操作中,加入水的目的是对浓硫酸进行适当稀释,下列说法不属于其作用的是___________。
| A.减少副产物烯和醚的生成 | B.水是反应的催化剂 |
| C.减少HBr的挥发 | D.减少 的生成 的生成 |
 经干燥、
经干燥、(5)若烧瓶内获得的有机物呈棕黄色,除去其中的杂质最佳的试剂是___________(填序号)。
A. | B.NaOH溶液 | C. 溶液 溶液 | D.稀硫酸 |
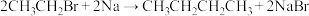 。应用该反应原理,只用一个分子
。应用该反应原理,只用一个分子(7)某实验小组制取1-溴丁烷时,向圆底烧瓶中加入14.8g 1-丁醇,23.0gNaBr和足量的浓硫酸,最终制得1-溴丁烷16.5g,则1-溴丁烷的产率是
您最近一年使用:0次
【推荐2】硫酸锰晶体(MnSO4·H2O)是一种重要的化工原料,利用软锰矿(主要成分为MnO2)和黄铜矿(主要成分为CuFeS2)可以制取(MnSO4·H2O),其化工生产流程如下:
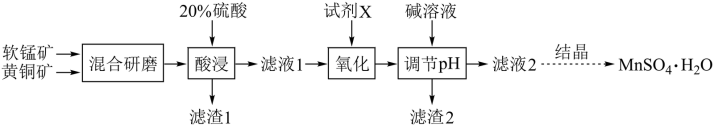
已知:Ksp[Mn(OH)2]=4.0×10-14、Ksp[Cu(OH)2]=2.0×10-20、Ksp[Fe(OH)3]=2.6×10-39、Ksp[Fe(OH)2]=1×10-16.3;
(1)将矿石混合研磨成细粉的目的是_______ ,“酸浸”过程中得到滤渣1为单质硫,滤液中含有Cu2+、Mn2+、Fe3+,写出“酸浸”发生反应的离子方程式:_______ 。
(2)氧化的目的是将酸性滤液中可能含有的Fe2+转化为Fe3+,则试剂X可能为_______ (填化学式)。检验滤液1中Fe3+常用的试剂为_______ 。
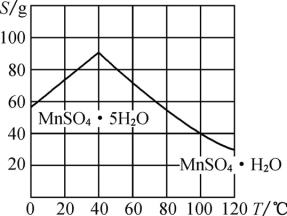
(3)滤渣2的成分为_______ (填化学式),为了得到较为纯净的MnSO4·H2O,使用碱液调节pH的范围为_______ 。(lg2=0.3)(已知:①滤液2中Mn2+的浓度为0.02mol/L;②当离子浓度小于10-6mol/L时,即可认为该离子已除净)
(4)若工艺流程改为先“调节pH”后“氧化”,则“滤液2”中可能含有的杂质离子为_______ 。
(5)结合图象,由滤液2获得(MnSO4·H2O)晶体的具体实验步骤是加1.0mol/L稀硫酸酸化,高于40℃蒸发结晶、_______ ,酒精洗涤,低温干燥 。

已知:Ksp[Mn(OH)2]=4.0×10-14、Ksp[Cu(OH)2]=2.0×10-20、Ksp[Fe(OH)3]=2.6×10-39、Ksp[Fe(OH)2]=1×10-16.3;
(1)将矿石混合研磨成细粉的目的是
(2)氧化的目的是将酸性滤液中可能含有的Fe2+转化为Fe3+,则试剂X可能为
(3)滤渣2的成分为
(4)若工艺流程改为先“调节pH”后“氧化”,则“滤液2”中可能含有的杂质离子为
(5)结合图象,由滤液2获得(MnSO4·H2O)晶体的具体实验步骤是加1.0mol/L稀硫酸酸化,高于40℃蒸发结晶、

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
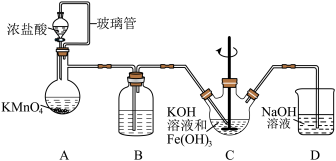
【推荐3】高铁酸钾(K2FeO4)是一种高效的水处理剂,实验室制备K2FeO4的装置如图所示。(夹持装置略去)
查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是___________ ,玻璃管的作用是___________ 。
(2)装置B中盛放的试剂是___________ 。
(3)装置C中KOH溶液过量的目的是___________ 。搅拌操作,除了防止因局部溶液碱性减弱,使K2FeO4与水反应产生Fe(OH)3和O2,另外的作用是___________ 。
(4)装置C中生成K2FeO4的离子方程式为___________ 。该反应放热,不利于K2FeO4固体析出,写出一条实验改进措施___________ 。
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用___________ 除水。(填标号)
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是___________ 。

查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是
(2)装置B中盛放的试剂是
(3)装置C中KOH溶液过量的目的是
(4)装置C中生成K2FeO4的离子方程式为
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
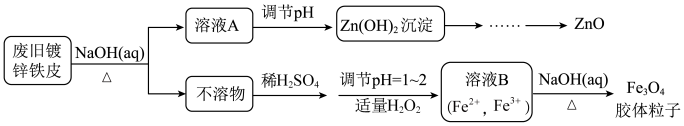
【推荐1】利用废旧镀锌铁皮可制备磁性 胶体粒子及副产物ZnO。制备流程图如下:
胶体粒子及副产物ZnO。制备流程图如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有_______。
(2)调节溶液A的pH可产生 沉淀,为制得ZnO,后续操作步骤是
沉淀,为制得ZnO,后续操作步骤是_______ 。
(3)由溶液B制得 胶体粒子的过程中,须持续通入
胶体粒子的过程中,须持续通入 ,原因是
,原因是_______ 。
(4) 胶体粒子
胶体粒子_______ 用(填“能”或“不能”)过滤法实现固液分离。
(5)用重铬酸钾法可测定产物 中的二价铁含量。方法是先将产物溶于酸后,用重铬酸钾法测定,重铬酸钾法测定原理用离子反应方程式可表示为
中的二价铁含量。方法是先将产物溶于酸后,用重铬酸钾法测定,重铬酸钾法测定原理用离子反应方程式可表示为_______ ;需配制浓度为 的
的 标准溶液250mL,配制该标准溶液时,下列仪器中不必要用到的有
标准溶液250mL,配制该标准溶液时,下列仪器中不必要用到的有_______ 。(用编号表示)。
①电子天平 ②烧杯 ③酸式滴定管 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有 标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将
标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将_______ (填“偏大”、“偏小”或“不变”)。
 胶体粒子及副产物ZnO。制备流程图如下:
胶体粒子及副产物ZnO。制备流程图如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有_______。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
 沉淀,为制得ZnO,后续操作步骤是
沉淀,为制得ZnO,后续操作步骤是(3)由溶液B制得
 胶体粒子的过程中,须持续通入
胶体粒子的过程中,须持续通入 ,原因是
,原因是(4)
 胶体粒子
胶体粒子(5)用重铬酸钾法可测定产物
 中的二价铁含量。方法是先将产物溶于酸后,用重铬酸钾法测定,重铬酸钾法测定原理用离子反应方程式可表示为
中的二价铁含量。方法是先将产物溶于酸后,用重铬酸钾法测定,重铬酸钾法测定原理用离子反应方程式可表示为 的
的 标准溶液250mL,配制该标准溶液时,下列仪器中不必要用到的有
标准溶液250mL,配制该标准溶液时,下列仪器中不必要用到的有①电子天平 ②烧杯 ③酸式滴定管 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有
 标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将
标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:
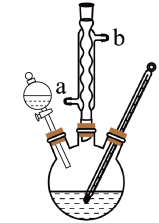
(1)水从冷凝管的______ (填“a”或“b”)处进入。
(2)已知下列数据:
又知温度高于140℃时发生副反应:2CH3CH2OH→CH3CH2OCH2CH3+H2O
①该副反应属于________ 反应(填字母)。
a.加成 b.取代 c.酯化
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是______ (填字母)。
a.T<77.5℃ b.T>150℃ c.115℃<T<130℃
(3)欲分离出乙酸乙酯,应使用的分离方法是________ (填操作方法名称,下同),所用到的仪器为______ , 进行此步操作后,所得有机层中的主要无机物杂质是水,在不允许使用干燥剂的条件下,除去水可用________ 的方法。
(4)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是_______ 。
(5)乙二酸和乙二醇也能发生酯化反应,写出生成环酯的化学反应方程式________ 。

(1)水从冷凝管的
(2)已知下列数据:
乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
熔点/℃ | ﹣117.3 | 16.6 | ﹣83.6 | ﹣ |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
①该副反应属于
a.加成 b.取代 c.酯化
②考虑到反应速率等多种因素,用上述装置制备乙酸乙酯时,反应的最佳温度范围是
a.T<77.5℃ b.T>150℃ c.115℃<T<130℃
(3)欲分离出乙酸乙酯,应使用的分离方法是
(4)若实验所用乙酸质量为6.0g,乙醇质量为5.0g,得到纯净的产品质量为4.4g,则乙酸乙酯的产率是
(5)乙二酸和乙二醇也能发生酯化反应,写出生成环酯的化学反应方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫的化合物有重要用途。硫代硫酸钠(Na2S2O3) 可用于氰化物中毒的解毒、治疗荨麻疹等皮肤病,它在中性、碱性环境中稳定,在酸性较强的溶液中产生S和SO2。实验室可以利用如图装置制备Na2S2O3和焦亚硫酸钠(Na2S2O5 )。

(1)仪器a的名称为_______ ,a中试剂最好选择_______ (填标号)。
A.浓盐酸 B.70%硫酸 C.稀硫酸
(2) B的作用是_______ ,该装置中存在一处明显的缺陷,改进措施是_______ 。
(3)排尽装置内空气后,关闭K2、K4,打开K1、K3和仪器a的活塞,段时间后,C中有焦亚硫酸钠晶体析出,从C中分离出该晶体的操作是_______ 、_______ 、干燥。取少量焦亚硫酸钠晶体于试管中,加足量双氧水,再加BaCl2溶液,有白色沉淀生成,经检验该沉淀为BaSO4,说明焦亚硫酸钠具有_______ 性。
(4)关闭K1、K3打开K2、K4,一段时间后,D中有Na2S2O3生成。写出SO2与Na2S和Na2CO3发生反应的化学方程式_______ 。通入D中的SO2不宜过量的原因是_______ 。

(1)仪器a的名称为
A.浓盐酸 B.70%硫酸 C.稀硫酸
(2) B的作用是
(3)排尽装置内空气后,关闭K2、K4,打开K1、K3和仪器a的活塞,段时间后,C中有焦亚硫酸钠晶体析出,从C中分离出该晶体的操作是
(4)关闭K1、K3打开K2、K4,一段时间后,D中有Na2S2O3生成。写出SO2与Na2S和Na2CO3发生反应的化学方程式
您最近一年使用:0次



