氟化工被称为“黄金产业”,在国民经济和社会发展中占有重要地位。我国某公司利用萤石(主要成分为 ,及少量
,及少量 、
、 等)制备无水氟化铝的主要工艺流程如下所示。
等)制备无水氟化铝的主要工艺流程如下所示。 的熔点
的熔点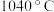 ,沸点
,沸点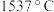 ;
;
③常温下, 。
。
请回答下列问题:
(1)在进入回转窑前,需要将萤石粉碎,其目的是_______ 。
(2)“回转窑反应”的温度控制在 之间,写出在回转窑获得
之间,写出在回转窑获得 的化学方程式:
的化学方程式:_______ 。
(3)在回转窑中的炉渣里还含有 ,将该物质在
,将该物质在 热分解,可获得两种气体(其中一种为
热分解,可获得两种气体(其中一种为 ),用多元醇选择性吸收产生的
),用多元醇选择性吸收产生的 气体,经过一系列工艺得到高纯
气体,经过一系列工艺得到高纯 。则多元醇能从两种气体中选择性吸收
。则多元醇能从两种气体中选择性吸收 的原理是
的原理是_______ 。
(4)经冷凝、精馏、脱气后的 与
与 在流化床、多级气流床中,在
在流化床、多级气流床中,在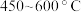 条件下进行一系列反应,由
条件下进行一系列反应,由 和
和 制备无水
制备无水 的反应的
的反应的 _______(填标号)。
_______(填标号)。
(5)常温下,向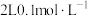 的
的 溶液中加入
溶液中加入 固体充分反应后可得
固体充分反应后可得 ,测得溶液中
,测得溶液中 的浓度为
的浓度为 ,则加入的
,则加入的 固体的物质的量为
固体的物质的量为_______ 。
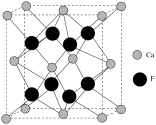
(6)已知萤石 立方晶胞参数
立方晶胞参数 ,结构如图所示,该
,结构如图所示,该 的晶体密度为
的晶体密度为_______  (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
 ,及少量
,及少量 、
、 等)制备无水氟化铝的主要工艺流程如下所示。
等)制备无水氟化铝的主要工艺流程如下所示。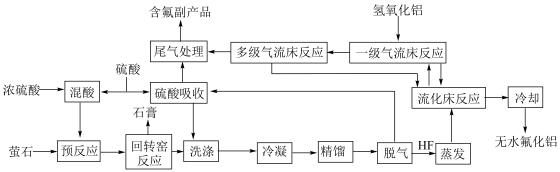
 的熔点
的熔点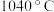 ,沸点
,沸点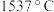 ;
;③常温下,
 。
。请回答下列问题:
(1)在进入回转窑前,需要将萤石粉碎,其目的是
(2)“回转窑反应”的温度控制在
 之间,写出在回转窑获得
之间,写出在回转窑获得 的化学方程式:
的化学方程式:(3)在回转窑中的炉渣里还含有
 ,将该物质在
,将该物质在 热分解,可获得两种气体(其中一种为
热分解,可获得两种气体(其中一种为 ),用多元醇选择性吸收产生的
),用多元醇选择性吸收产生的 气体,经过一系列工艺得到高纯
气体,经过一系列工艺得到高纯 。则多元醇能从两种气体中选择性吸收
。则多元醇能从两种气体中选择性吸收 的原理是
的原理是(4)经冷凝、精馏、脱气后的
 与
与 在流化床、多级气流床中,在
在流化床、多级气流床中,在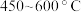 条件下进行一系列反应,由
条件下进行一系列反应,由 和
和 制备无水
制备无水 的反应的
的反应的 _______(填标号)。
_______(填标号)。| A.大于0 | B.小于0 | C.等于0 | D.无法确定 |
(5)常温下,向
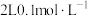 的
的 溶液中加入
溶液中加入 固体充分反应后可得
固体充分反应后可得 ,测得溶液中
,测得溶液中 的浓度为
的浓度为 ,则加入的
,则加入的 固体的物质的量为
固体的物质的量为(6)已知萤石
 立方晶胞参数
立方晶胞参数 ,结构如图所示,该
,结构如图所示,该 的晶体密度为
的晶体密度为 (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
更新时间:2024-06-02 12:41:40
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,平均反应速率v(CO2)=__________ mol/(L·min)。
②该反应的平衡常数表达式为________________________________ 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________ 。
A 升高温度 B 充入He(g),使体系压强增大
C 将H2O(g)从体系中分离 D 再充入1mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2 ,CO可用作燃料。已知该反应的阳极反应为:4OH―-4e-=O2↑+2H2O则阴极反应式为:________________ 。有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:________ ,__________ 。
 CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,平均反应速率v(CO2)=
②该反应的平衡常数表达式为
③下列措施中能使n(CH3OH)/n(CO2)增大的是
A 升高温度 B 充入He(g),使体系压强增大
C 将H2O(g)从体系中分离 D 再充入1mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2 ,CO可用作燃料。已知该反应的阳极反应为:4OH―-4e-=O2↑+2H2O则阴极反应式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】按要求回答下列问题。
(1)化学反应 的能量变化如图所示,该反应生成
的能量变化如图所示,该反应生成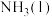 的热化学方程式是
的热化学方程式是___________ 。

(2)在1800K时,

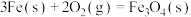
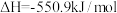
则反应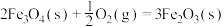 的
的
___________  ,该反应
,该反应___________ (填“能”或“不能”)自发进行。
(3)已知25℃、101kPa下,稀的强酸与稀的强碱溶液反应的中和热为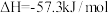 。
。
①写出稀硫酸与稀烧碱溶液反应表示中和热的热化学方程式___________ 。
②用如图所示装置测定中和热,碎泡沫塑料的主要作用是___________ 。

③下列关于中和热的说法正确的是___________ (填字母)。
A.用稀盐酸和 代替稀盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同
代替稀盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同
B.测定中和热时,为保证酸碱充分反应,应将碱溶液缓慢分次倒入酸溶液中,并充分搅拌
C.测定中和热时,温度计测量盐酸的温度后,用蒸馏水洗净再测NaOH溶液的温度,实验准确度更高
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
(1)化学反应
 的能量变化如图所示,该反应生成
的能量变化如图所示,该反应生成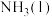 的热化学方程式是
的热化学方程式是
(2)在1800K时,


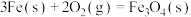
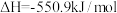
则反应
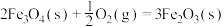 的
的
 ,该反应
,该反应(3)已知25℃、101kPa下,稀的强酸与稀的强碱溶液反应的中和热为
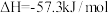 。
。①写出稀硫酸与稀烧碱溶液反应表示中和热的热化学方程式
②用如图所示装置测定中和热,碎泡沫塑料的主要作用是

③下列关于中和热的说法正确的是
A.用稀盐酸和
 代替稀盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同
代替稀盐酸与NaOH溶液进行中和热测定,如果准确操作,所测中和热数值可以相同B.测定中和热时,为保证酸碱充分反应,应将碱溶液缓慢分次倒入酸溶液中,并充分搅拌
C.测定中和热时,温度计测量盐酸的温度后,用蒸馏水洗净再测NaOH溶液的温度,实验准确度更高
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】碳及其化合物在生产、生活中广泛存在。请回答下列问题:
I.已知甲烷隔绝空气在不同温度下有可能发生如下两个裂解反应:
①CH4(g)→C(s)+2H2(g) ΔH(298K)=+74.8kJ/mol,ΔS(298K)=+80.7J/(mol·K)
②2CH4(g) →C2H2(g)+3H2(g) ΔH(298K)=+376.4kJ/mol,ΔS(298K)=+220.2J/(mol·K)
某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到如下热力学数据:
(1)反应①属于___________ (填“高温”或“低温”)自发反应。反应①自发进行是由___________ (填“焓变”或“熵变”)决定的。
(2)计算反应②能自发进行的温度范围(写出计算过程)___________ 。
(3)已知:①C(s)+CO2(g) 2CO(g) ΔH1=akJ/mol 平衡常数K1
2CO(g) ΔH1=akJ/mol 平衡常数K1
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2=bkJ/mol 平衡常数K2
H2(g)+CO2(g) ΔH2=bkJ/mol 平衡常数K2
③C(s)+H2O(g) H2(g)+CO(g) ΔH3 平衡常数K3
H2(g)+CO(g) ΔH3 平衡常数K3
则K1、K2、K3之间的关系是K3=___________ 。
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气2L密闭容器中,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g)。该反应平衡常数随温度的变化如表所示:该反应的正反应方向是
H2(g)+CO2(g)。该反应平衡常数随温度的变化如表所示:该反应的正反应方向是___________ 反应(填“吸热”或“放热”)。
(5)若在500℃时进行,设起始时CO和H2O起始浓度均为0.02mol/L,在该条件下,CO的平衡转化率为___________ 。
(6)保持温度500℃不变,某一体积为1L的密闭容器中加入该反应中四种物质各2mol,则此时反应___________ 移动(填“正向”、“逆向”或“不”),理由是:___________ 。
I.已知甲烷隔绝空气在不同温度下有可能发生如下两个裂解反应:
①CH4(g)→C(s)+2H2(g) ΔH(298K)=+74.8kJ/mol,ΔS(298K)=+80.7J/(mol·K)
②2CH4(g) →C2H2(g)+3H2(g) ΔH(298K)=+376.4kJ/mol,ΔS(298K)=+220.2J/(mol·K)
某同学为了得到用天然气制取炭黑的允许温度范围和最佳温度,在图书馆查到如下热力学数据:
(1)反应①属于
(2)计算反应②能自发进行的温度范围(写出计算过程)
(3)已知:①C(s)+CO2(g)
 2CO(g) ΔH1=akJ/mol 平衡常数K1
2CO(g) ΔH1=akJ/mol 平衡常数K1②CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2=bkJ/mol 平衡常数K2
H2(g)+CO2(g) ΔH2=bkJ/mol 平衡常数K2③C(s)+H2O(g)
 H2(g)+CO(g) ΔH3 平衡常数K3
H2(g)+CO(g) ΔH3 平衡常数K3则K1、K2、K3之间的关系是K3=
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气2L密闭容器中,发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g)。该反应平衡常数随温度的变化如表所示:该反应的正反应方向是
H2(g)+CO2(g)。该反应平衡常数随温度的变化如表所示:该反应的正反应方向是| 温度/℃ | 400 | 500 | 800 |
| 平衡常数/K | 9.94 | 9 | 1 |
(6)保持温度500℃不变,某一体积为1L的密闭容器中加入该反应中四种物质各2mol,则此时反应
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】已知NH4VO3在pH=7~8时溶解度最小。某工厂利用钒铬渣提取液(主要成分为NaVO3和Na2CrO4)制备Na2CrO4和NH4VO3晶体,流程如下:

不同温度下相关物质的溶解度
(1)关于“钒铬分离”过程,下列说法正确的是___________。
(2)从滤液A中获取 晶体时,应采用的结晶方法为
晶体时,应采用的结晶方法为___________ ;残留的含铬废水不能直接排放,处理时需要经过“酸化→还原→沉降”三个步骤,用 溶液还原时,还原产物为
溶液还原时,还原产物为 ,则反应的离子方程式
,则反应的离子方程式___________ ;为了使 不高于
不高于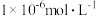 ,“沉降”时应调节pH
,“沉降”时应调节pH___________ [该温度下 的Ksp近似为
的Ksp近似为 ]。
]。
(3)“浸出”过程中生成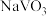 的离子方程式为
的离子方程式为___________ 。
(4)“转化”过程中选用 溶液不选用
溶液不选用 溶液的可能原因为
溶液的可能原因为___________ 。
(5)该流程中可循环利用的物质有___________ 。
(6)某工厂用1m3钒铬渣提取液[ ]最终制得
]最终制得 质量为70.2kg,则产率为
质量为70.2kg,则产率为___________ 。

不同温度下相关物质的溶解度
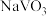 |  | 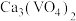 | 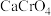 | |
| 20℃ | 19.3 | 84.0 | 0.1 | 5.5 |
| 40℃ | 22.5 | 96.5 | 0.09 | 2.49 |
| 60℃ | 26.3 | 102 | 0.09 | 1.3 |
(1)关于“钒铬分离”过程,下列说法正确的是___________。
A.研磨可防止生成的沉淀覆在 表面,提高 表面,提高 利用率 利用率 |
| B.研磨减小了所得钒渣的粒径,提高了后续步骤中钒渣的浸出率 |
| C.相对于20℃、40℃,工业上更宜选用60℃ |
| D.该过程发生了氧化还原反应 |
 晶体时,应采用的结晶方法为
晶体时,应采用的结晶方法为 溶液还原时,还原产物为
溶液还原时,还原产物为 ,则反应的离子方程式
,则反应的离子方程式 不高于
不高于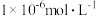 ,“沉降”时应调节pH
,“沉降”时应调节pH 的Ksp近似为
的Ksp近似为 ]。
]。(3)“浸出”过程中生成
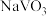 的离子方程式为
的离子方程式为(4)“转化”过程中选用
 溶液不选用
溶液不选用 溶液的可能原因为
溶液的可能原因为(5)该流程中可循环利用的物质有
(6)某工厂用1m3钒铬渣提取液[
 ]最终制得
]最终制得 质量为70.2kg,则产率为
质量为70.2kg,则产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某废合金的主要成分为Sn、Cu、Pb、Fe,一种综合回收的工艺流程如图所示:

已知:常温下,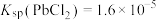 ,
, ,
, 。
。
回答下列问题:
(1)“氯化浸出”浸出液中金属阳离子主要有 、
、 、
、_______ ;浸渣的主要成分为_______ (填化学式)。“氯化没出”时温度不宜过高或过低的原因是_______ 。
(2)写出“还原”中Fe与 反应的化学方程式:
反应的化学方程式:_______ 。
(3)常温下,为使 完全沉淀,“调pH”时应使溶液pH不低于
完全沉淀,“调pH”时应使溶液pH不低于_______ (结果保留1位小数)。
(4)“氧化”时为检验 是否已被充分氧化,可取样滴加
是否已被充分氧化,可取样滴加_______ (填化学式)溶液。
(5)写出“沉铁”时发生反应的离子反应方程式:_______ 。
(6) 受热后可制得物质A,写出物质A的一种用途:
受热后可制得物质A,写出物质A的一种用途:_______ 。

已知:常温下,
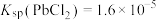 ,
, ,
, 。
。回答下列问题:
(1)“氯化浸出”浸出液中金属阳离子主要有
 、
、 、
、(2)写出“还原”中Fe与
 反应的化学方程式:
反应的化学方程式:(3)常温下,为使
 完全沉淀,“调pH”时应使溶液pH不低于
完全沉淀,“调pH”时应使溶液pH不低于(4)“氧化”时为检验
 是否已被充分氧化,可取样滴加
是否已被充分氧化,可取样滴加(5)写出“沉铁”时发生反应的离子反应方程式:
(6)
 受热后可制得物质A,写出物质A的一种用途:
受热后可制得物质A,写出物质A的一种用途:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
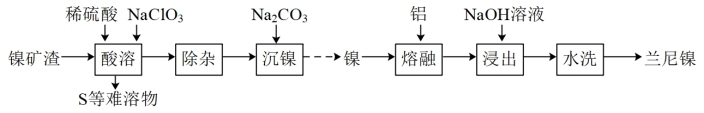
【推荐3】兰尼镍(Raney-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,常用作烯烃、炔烃等氢化反应催化剂,其高催化活性源自于镍本身的催化性质和其多孔结构对氢气的强吸附性。由镍矿渣[主要含 、
、 ,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
已知: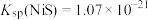 ,
,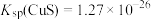
(1)“酸溶”过程中, 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)“除杂”过程中加入 除去
除去 发生的反应是:
发生的反应是: ,该反应的平衡常数
,该反应的平衡常数
_______ 。
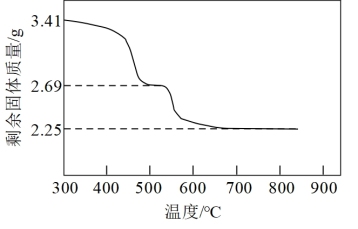
(3)“沉镍”所得沉淀有多种组成,可表示为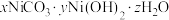 。为测定其组成,进行下列实验:称取干燥沉淀样品
。为测定其组成,进行下列实验:称取干燥沉淀样品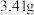 ,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(
,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(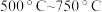 条件下加热,收集到的气体产物只有一种,
条件下加热,收集到的气体产物只有一种,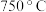 以上残留固体为
以上残留固体为 )。通过计算确定该样品的化学式。(写出计算过程)
)。通过计算确定该样品的化学式。(写出计算过程)_______
(4)“浸出”是制备兰尼镍的关键步骤, 溶液在“浸出”过程中的作用是
溶液在“浸出”过程中的作用是_______ 。
(5)使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是_______ 。
 、
、 ,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
已知:
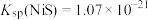 ,
,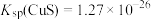
(1)“酸溶”过程中,
 发生反应的离子方程式为
发生反应的离子方程式为(2)“除杂”过程中加入
 除去
除去 发生的反应是:
发生的反应是: ,该反应的平衡常数
,该反应的平衡常数
(3)“沉镍”所得沉淀有多种组成,可表示为
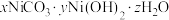 。为测定其组成,进行下列实验:称取干燥沉淀样品
。为测定其组成,进行下列实验:称取干燥沉淀样品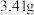 ,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(
,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(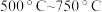 条件下加热,收集到的气体产物只有一种,
条件下加热,收集到的气体产物只有一种,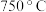 以上残留固体为
以上残留固体为 )。通过计算确定该样品的化学式。(写出计算过程)
)。通过计算确定该样品的化学式。(写出计算过程)
(4)“浸出”是制备兰尼镍的关键步骤,
 溶液在“浸出”过程中的作用是
溶液在“浸出”过程中的作用是(5)使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】VA族元素氮、磷、砷(As)、锑(Sb)、铋(Bi)的单质及其化合物在科研和生产中有许多重要用途。
(1)铋合金可用于自动喷水器的安全塞,铋的价电子排布式为_______ 。
(2)第三周期元素中第一电离能大于磷的元素有_______ (填元素符号)。
(3)Pt(NH3)2C12具有如图所示的两种平面四边形结构(一种有抗癌作用),其中在水中的溶解度较小是_______ (填“顺式”或“反式”)。

(4)偏亚砷酸钠(NaAsO2)是一种灭生性除草剂,其阴离子的立体构型为_______ 。
(5)化肥厂生产的(NH4)2SO4中往往含有少量极易被植物根系吸收的具有正四面体结构的N4H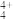 ,其结构式为
,其结构式为_______ ,其中N原子的杂化方式为_______ 。
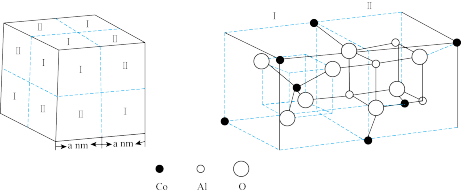
(6)钴蓝晶体结构如下图,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,其化学式为_______ ,晶体中Al3+占据O2-形成的_______ (填“四面体空隙”或“八面体空隙”)。
(1)铋合金可用于自动喷水器的安全塞,铋的价电子排布式为
(2)第三周期元素中第一电离能大于磷的元素有
(3)Pt(NH3)2C12具有如图所示的两种平面四边形结构(一种有抗癌作用),其中在水中的溶解度较小是

(4)偏亚砷酸钠(NaAsO2)是一种灭生性除草剂,其阴离子的立体构型为
(5)化肥厂生产的(NH4)2SO4中往往含有少量极易被植物根系吸收的具有正四面体结构的N4H
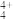 ,其结构式为
,其结构式为(6)钴蓝晶体结构如下图,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,其化学式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】卤素是典型的非金属元素。
(1)它们在自然界中都以___________ 态存在(填“游离”或“化合”)。
氯气在常温常压下溶于水的过程及其平衡常数如下:
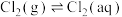
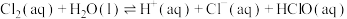
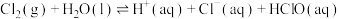

(2)
___________ (用含 和
和 的代数式表示)。若平衡时
的代数式表示)。若平衡时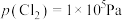 、
、 估算饱和氯水的
估算饱和氯水的
___________ (忽略次氯酸和水的电离, ,结果保留两位有效数字);
,结果保留两位有效数字);
(3)已知某氯气—氯水体系中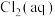 、HClO、
、HClO、 的物质的量分数(
的物质的量分数( )随pH变化如图所示。
)随pH变化如图所示。
___________ ;
(4)下表是 在蒸馏水和NaCl溶液中的溶解度数据:
在蒸馏水和NaCl溶液中的溶解度数据:
请从物质结构的角度分析氯气在NaCl溶液中溶解度减小的原因___________ ;
(5)某实验小组研究 在盐酸中的溶解性。利用数字化实验仪器,得出下列随温度和盐酸浓度变化氯气的溶解度图:
在盐酸中的溶解性。利用数字化实验仪器,得出下列随温度和盐酸浓度变化氯气的溶解度图: 浓度较大时发生反应
浓度较大时发生反应
 ,
, 热稳定性差。
热稳定性差。
① 中心氯原子3d轨道
中心氯原子3d轨道___________ 杂化(填“参与”或“不参与”);
②推测盐酸浓度较大时,随着盐酸浓度的增大, 溶解度增大的原因是
溶解度增大的原因是___________ ;
③温度升高(不考虑HCl的挥发)后盐酸浓度变化对氯气的溶解度影响变小的原因是___________ 。
(1)它们在自然界中都以
氯气在常温常压下溶于水的过程及其平衡常数如下:
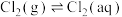
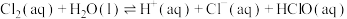
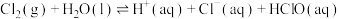

(2)

 和
和 的代数式表示)。若平衡时
的代数式表示)。若平衡时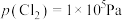 、
、 估算饱和氯水的
估算饱和氯水的
 ,结果保留两位有效数字);
,结果保留两位有效数字);(3)已知某氯气—氯水体系中
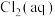 、HClO、
、HClO、 的物质的量分数(
的物质的量分数( )随pH变化如图所示。
)随pH变化如图所示。

(4)下表是
 在蒸馏水和NaCl溶液中的溶解度数据:
在蒸馏水和NaCl溶液中的溶解度数据: | 0 | 1.32 |
 | 0.095 | 0.059 |
(5)某实验小组研究
 在盐酸中的溶解性。利用数字化实验仪器,得出下列随温度和盐酸浓度变化氯气的溶解度图:
在盐酸中的溶解性。利用数字化实验仪器,得出下列随温度和盐酸浓度变化氯气的溶解度图:
 浓度较大时发生反应
浓度较大时发生反应
 ,
, 热稳定性差。
热稳定性差。①
 中心氯原子3d轨道
中心氯原子3d轨道②推测盐酸浓度较大时,随着盐酸浓度的增大,
 溶解度增大的原因是
溶解度增大的原因是③温度升高(不考虑HCl的挥发)后盐酸浓度变化对氯气的溶解度影响变小的原因是
您最近一年使用:0次
【推荐3】氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
(1)写出铬原子的基态电子排布式__ ,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有__ (填元素符号)。
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是_ (填“极性”或“非极性”分子)。
(3)在①乙烯、② 、③BF3、④H2O、⑤CCl4、⑥SO3六种有机溶剂中,中心原子采取sp2杂化的分子有
、③BF3、④H2O、⑤CCl4、⑥SO3六种有机溶剂中,中心原子采取sp2杂化的分子有__ (填序号),写一种 互为等电子体的阴离子
互为等电子体的阴离子__ 。
(1)写出铬原子的基态电子排布式
(2)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是
(3)在①乙烯、②
 、③BF3、④H2O、⑤CCl4、⑥SO3六种有机溶剂中,中心原子采取sp2杂化的分子有
、③BF3、④H2O、⑤CCl4、⑥SO3六种有机溶剂中,中心原子采取sp2杂化的分子有 互为等电子体的阴离子
互为等电子体的阴离子
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大2010级少年班的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。

(1)图乙中1号C与相邻C有无形成π键?_______ (填“有”或“无”)。
(2)图甲中1号C与相邻C形成的键之间的夹角_______ (填“>”“<”或“=”)120°。
(3)我国制墨工艺将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者沸点更高,其原因是_______ 。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为_______ ,该材料的化学式为_______ 。

图丙
(5)一定条件下,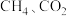 都能与
都能与 形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。
形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 与
与 形成的水合物晶体俗称“可燃冰”。
形成的水合物晶体俗称“可燃冰”。
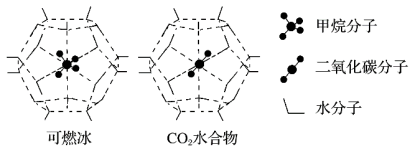
①“可燃冰”中分子间存在的2种作用力是_______ ;
②有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586nm,结合表中内容从物质结构及性质的角度分析,该设想能否实现?_______ (填“能”或“否”)。

(1)图乙中1号C与相邻C有无形成π键?
(2)图甲中1号C与相邻C形成的键之间的夹角
(3)我国制墨工艺将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者沸点更高,其原因是
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为

图丙
(5)一定条件下,
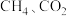 都能与
都能与 形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。
形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 与
与 形成的水合物晶体俗称“可燃冰”。
形成的水合物晶体俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与 的结合能 的结合能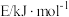 |
 | 0.436 | 16.40 |
 | 0.512 | 29.91 |
②有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586nm,结合表中内容从物质结构及性质的角度分析,该设想能否实现?
您最近一年使用:0次
【推荐2】我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为___________ ;单晶硅的晶体类型为___________ 。SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。
(2)CO2分子中存在___________ 个σ键和___________ 个π键。
(3)甲醇的沸点(64.7°C)介于水(100°C)和甲硫醇(CH3SH,7.6°C)之间,其原因是___________ 。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是___________ ,晶胞参数为apm、apm、cpm,该晶体密度为___________ g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=___________ (用x表达)。

(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为
(2)CO2分子中存在
(3)甲醇的沸点(64.7°C)介于水(100°C)和甲硫醇(CH3SH,7.6°C)之间,其原因是
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】原子序数依次增大的A、B、C、D、E、F五种元素的原子位于前四周期,A元素原子核外有三种不同能级且各个能级所填充的电子数相同,C原子的核外已成对的电子数是未成对电子数的3倍;D核内质子数比E少1;E与C同主族;F2+的M能层里电子全满。
(1)B元素的名称为_____ ,F元素基态原子的价电子排布式为_____ 。
(2)元素A、B、C第一电离能顺序为_____ (填元素符号)。
(3)C与E分别形成的最简单氢化物沸点高低顺序为_____ (用化学式表示),原因是______ 。
(4)D与溴形成的化合物DBr5,加压条件下95℃液化,发生完全电离得到一种能够导电的液体,经测定,该熔体中含有一种正四面体结构的阳离子和Br-,请写出该条件下DBr5电离的电离方程式____ 。该熔体中阳离子的中心原子的杂化方式为_____ 。
(5)请写出E的两种常见氧化物的分子空间构型:_____ ,____ 。

(6)F与E形成的离子晶体晶胞如图所示,该晶体的化学式为______ (用元素符号表示);若晶体的密度为ρ g/cm3,则该晶胞的棱长为_____ pm。
(1)B元素的名称为
(2)元素A、B、C第一电离能顺序为
(3)C与E分别形成的最简单氢化物沸点高低顺序为
(4)D与溴形成的化合物DBr5,加压条件下95℃液化,发生完全电离得到一种能够导电的液体,经测定,该熔体中含有一种正四面体结构的阳离子和Br-,请写出该条件下DBr5电离的电离方程式
(5)请写出E的两种常见氧化物的分子空间构型:

(6)F与E形成的离子晶体晶胞如图所示,该晶体的化学式为
您最近一年使用:0次



