闪锌矿的主要成分为ZnS,其中含有大量的铁元素以及少量的CuO等。湿法浸取闪锌矿制备 和
和 的工艺流程如下图所示。请回答以下问题。
的工艺流程如下图所示。请回答以下问题。 的价电子排布图为
的价电子排布图为________ 。同周期和基态Cu原子具有相同未成对电子数目的元素还有________ 种。
(2)酸浸时 的作用为
的作用为________ 。铜元素在滤渣中的存在形式为________ 。
(3)加入铁粉还原脱酸的优点是________ 。
(4)浓缩结晶时,溶液蒸发至________ 即停止加热。
(5)针铁矿法除铁是在常温下将 缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为
缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为________ 。
(6)把 放到密闭容器内,缓缓抽去其中的水气,
放到密闭容器内,缓缓抽去其中的水气, 分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。
分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。________ ;第三步反应的压强平衡常数为________ Pa;M点时所对应反应的转化率为________ 。
 和
和 的工艺流程如下图所示。请回答以下问题。
的工艺流程如下图所示。请回答以下问题。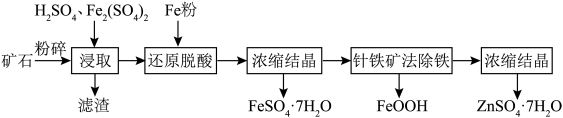
 的价电子排布图为
的价电子排布图为(2)酸浸时
 的作用为
的作用为(3)加入铁粉还原脱酸的优点是
(4)浓缩结晶时,溶液蒸发至
(5)针铁矿法除铁是在常温下将
 缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为
缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为(6)把
 放到密闭容器内,缓缓抽去其中的水气,
放到密闭容器内,缓缓抽去其中的水气, 分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。
分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。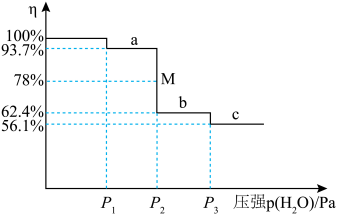
更新时间:2024/05/19 20:18:16
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】甲醇是一种可再生的清洁能源,二氧化碳催化加氢制甲醇,有利于实现“碳达峰”、“碳中和”。已知有关 的热化学方程式如下:
的热化学方程式如下:
Ⅰ. ,
,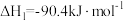 ;
;
Ⅱ. ,
, ;
;
Ⅲ. ,
,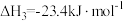 ;
;
Ⅳ. ,
,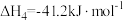 ;
;
请回答下列问题:
(1)

_______ 。
(2)在体积一定的密闭容器中按物质的量比1:2充入CO和 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
_______ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②反应Ⅰ达平衡后,下列措施能提高 产率的是
产率的是_______ (填字母)。
A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:_______ 的浓度随时间的变化; 内,
内, 的平均反应速率为
的平均反应速率为_______  。
。
(4)对于反应Ⅲ,其速率方程式为 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
已知某温度下,上述反应平衡常数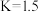 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:
_______  。
。
 的热化学方程式如下:
的热化学方程式如下:Ⅰ.
 ,
,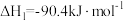 ;
;Ⅱ.
 ,
, ;
;Ⅲ.
 ,
,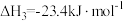 ;
;Ⅳ.
 ,
,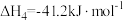 ;
;请回答下列问题:
(1)


(2)在体积一定的密闭容器中按物质的量比1:2充入CO和
 ,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中
,发生上述反应Ⅰ,充分反应达平衡后,如图是平衡混合物中 的体积分数在不同压强下随温度变化的平衡曲线。
的体积分数在不同压强下随温度变化的平衡曲线。
 ,温度为300℃时,反应Ⅰ的压强平衡常数
,温度为300℃时,反应Ⅰ的压强平衡常数
②反应Ⅰ达平衡后,下列措施能提高
 产率的是
产率的是A.加入适量一氧化碳 B.升高温度 C.使用高效催化剂 D.增大压强
(3)一定温度下,向容积为1L的恒容密闭容器中,充入
 和
和 ,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示:
,发生上述反应Ⅱ,测得各物质的物质的量浓度变化如图所示: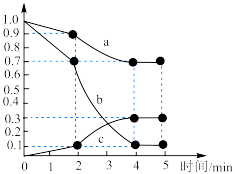
 内,
内, 的平均反应速率为
的平均反应速率为 。
。(4)对于反应Ⅲ,其速率方程式为
 ,
, ,
, ,
, 为速率常数且只与温度有关,则该反应的平衡常数
为速率常数且只与温度有关,则该反应的平衡常数
 、
、 的代数式表示)。
的代数式表示)。已知某温度下,上述反应平衡常数
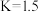 ,在密闭容器中充入一定物质的量的
,在密闭容器中充入一定物质的量的 ,反应到某时刻测得各组分的物质的量如下:
,反应到某时刻测得各组分的物质的量如下:| 物质 |  |  | 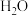 |
| 物质的量/mol | 0.2 | 0.2 | 0.2 |

 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】减少工业和生活废弃物的排放并合理开发利用,近年来受到了人们的普遍关注。
Ⅰ.利用工业废水中的CO2制取甲醇,反应为CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
(1)已知下列反应的能量变化如图所示:
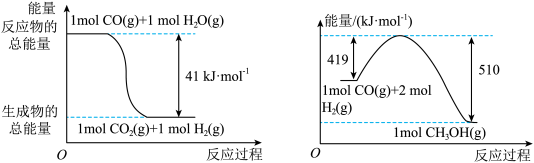
由二氧化碳和氢气制备甲醇的热化学方程式为____________________________ 。
Ⅱ.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(2)一定条件下,在1 L密闭容器中充入0.6 mol CO和1.4 mol H2,8 min后达到平衡,CO的转化率为50%,则8 min内H2的平均反应速率为__________________ 。
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=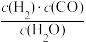 ,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式
,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式____________________________ 。
(4)T ℃时,能发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
此刻正、逆反应速率的关系是v(正)_______ (填“>”、“<”或“=”)v(逆),平衡时c(CH3OCH3)是___________ 。
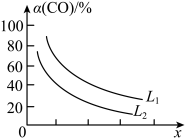
(5)已知反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示_________ (填“温度”或“压强”),判断的理由是_______________________ 。
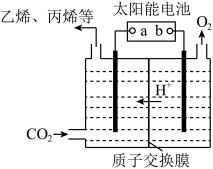
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图所示。b为电源的_____ 极。电解时,生成乙烯的电极反应式为_________________________ 。
Ⅰ.利用工业废水中的CO2制取甲醇,反应为CO2+3H2
 CH3OH+H2O。
CH3OH+H2O。(1)已知下列反应的能量变化如图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为
Ⅱ.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。(2)一定条件下,在1 L密闭容器中充入0.6 mol CO和1.4 mol H2,8 min后达到平衡,CO的转化率为50%,则8 min内H2的平均反应速率为
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=
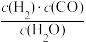 ,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式
,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式(4)T ℃时,能发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.46 | 1.0 | 1.0 |
此刻正、逆反应速率的关系是v(正)

(5)已知反应3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图所示。b为电源的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】二甲醚(CH3OCH3)是一种性能优良的汽车燃料,工业上可利用CO和H2来合成二甲醚,发生的反应为:
I.CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-90.7kJ·mol-l
II.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
回答下列问题:
(1)由CO和H2直接合成CH3OCH3(g)的热化学反应方程式为_______ 。
(2)一定条件下,向恒容容器中充入amolCO和bmolH2,反应1min后,测得不同温度下CO转化率如下表所示。则CO转化率在600K时达到最高的原因是_______ 。
(3)T℃下,向体积为2L的恒容密闭容器中充入2molCH3OH(g)发生反应II。20min时反应达平衡,测得体系中H2O(g)的体积分数为25%。
①0~20min内,用CH3OH表示的平均反应速率v(CH3OH)=_______ mol·L-1·min-1;T℃下反应的平衡常数K=_______ 。若其他条件不变,向该平衡体系中再充入1molCH3OH和lmolCH3OCH3,则平衡向_______ (填“正”或“逆”)反应方向移动。
②实验测得该反应:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)·c(H2O),k正、k逆为速率常数。若改变温度为Tˊ℃,测得平衡时k正=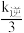 ,则Tˊ
,则Tˊ_______ T(填“大于”或“小于”),判断的理由为_______ 。
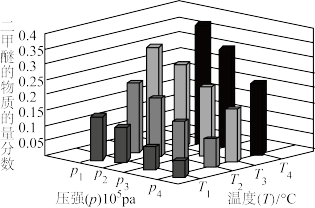
(4)不同压强和温度下,将2.0molCO(g)和4.0molH2(g)充入容积为2L的恒温密闭容器中,平衡时体系中二甲醚的物质的量分数变化情况如下图所示,则H2的平衡转化率最大时应选择的条件是_______(填标号)。
I.CO(g)+2H2(g)⇌CH3OH(g) ΔH1=-90.7kJ·mol-l
II.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
回答下列问题:
(1)由CO和H2直接合成CH3OCH3(g)的热化学反应方程式为
(2)一定条件下,向恒容容器中充入amolCO和bmolH2,反应1min后,测得不同温度下CO转化率如下表所示。则CO转化率在600K时达到最高的原因是
| 温度/K | 400 | 450 | 500 | 550 | 600 | 650 | 700 |
| CO转化率 | 22% | 28% | 32% | 40% | 61% | 50% | 18% |
(3)T℃下,向体积为2L的恒容密闭容器中充入2molCH3OH(g)发生反应II。20min时反应达平衡,测得体系中H2O(g)的体积分数为25%。
①0~20min内,用CH3OH表示的平均反应速率v(CH3OH)=
②实验测得该反应:v正=k正c2(CH3OH),v逆=k逆c(CH3OCH3)·c(H2O),k正、k逆为速率常数。若改变温度为Tˊ℃,测得平衡时k正=
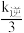 ,则Tˊ
,则Tˊ(4)不同压强和温度下,将2.0molCO(g)和4.0molH2(g)充入容积为2L的恒温密闭容器中,平衡时体系中二甲醚的物质的量分数变化情况如下图所示,则H2的平衡转化率最大时应选择的条件是_______(填标号)。

| A.p1、T4 | B.p4、T2 | C.P3、T3 | D.P4、T1 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】砷化铝(AlAs)常用作光谱分析试剂和制备电子组件的原料,是一种新型半导体材料。回答下列问题:
(1)基态As原子的核外价电子排布图为_______ ;第一电离能I1(As)_______ I1(Se) (填“大于”或“小于”),其原因是_______ 。
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为_______ ;分子中As、S原子的杂化轨道类型分别为_______ 、_______ 。
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是_______ 、_______ 。
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为_______ ;该晶体密度为ρ g·cm-3,设NA为阿伏加德罗常数的值,晶胞参数为_______ pm。

(1)基态As原子的核外价电子排布图为
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为____________ , 含有____________ 等化学键。
(2)生成物中含有10个电子的分子是________ (写分子式),该分子的空间构型_______ ,中心原子的杂化方式为___________________ 。
(3)反应物中电负性最大的元素为________ (填元素符号),写出其原子最外层的电子排布图_______________ 。
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点、大立方体的体心和8个小立方体的体心,那么大立方体的面心处所代表的微粒是__________ (填微粒符号)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
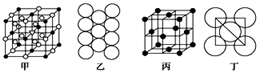
若已知Al的原子半径为r pm,NA代表阿伏伽德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___________ 个; Al晶体的密度为________ g/cm3 (用字母表示)。
(1)冰晶石的化学式为
(2)生成物中含有10个电子的分子是
(3)反应物中电负性最大的元素为
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,“●”位于大立方体的顶点和面心,“○”位于大立方体的12条棱的中点、大立方体的体心和8个小立方体的体心,那么大立方体的面心处所代表的微粒是
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知Al的原子半径为r pm,NA代表阿伏伽德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】钴合金是以铂为基的含钴二元合金,在高温下,铂与钻可无限互熔,其固熔体为面心立方晶格。
(1)Co元素在周期表中属于___________ 区,其基态原子的价电子排布图为___________ 。
(2)二氯二吡啶合铂分子是一种铂配合物,有顺式和反式两种同分异构体(如图)。科学研究表明,顺式分子具有抗癌活性。
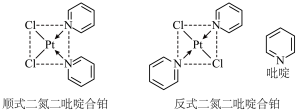
①顺式二氯二吡啶合铂分子中不存在的化学键类型为___________ (填字母)。
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键
②反式二氯二吡啶合铂分子是___________ 分子(填“极性”或“非极性”)。
③吡啶分子是大体积平面形配体,吡啶中 原子的杂化方式为
原子的杂化方式为___________ ,吡啶分子中与 形成配位键的电子对位于
形成配位键的电子对位于 原子的
原子的___________ 轨道上。
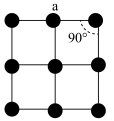
(3)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿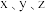 轴的投影图均为如下图所示,若金属铂的密度为
轴的投影图均为如下图所示,若金属铂的密度为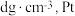 原子的半径为
原子的半径为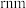 ,则晶胞参数a=
,则晶胞参数a=___________  (用含
(用含 的表达式表示,下同),该堆积方式中的空间利用率为
的表达式表示,下同),该堆积方式中的空间利用率为___________ 。
(1)Co元素在周期表中属于
(2)二氯二吡啶合铂分子是一种铂配合物,有顺式和反式两种同分异构体(如图)。科学研究表明,顺式分子具有抗癌活性。

①顺式二氯二吡啶合铂分子中不存在的化学键类型为
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键
②反式二氯二吡啶合铂分子是
③吡啶分子是大体积平面形配体,吡啶中
 原子的杂化方式为
原子的杂化方式为 形成配位键的电子对位于
形成配位键的电子对位于 原子的
原子的(3)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿
 轴的投影图均为如下图所示,若金属铂的密度为
轴的投影图均为如下图所示,若金属铂的密度为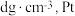 原子的半径为
原子的半径为 ,则晶胞参数a=
,则晶胞参数a= (用含
(用含 的表达式表示,下同),该堆积方式中的空间利用率为
的表达式表示,下同),该堆积方式中的空间利用率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】硫酸亚铁铵(NH4)2Fe(SO4)2常以结晶水合物形式存在,俗称莫尔盐,为浅绿色晶体,它在空气中比一般的亚铁盐要稳定,不易被氧化,易溶于水,但不溶于乙醇。某小组同学设计如下实验制备莫尔盐:
步骤1:称取铁屑,放入锥形瓶中,加入10%Na2CO3溶液以去除表面的油污,缓缓加热约10min,倒去碱液,用水清洗铁屑;
步骤2:向盛有铁屑的锥形瓶中加入3mol/LH2SO4溶液,加热,直至反应基本完成,得FeSO4溶液;
步骤3:向上述溶液中加入(NH4)2SO4固体制得混合溶液,“操作X”,冷却至室温析出硫酸亚铁铵晶体,过滤。
(1)步骤2中为加快反应速率,需将试剂温度保持在70~75℃,一般采取的加热方式是_______ 。
(2)步骤3中,“操作X”为________ 。
(3)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质。请设法检验制得的晶体是否发生了变质_______ 。
(4)实验小组为测定莫尔盐(NH4)2Fe(SO4)2•nH2O的化学式,操作过程如下:
①称取质量为1.96g的莫尔盐,制成溶液。
②加入含0.001molKMnO4的酸性溶液,一段时间后,KMnO4恰好完全被Fe2+还原为Mn2+,Fe2+则被氧化为Fe3+。通过计算得出n=_______ 。
(5)制备莫尔盐的实验中,需对过滤出产品的母液进行处理。常温下,分别取母液并向其中加入指定物质后,溶液中可以大量存在的离子组合正确的是_______ 。
步骤1:称取铁屑,放入锥形瓶中,加入10%Na2CO3溶液以去除表面的油污,缓缓加热约10min,倒去碱液,用水清洗铁屑;
步骤2:向盛有铁屑的锥形瓶中加入3mol/LH2SO4溶液,加热,直至反应基本完成,得FeSO4溶液;
步骤3:向上述溶液中加入(NH4)2SO4固体制得混合溶液,“操作X”,冷却至室温析出硫酸亚铁铵晶体,过滤。
(1)步骤2中为加快反应速率,需将试剂温度保持在70~75℃,一般采取的加热方式是
(2)步骤3中,“操作X”为
(3)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质。请设法检验制得的晶体是否发生了变质
(4)实验小组为测定莫尔盐(NH4)2Fe(SO4)2•nH2O的化学式,操作过程如下:
①称取质量为1.96g的莫尔盐,制成溶液。
②加入含0.001molKMnO4的酸性溶液,一段时间后,KMnO4恰好完全被Fe2+还原为Mn2+,Fe2+则被氧化为Fe3+。通过计算得出n=
(5)制备莫尔盐的实验中,需对过滤出产品的母液进行处理。常温下,分别取母液并向其中加入指定物质后,溶液中可以大量存在的离子组合正确的是
A.通入过量Cl2:Fe3+、H+、NH 、Cl-、SO 、Cl-、SO |
B.加入过量NaClO溶液:NH 、Fe2+、H+、SO 、Fe2+、H+、SO 、ClO- 、ClO- |
C.加入过量NaOH溶液:Na+、Fe2+、NH 、SO 、SO 、OH- 、OH- |
D.加入过量NaClO和NaOH溶液:Na+、SO 、Cl-、ClO-、OH- 、Cl-、ClO-、OH- |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】过氧化钙( )微溶于水,溶于酸,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术提供氧气。
)微溶于水,溶于酸,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术提供氧气。
以下是一种实验室制备过氧化钙方法的主要流程:
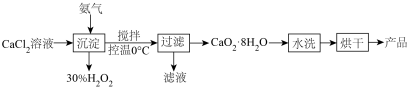
(1)实验装置如下:

仪器a的名称为___________ 。
(2)A装置的作用是___________ 。装置的连接顺序为___________ (按气流方向,用大写字母表示)
(3)反应中生成沉淀的化学方程式为___________ 。
(4)有同学认为,为了加快反应速率和提高产率,可将冰水浴改为温水浴加热,你认为该同学的观点是否合理并说明理由___________ 。
(5)检验 是否洗净的操作是
是否洗净的操作是___________ 。
(6)为测量样品中 的纯度,取0.3000g产品于烧杯,加过量盐酸并煮沸,冷却后加过量
的纯度,取0.3000g产品于烧杯,加过量盐酸并煮沸,冷却后加过量 沉淀,过滤、洗涤后将沉淀转入锥形瓶中,加足量稀硫酸,用
沉淀,过滤、洗涤后将沉淀转入锥形瓶中,加足量稀硫酸,用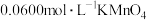 标准溶液滴定至终点,重复2~3次,平均消耗标准溶液26.00mL。
标准溶液滴定至终点,重复2~3次,平均消耗标准溶液26.00mL。
已知:
①样品中 的纯度是
的纯度是___________ 。(保留三位有效数字,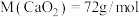 )
)
②若操作不当,造成结果偏低的可能原因有___________ (选填序号)。
A.烘干时温度过高,少量 分解为CaO B.转移
分解为CaO B.转移 沉淀时,有固体残留在滤纸上
沉淀时,有固体残留在滤纸上
C.洗涤 沉淀时,未洗涤干净 D.滴定终点读数时,俯视读数
沉淀时,未洗涤干净 D.滴定终点读数时,俯视读数
 )微溶于水,溶于酸,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术提供氧气。
)微溶于水,溶于酸,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术提供氧气。以下是一种实验室制备过氧化钙方法的主要流程:

(1)实验装置如下:

仪器a的名称为
(2)A装置的作用是
(3)反应中生成沉淀的化学方程式为
(4)有同学认为,为了加快反应速率和提高产率,可将冰水浴改为温水浴加热,你认为该同学的观点是否合理并说明理由
(5)检验
 是否洗净的操作是
是否洗净的操作是(6)为测量样品中
 的纯度,取0.3000g产品于烧杯,加过量盐酸并煮沸,冷却后加过量
的纯度,取0.3000g产品于烧杯,加过量盐酸并煮沸,冷却后加过量 沉淀,过滤、洗涤后将沉淀转入锥形瓶中,加足量稀硫酸,用
沉淀,过滤、洗涤后将沉淀转入锥形瓶中,加足量稀硫酸,用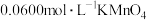 标准溶液滴定至终点,重复2~3次,平均消耗标准溶液26.00mL。
标准溶液滴定至终点,重复2~3次,平均消耗标准溶液26.00mL。已知:

①样品中
 的纯度是
的纯度是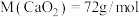 )
)②若操作不当,造成结果偏低的可能原因有
A.烘干时温度过高,少量
 分解为CaO B.转移
分解为CaO B.转移 沉淀时,有固体残留在滤纸上
沉淀时,有固体残留在滤纸上C.洗涤
 沉淀时,未洗涤干净 D.滴定终点读数时,俯视读数
沉淀时,未洗涤干净 D.滴定终点读数时,俯视读数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】Ⅰ.胆矾(CuSO4·5H2O)易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的CuO(杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有_______(填标号)
(2)将CuO加入到适量的稀硫酸中,加热,其主要反应的化学方程式为_______ ,与直接用废铜和浓硫酸反应相比,该方法的优点是_______ 。
(3)待CuO完全反应后停止加热,边搅拌边加入适量H2O2,冷却后用NH3·H2O调pH为3.5~4,再煮沸10min,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、_______ 、乙醇洗涤、_______ ,得到胆矾。其中,控制溶液pH为3.5~4的目的是_______
ⅠⅠ.高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。现某实验小组制备高铁酸钾(K2FeO4)装置如图所示,夹持、加热等装置略。回答下列问题:
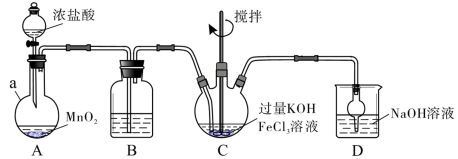
(4)装置B中除杂质所用试剂是_______ ,装置D的作用是_______ 。
(5)C中反应为放热反应,而反应温度须控制在0~5℃,反应中KOH必须过量的原因是_______ 。
(6)C中制备高铁酸钾的反应体系中有六种微粒;Fe3+、Cl2、OH-、FeO 、Cl-、H2O。写出总反应的离子方程式:
、Cl-、H2O。写出总反应的离子方程式:_______ 。C中混合物经过重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体若反应过程中转移了0.6mol电子,则还原产物的物质的量为_______ mol。
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有_______(填标号)
| A.烧杯 | B.容量瓶 | C.蒸发皿 | D.移液管 |
(3)待CuO完全反应后停止加热,边搅拌边加入适量H2O2,冷却后用NH3·H2O调pH为3.5~4,再煮沸10min,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、
ⅠⅠ.高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。现某实验小组制备高铁酸钾(K2FeO4)装置如图所示,夹持、加热等装置略。回答下列问题:

(4)装置B中除杂质所用试剂是
(5)C中反应为放热反应,而反应温度须控制在0~5℃,反应中KOH必须过量的原因是
(6)C中制备高铁酸钾的反应体系中有六种微粒;Fe3+、Cl2、OH-、FeO
 、Cl-、H2O。写出总反应的离子方程式:
、Cl-、H2O。写出总反应的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】测定某样品中小苏打(主要成分为 )的含量有多种方法。
)的含量有多种方法。
I.重量法:
(1)某小组欲通过加热样品以测定小苏打的含量,化学方程式为:_________________ ;
为了测定某发酵剂样品中碳酸氢钠的含量,取样品ng,充分灼烧以后,称得残留固体质量为mg(假设其他成分不分解)。则样品中碳酸氢钠的含量:______________ (填含n、m的计算式)。
(2)另一化学兴趣小组的同学用重量法测定某品牌小苏打中 的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生汽泡为止,测得的有关数据如下表所示。
的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生汽泡为止,测得的有关数据如下表所示。
生成 的质量为
的质量为__________ :样品中的 的质量分数
的质量分数__________ (以小数点表示,保留小数点后3位)。
II.量气法:
(3)通过测得__________ 的体积,从而通过换算求得小苏打的含量。
方案II的装置如图所示(在标准状况下):

操作步骤:.
①使A和B液面相平,记录A的液面位置 ;
;
②待烧瓶中不再有气体产生并恢复至室温后,使A和B液面相平;
③再次记录A的液面位置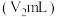 ;
;
④将足量试剂Y和样品加入Y型管中;
⑤检查装置气密性;
⑥倾斜Y形管,使样品全部进入样品的支管中反应;
⑦将A和B错开高度固定在滴定管夹上,从B中注入一定量的水在0至100mL之间。
(4)该实验的操作顺序是__________ (用序号表示)。
(5)A装置的名称是__________ ,B装置的名称是__________ 。
(6)有同学认为试剂Y选用稀盐酸不够好,你认为可能的原因是:__________ 。
(7)用图所示实验装置测定气体摩尔体积,相关叙述正确的是__________ (填字母)。
a.用 代替水,测得二氧化碳的体积更准确
代替水,测得二氧化碳的体积更准确
b.A压入B的水过多而溢出,会导致测定失败
c.不一定需要体系温度降低到室温也可进行读数
d.上提水准管,量气管液面高度不断改变,说明装置漏气
 )的含量有多种方法。
)的含量有多种方法。I.重量法:
(1)某小组欲通过加热样品以测定小苏打的含量,化学方程式为:
为了测定某发酵剂样品中碳酸氢钠的含量,取样品ng,充分灼烧以后,称得残留固体质量为mg(假设其他成分不分解)。则样品中碳酸氢钠的含量:
(2)另一化学兴趣小组的同学用重量法测定某品牌小苏打中
 的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生汽泡为止,测得的有关数据如下表所示。
的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生汽泡为止,测得的有关数据如下表所示。| 物质 | 样品 | 消耗的稀盐酸 | 反应后的溶液 |
| 质量(g) | 4.5g | 37.7g | 40g |
 的质量为
的质量为 的质量分数
的质量分数II.量气法:
(3)通过测得
方案II的装置如图所示(在标准状况下):

操作步骤:.
①使A和B液面相平,记录A的液面位置
 ;
;②待烧瓶中不再有气体产生并恢复至室温后,使A和B液面相平;
③再次记录A的液面位置
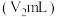 ;
;④将足量试剂Y和样品加入Y型管中;
⑤检查装置气密性;
⑥倾斜Y形管,使样品全部进入样品的支管中反应;
⑦将A和B错开高度固定在滴定管夹上,从B中注入一定量的水在0至100mL之间。
(4)该实验的操作顺序是
(5)A装置的名称是
(6)有同学认为试剂Y选用稀盐酸不够好,你认为可能的原因是:
(7)用图所示实验装置测定气体摩尔体积,相关叙述正确的是
a.用
 代替水,测得二氧化碳的体积更准确
代替水,测得二氧化碳的体积更准确b.A压入B的水过多而溢出,会导致测定失败
c.不一定需要体系温度降低到室温也可进行读数
d.上提水准管,量气管液面高度不断改变,说明装置漏气
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】侯德榜先生对索尔维制碱法进行了改进,将氨碱法和合成氨联合起来,这就是联合制碱法,也称侯氏制碱法。
Ⅰ、侯氏制碱法的生产流程如下图所示:_______ ,产品Z的化学式为_______ ,操作1的名称是_______ 。
(2)该法通入 的反应原理是
的反应原理是_______ (用化学方程式表示)。
Ⅱ、制得的碳酸钠样品中往往含有少量的 ,某探究性学习小组设计如下图所示装置,测定该样品中
,某探究性学习小组设计如下图所示装置,测定该样品中 的质量分数。
的质量分数。
①检查装置的气密性 ②取 样品装入广口瓶中 ③打开止水夹 ④缓慢鼓入空气数分钟 ⑤关闭止水夹 ⑥在干燥管内装满碱石灰,称量其质量为
样品装入广口瓶中 ③打开止水夹 ④缓慢鼓入空气数分钟 ⑤关闭止水夹 ⑥在干燥管内装满碱石灰,称量其质量为 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧打开止水夹
⑦缓慢加入稀硫酸至不再产生气体为止 ⑧打开止水夹
⑨缓慢鼓入空气数分钟,再称量干燥管质量为
(3)装置A的作用是_______ ;操作④中,鼓入空气的作用是_______ 。
(4)如果将步骤⑥提前到与步骤②一同进行,会导致测定结果_______ (填“偏大”、“偏小”或“不变”)。
(5)根据实验数据列出样品中 的质量分数表达式
的质量分数表达式_______ 。
Ⅰ、侯氏制碱法的生产流程如下图所示:
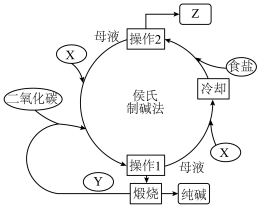
(2)该法通入
 的反应原理是
的反应原理是Ⅱ、制得的碳酸钠样品中往往含有少量的
 ,某探究性学习小组设计如下图所示装置,测定该样品中
,某探究性学习小组设计如下图所示装置,测定该样品中 的质量分数。
的质量分数。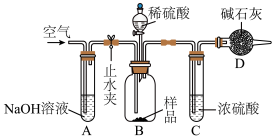
①检查装置的气密性 ②取
 样品装入广口瓶中 ③打开止水夹 ④缓慢鼓入空气数分钟 ⑤关闭止水夹 ⑥在干燥管内装满碱石灰,称量其质量为
样品装入广口瓶中 ③打开止水夹 ④缓慢鼓入空气数分钟 ⑤关闭止水夹 ⑥在干燥管内装满碱石灰,称量其质量为 ⑦缓慢加入稀硫酸至不再产生气体为止 ⑧打开止水夹
⑦缓慢加入稀硫酸至不再产生气体为止 ⑧打开止水夹⑨缓慢鼓入空气数分钟,再称量干燥管质量为

(3)装置A的作用是
(4)如果将步骤⑥提前到与步骤②一同进行,会导致测定结果
(5)根据实验数据列出样品中
 的质量分数表达式
的质量分数表达式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】大量燃放鞭炮会引起空气中SO2等有害气体含量增高,造成大气污染。某兴趣小组欲探究SO2的性质,并利用SO2制备食品抗氧化剂焦亚硫酸钠(Na2S2O5)。已知Na2S2O5溶于水即生成NaHSO3。
(1)制取SO2并探究其性质

①装置A1中发生反应的化学方程式为_______ 。
②装置B用于检验SO2的漂白性,其中所盛试剂为_______ ,装置C中发生反应的SO2和H2S的物质的量之比为_______ 。
③为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2除具有绿色环保的优点外,还具有的优点是_______ (任写一点)。
(2)制备焦亚硫酸钠并测定其含量
①将SO2通入Na2SO3制取Na2S2O5,发生的反应为Na2SO3+SO2=Na2S2O5,该反应为_______ (填“氧化还原反应”或“非氧化还原反应”)。
②测定某葡萄酒中Na2S2O5残留量的方案为:取葡萄酒样品100.00mL,加入盐酸充分蒸馏。将馏分用0.0100mol/L标准I2溶液进行滴定(反应方程式为SO2+I2+2H2O=H2SO4+2HI),消耗标准I2溶液25.00mL。
计算样品中抗氧化剂的残留量(以SO2计)为_______ g•L-1(写出计算过程)。
(1)制取SO2并探究其性质

①装置A1中发生反应的化学方程式为
②装置B用于检验SO2的漂白性,其中所盛试剂为
③为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2除具有绿色环保的优点外,还具有的优点是
(2)制备焦亚硫酸钠并测定其含量
①将SO2通入Na2SO3制取Na2S2O5,发生的反应为Na2SO3+SO2=Na2S2O5,该反应为
②测定某葡萄酒中Na2S2O5残留量的方案为:取葡萄酒样品100.00mL,加入盐酸充分蒸馏。将馏分用0.0100mol/L标准I2溶液进行滴定(反应方程式为SO2+I2+2H2O=H2SO4+2HI),消耗标准I2溶液25.00mL。
计算样品中抗氧化剂的残留量(以SO2计)为
您最近一年使用:0次



