2024届河南省郑州市高三下学期第三次质量预测理科综合试题-高中化学
河南
高三
三模
2024-05-19
214次
整体难度:
适中
考查范围:
认识化学科学、化学与STSE、有机化学基础、化学反应原理、物质结构与性质、常见无机物及其应用、化学实验基础
2024届河南省郑州市高三下学期第三次质量预测理科综合试题-高中化学
河南
高三
三模
2024-05-19
214次
整体难度:
适中
考查范围:
认识化学科学、化学与STSE、有机化学基础、化学反应原理、物质结构与性质、常见无机物及其应用、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
1. 我国歼35战机采用双发动机布局、铝合金加强框一翼梁整体大部件、碳纤维材料、特殊表面纳米材料涂层等创新技术,零件减少50%、减重38%,制造效率提高10倍以上。下列叙述正确的是
| A.其燃料煤油属于纯净物 |
| B.碳纤维属于有机高分子化合物 |
| C.铝合金具有质量轻、强度低的性质 |
D.纳米材料的微粒直径范围为 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
2. 某同学设计的一种合成缓释阿司匹林的部分路线如下。
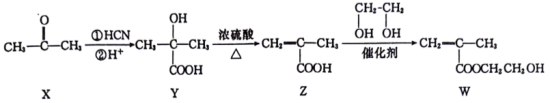
| A.上述有机物包含了5种含氧官能团 |
| B.X分子中最多有4个原子共平面 |
| C.Y的名称为2-甲基-2-羟基丙酸 |
| D.W可发生加成、氧化、还原、缩聚等反应 |
您最近一年使用:0次
单选题
|
适中(0.65)
3. 中科院理化技术研究所在低温下制备了PbZn合金负载的ZnO光催化剂(PbZn-ZnO),首次实现了光催化乙烷氧气化脱氢制乙烯。反应历程如图1,PbZn晶胞结构如图2。其中“*”表示催化剂吸附状态。下列说法错误的是

| A.光催化乙烷氧气化脱氢制乙烯为放热反应 |
B.该PbZn合金的晶胞密度为 |
| C.反应速率最快的基元反应中有σ键的断裂与生成 |
D.该历程发生的反应为: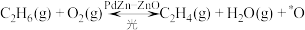 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
4. X、Y、Z、W为原子序数依次增大的4种短周期元素,其中基态W原子的s轨道上电子数总和比p轨道上电子数少1。X、Y、Z、W构成的某有机物的结构如图所示,该有机物是锂电池的电解液添加剂,可以降低锂电池发热和自燃率。下列说法正确的是

| A.第一电离能:W>Z>Y | B.原子半径:Y>Z>X>W |
| C.氢化物的沸点:Z>Y>W | D.该有机物中Y原子的杂化类型有 、 、 、 、 |
您最近一年使用:0次
单选题
|
适中(0.65)
5. 某化学兴趣小组探究一种硫酸盐晶体的组成,其实验过程如图所示。下列说法正确的是
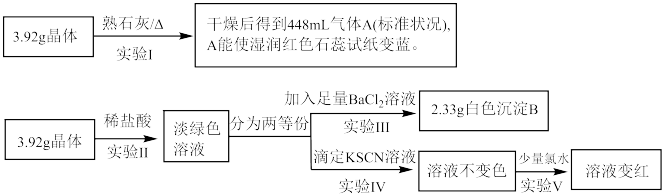
A.该硫酸盐的化学式为 |
| B.实验Ⅲ的操作包括过滤、洗涤、干燥、称量 |
C.由实验Ⅲ数据可知3.92g晶体中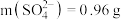 |
D.上述实验过程可证明该晶体中含有 |
您最近一年使用:0次
单选题
|
较难(0.4)
6. 光电合成 、HClO绿色消毒剂具有巨大的潜力。下图中的电解池以含
、HClO绿色消毒剂具有巨大的潜力。下图中的电解池以含 S型异质结双功能催化剂为电极材料电解NaCl溶液,实现了同时生成
S型异质结双功能催化剂为电极材料电解NaCl溶液,实现了同时生成 和HClO。下列说法错误的是
和HClO。下列说法错误的是
 、HClO绿色消毒剂具有巨大的潜力。下图中的电解池以含
、HClO绿色消毒剂具有巨大的潜力。下图中的电解池以含 S型异质结双功能催化剂为电极材料电解NaCl溶液,实现了同时生成
S型异质结双功能催化剂为电极材料电解NaCl溶液,实现了同时生成 和HClO。下列说法错误的是
和HClO。下列说法错误的是
| A.b电极的电势高于a电极 |
| B.电解过程中Ⅱ池pH变小 |
| C.离子交换膜为阳离子交换膜时,Ⅱ池溶液质量增大 |
D.Ⅰ池电极反应为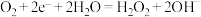 |
【知识点】 电解池电极反应式及化学方程式的书写与判断解读
您最近一年使用:0次
7. 某温度下,保持溶液中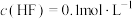 ,调节溶液的pH,pH与pX[X表示
,调节溶液的pH,pH与pX[X表示 、
、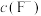 、
、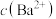 、
、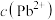 ]的关系如下图所示。已知:
]的关系如下图所示。已知: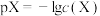 ;
; 。下列叙述错误的是
。下列叙述错误的是
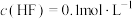 ,调节溶液的pH,pH与pX[X表示
,调节溶液的pH,pH与pX[X表示 、
、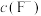 、
、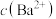 、
、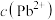 ]的关系如下图所示。已知:
]的关系如下图所示。已知: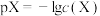 ;
; 。下列叙述错误的是
。下列叙述错误的是
A.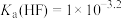 |
B.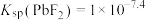 |
| C.①与②线的交点的pH为2.3 |
D. 时, 时,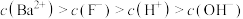 |
【知识点】 盐溶液中离子浓度大小的比较解读 溶度积常数相关计算解读
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
8. 葡萄糖酸锌 是一种有机补锌剂,易溶于热水,不溶于乙醇,温度高于100℃即开始分解。化学间接合成法制备葡萄糖酸锌的过程如下图所示。
是一种有机补锌剂,易溶于热水,不溶于乙醇,温度高于100℃即开始分解。化学间接合成法制备葡萄糖酸锌的过程如下图所示。
称取ag产品配成溶液置于锥形瓶中,加入铬黑T指示剂,用 的EDTA进行滴定,消耗EDTA的体积平均为VmL。[
的EDTA进行滴定,消耗EDTA的体积平均为VmL。[ 代表EDTA,EDTA与
代表EDTA,EDTA与 形成无色的配合物
形成无色的配合物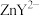 ,铬黑T离子
,铬黑T离子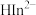 (蓝色)能与
(蓝色)能与 形成紫红色的
形成紫红色的 。滴定原理为:
。滴定原理为: (紫红色)
(紫红色) (蓝色)
(蓝色)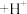 ]
]
已知: 的溶解度如下表:
的溶解度如下表:
回答以下问题:
(1)Ⅰ处稀释浓硫酸时不需要用到下列物品中的________ (填标号)。
(2)Ⅱ处葡萄糖酸钙和稀硫酸反应时需保持温度为90℃,其加热方式为________ 。分离出“滤渣”的操作是________ 。Ⅲ处将滤液通过强酸性离子交换树脂的目的是________ 。
(3)生成葡萄糖酸锌的化学方程式是________ 。
(4)抽滤前加入乙醇,充分搅拌并冷却,析出葡萄糖酸锌固体。加入乙醇的目的是________ ,从而降低产品的溶解度而使其析出。抽滤时滤纸用乙醇湿润,而不能用水湿润的原因是________ 。
(5)滴定终点时溶液的颜色变化为________ 。
(6)产品中Zn的含量为________ 。
 是一种有机补锌剂,易溶于热水,不溶于乙醇,温度高于100℃即开始分解。化学间接合成法制备葡萄糖酸锌的过程如下图所示。
是一种有机补锌剂,易溶于热水,不溶于乙醇,温度高于100℃即开始分解。化学间接合成法制备葡萄糖酸锌的过程如下图所示。
称取ag产品配成溶液置于锥形瓶中,加入铬黑T指示剂,用
 的EDTA进行滴定,消耗EDTA的体积平均为VmL。[
的EDTA进行滴定,消耗EDTA的体积平均为VmL。[ 代表EDTA,EDTA与
代表EDTA,EDTA与 形成无色的配合物
形成无色的配合物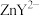 ,铬黑T离子
,铬黑T离子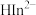 (蓝色)能与
(蓝色)能与 形成紫红色的
形成紫红色的 。滴定原理为:
。滴定原理为: (紫红色)
(紫红色) (蓝色)
(蓝色)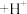 ]
]已知:
 的溶解度如下表:
的溶解度如下表:温度/℃ | 40 | 50 | 60 | 70 |
| 0.210 | 0.207 | 0.201 | 0.193 |
(1)Ⅰ处稀释浓硫酸时不需要用到下列物品中的
|
|
|
|
| A.实验服 | B.护目镜 | C.医用橡胶手套 | D.防毒面具 |
(3)生成葡萄糖酸锌的化学方程式是
(4)抽滤前加入乙醇,充分搅拌并冷却,析出葡萄糖酸锌固体。加入乙醇的目的是
(5)滴定终点时溶液的颜色变化为
(6)产品中Zn的含量为
【知识点】 酸碱中和滴定原理的应用解读 仪器使用与实验安全 物质含量的测定
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
9. 闪锌矿的主要成分为ZnS,其中含有大量的铁元素以及少量的CuO等。湿法浸取闪锌矿制备 和
和 的工艺流程如下图所示。请回答以下问题。
的工艺流程如下图所示。请回答以下问题。 的价电子排布图为
的价电子排布图为________ 。同周期和基态Cu原子具有相同未成对电子数目的元素还有________ 种。
(2)酸浸时 的作用为
的作用为________ 。铜元素在滤渣中的存在形式为________ 。
(3)加入铁粉还原脱酸的优点是________ 。
(4)浓缩结晶时,溶液蒸发至________ 即停止加热。
(5)针铁矿法除铁是在常温下将 缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为
缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为________ 。
(6)把 放到密闭容器内,缓缓抽去其中的水气,
放到密闭容器内,缓缓抽去其中的水气, 分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。
分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。________ ;第三步反应的压强平衡常数为________ Pa;M点时所对应反应的转化率为________ 。
 和
和 的工艺流程如下图所示。请回答以下问题。
的工艺流程如下图所示。请回答以下问题。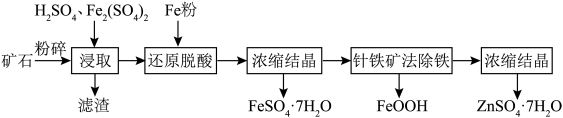
 的价电子排布图为
的价电子排布图为(2)酸浸时
 的作用为
的作用为(3)加入铁粉还原脱酸的优点是
(4)浓缩结晶时,溶液蒸发至
(5)针铁矿法除铁是在常温下将
 缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为
缓慢氧化,使铁元素以针铁矿形式形成沉淀而达到除铁的目的。针铁矿法除铁的离子方程式为(6)把
 放到密闭容器内,缓缓抽去其中的水气,
放到密闭容器内,缓缓抽去其中的水气, 分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。
分三次脱水。各步脱水过程为一系列动态平衡。剩余固体质量占原来总质量的百分比(η)与容器中水蒸气的压强变化关系如下图所示。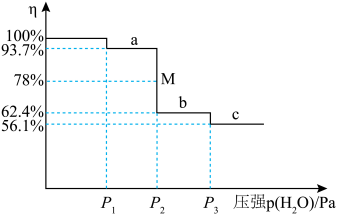
您最近一年使用:0次
解答题-原理综合题
|
较难(0.4)
10. T℃下,向恒压密闭容器中充入 ,加入催化剂发生催化脱氢反应
,加入催化剂发生催化脱氢反应
 。
。
(1)下图为丙烷的平衡转化率在不同压强下随温度的变化关系。
________ 0(填“>”“<”,下同),压强
________  。
。
(2)若平衡时体系总压强为P。试用压强平衡常数 和P表示丙烷的转化率x=
和P表示丙烷的转化率x=________ 。(不考虑副反应)
(3)若在体系中通入 可以提高脱氢反应的转化率,其原因可能是
可以提高脱氢反应的转化率,其原因可能是________ (答2点)。
(4)某同学查阅资料得知丙烷无氧脱氢制丙烯的几种催化剂的反应性能如下表所示(丙烯选择性是指转化的 中生成
中生成 的百分比))。
的百分比))。
常见丙烷无氧脱氢制丙烯催化剂反应性能
表中的反应温度数据不尽相同,其选取温度的考虑因素可能是________ 。丙烯收率的计算公式是:收率=________ 。由表中数据,你认为最佳催化剂为________ 。
(5)向1L密闭容器中充入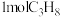 ,在某催化剂作用下反应10min,丙烷转化率和丙烯选择性如下图所示。当
,在某催化剂作用下反应10min,丙烷转化率和丙烯选择性如下图所示。当 的转化率为40%时,丙烯的选择性是
的转化率为40%时,丙烯的选择性是________ %,丙烯的收率是________ %。
 ,加入催化剂发生催化脱氢反应
,加入催化剂发生催化脱氢反应
 。
。(1)下图为丙烷的平衡转化率在不同压强下随温度的变化关系。



 。
。(2)若平衡时体系总压强为P。试用压强平衡常数
 和P表示丙烷的转化率x=
和P表示丙烷的转化率x=(3)若在体系中通入
 可以提高脱氢反应的转化率,其原因可能是
可以提高脱氢反应的转化率,其原因可能是(4)某同学查阅资料得知丙烷无氧脱氢制丙烯的几种催化剂的反应性能如下表所示(丙烯选择性是指转化的
 中生成
中生成 的百分比))。
的百分比))。常见丙烷无氧脱氢制丙烯催化剂反应性能
催化剂 | 反应温度/℃ | 转化率/% | 丙烯选择性/% | 丙烯收率/% |
 | 600 | 50.0 | 90.0 | 45.0 |
 | 620 | 39.0 | 85.0 | 33.2 |
 | 620 | 34.4 | 62.9 | 21.6 |
 | 590 | 18.6 | 76.8 | 14.3 |
 | 590 | 36.4 | 99.3 | 36.1 |
(5)向1L密闭容器中充入
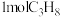 ,在某催化剂作用下反应10min,丙烷转化率和丙烯选择性如下图所示。当
,在某催化剂作用下反应10min,丙烷转化率和丙烯选择性如下图所示。当 的转化率为40%时,丙烯的选择性是
的转化率为40%时,丙烯的选择性是
您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
解题方法
11. 贝诺酯有解热镇痛消炎作用。以下为贝诺酯的一种合成路线。
回答下列问题:
(1)B的化学名称是________ 。A和B相比,酸性更强的是________ 。
(2)B→C的反应需要在碱性条件下进行,其原因是________ 。
(3)E的结构简式为________ 。
(4)F中官能团的名称为________ 。
(5)D与 反应生成E的反应类型为
反应生成E的反应类型为________ 。
(6)试剂a为酸性 ,则C→D反应的离子方程式为
,则C→D反应的离子方程式为________ 。
(7)在C的同分异构体中,同时满足下列条件的共有________ 种(不考虑立体异构)。
①能和NaOH溶液反应②不能发生银镜反应③含有碳氧双键,且苯环对位有两个取代基。其中,核磁共振氢谱显示为4组峰,且峰面积比为3:2:2:3的同分异构体的结构简式为________ 。
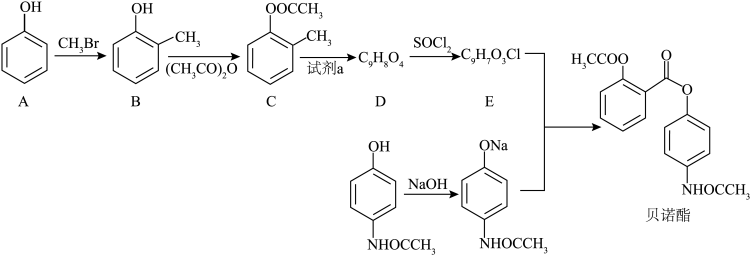

回答下列问题:
(1)B的化学名称是
(2)B→C的反应需要在碱性条件下进行,其原因是
(3)E的结构简式为
(4)F中官能团的名称为
(5)D与
 反应生成E的反应类型为
反应生成E的反应类型为(6)试剂a为酸性
 ,则C→D反应的离子方程式为
,则C→D反应的离子方程式为(7)在C的同分异构体中,同时满足下列条件的共有
①能和NaOH溶液反应②不能发生银镜反应③含有碳氧双键,且苯环对位有两个取代基。其中,核磁共振氢谱显示为4组峰,且峰面积比为3:2:2:3的同分异构体的结构简式为
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:认识化学科学、化学与STSE、有机化学基础、化学反应原理、物质结构与性质、常见无机物及其应用、化学实验基础
试卷题型(共 11题)
题型
数量
单选题
7
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 胶体的定义及分类 化学科学对人类文明发展的意义 高分子材料 金属与合金性能比较 | |
| 2 | 0.65 | 常见官能团名称、组成及结构 酯的化学性质 多官能团有机物的结构与性质 | |
| 3 | 0.65 | 吸热反应和放热反应 共价键的形成及主要类型 晶胞的有关计算 | |
| 4 | 0.65 | 微粒半径大小的比较方法 根据原子结构进行元素种类推断 电离能变化规律 利用杂化轨道理论判断化学键杂化类型 | |
| 5 | 0.65 | 铵根离子的检验 硫酸根离子的检验 Fe3+的检验 探究物质组成或测量物质的含量 | |
| 6 | 0.4 | 电解池电极反应式及化学方程式的书写与判断 | |
| 7 | 0.4 | 盐溶液中离子浓度大小的比较 溶度积常数相关计算 | |
| 二、解答题 | |||
| 8 | 0.65 | 酸碱中和滴定原理的应用 仪器使用与实验安全 物质含量的测定 | 实验探究题 |
| 9 | 0.65 | 化学平衡常数的有关计算 轨道表示式 常见无机物的制备 探究物质组成或测量物质的含量 | 工业流程题 |
| 10 | 0.4 | 化学平衡的移动及其影响因素 化学平衡的有关计算 化学平衡图像分析 化学平衡常数的有关计算 | 原理综合题 |
| 11 | 0.65 | 有机反应类型 根据要求书写同分异构体 同分异构体的数目的确定 有机推断综合考查 | 有机推断题 |







