利用热镀锌厂在生产过程中产生的副产品锌灰(主要成分为ZnO、 及少量
及少量 、CuO、PbO等)为原料制备氧化锌或皓矾(
、CuO、PbO等)为原料制备氧化锌或皓矾( )工艺流程如下:
)工艺流程如下: 、
、 进入溶液;
进入溶液;
②25℃时, ,
, ;
;
③深度除杂标准:溶液中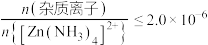 ;
;
④有机萃取剂(用HR表示)可萃取出 ,其萃取原反应为:
,其萃取原反应为: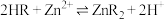 。
。
(1)浸渣中含有的物质包括PbOCl、______ 。
(2)除砷时, 转化为
转化为 沉淀,写出该反应的离子方程式
沉淀,写出该反应的离子方程式______ 。
(3)若深度除铜所得滤液中 的浓度为0.2
的浓度为0.2 ,则溶液中
,则溶液中 (不考虑水解)浓度至少为
(不考虑水解)浓度至少为______  ,才能达到深度除杂标准。
,才能达到深度除杂标准。
(4)反萃取加入的X最佳物质为______ 。
(5)“沉锌”过程获得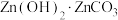 ,离子方程式为
,离子方程式为______ 。
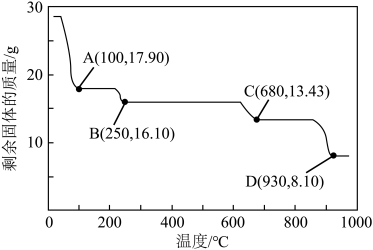
(6)获取皓矾的一系列操作包括______ 、过滤、洗涤、干燥。取28.7g产品加热至不同温度,剩余固体的质量变化如图所示。已知B→D的过程中产生两种气体,分析数据,写出该过程的化学方程式______ 。
 及少量
及少量 、CuO、PbO等)为原料制备氧化锌或皓矾(
、CuO、PbO等)为原料制备氧化锌或皓矾( )工艺流程如下:
)工艺流程如下:
 、
、 进入溶液;
进入溶液;②25℃时,
 ,
, ;
;③深度除杂标准:溶液中
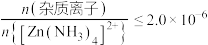 ;
;④有机萃取剂(用HR表示)可萃取出
 ,其萃取原反应为:
,其萃取原反应为: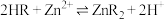 。
。(1)浸渣中含有的物质包括PbOCl、
(2)除砷时,
 转化为
转化为 沉淀,写出该反应的离子方程式
沉淀,写出该反应的离子方程式(3)若深度除铜所得滤液中
 的浓度为0.2
的浓度为0.2 ,则溶液中
,则溶液中 (不考虑水解)浓度至少为
(不考虑水解)浓度至少为 ,才能达到深度除杂标准。
,才能达到深度除杂标准。(4)反萃取加入的X最佳物质为
(5)“沉锌”过程获得
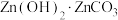 ,离子方程式为
,离子方程式为(6)获取皓矾的一系列操作包括
更新时间:2024-05-25 14:19:29
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】I.某小组对Cu与浓HNO3的反应进行研究。记录如下:
(1)Cu与浓HNO3反应的化学方程式是___________ 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(2)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是___________ 。
(3)乙认为溶液呈绿色是由溶解的NO2引起的。
进行实验2:先将NO2通入B中,再鼓入N2,结果证实假设成立。
则以上两步操作对应的现象分别是___________ 、___________ 。
(4)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O= HNO3+HNO2;
HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii. 能与Cu2+反应:Cu2+(蓝色)+4
能与Cu2+反应:Cu2+(蓝色)+4

 (绿色)
(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了 使溶液呈绿色。
使溶液呈绿色。
丙进行如下实验:
①亚硝酸分解的化学方程式是___________ 。
②请用平衡原理解释加入H2SO4后绿色溶液变蓝的原因:___________ 。
(5)根据实验得出结论:实验1中溶液A呈绿色的主要原因是___________ 。请依据实验现象阐述理由:___________ 。
| 装置 | 药品 | 现象 | |
| 实验1 |  | 0.64gCu片(0.01mol) Cu片和20.0 mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶 液B,…… |
(1)Cu与浓HNO3反应的化学方程式是
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(2)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是
(3)乙认为溶液呈绿色是由溶解的NO2引起的。
进行实验2:先将NO2通入B中,再鼓入N2,结果证实假设成立。
则以上两步操作对应的现象分别是
(4)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O= HNO3+HNO2;
HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.
 能与Cu2+反应:Cu2+(蓝色)+4
能与Cu2+反应:Cu2+(蓝色)+4

 (绿色)
(绿色)据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了
 使溶液呈绿色。
使溶液呈绿色。丙进行如下实验:
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01molCu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| iii.加水稀释 | 溶液立即变蓝 | |
| 实验4 | i.向20.0mL0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
②请用平衡原理解释加入H2SO4后绿色溶液变蓝的原因:
(5)根据实验得出结论:实验1中溶液A呈绿色的主要原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】某油脂厂废弃的油脂加氢镍催化剂主要含金属 、
、 、
、 及其氧化物,还有少量其他不溶性物质。采用如下所示工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下所示工艺流程回收其中的镍制备硫酸镍晶体 :
:

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中 的两个作用分别是
的两个作用分别是_______ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式:_______ 。
(2)“滤液②”中含有的金属离子是_______ 。
(3)“转化”中可替代 的物质是
的物质是_______ 。若工艺流程改为先“调 ”后“转化”,即
”后“转化”,即

“滤液③”中可能含有的杂质离子为_______ 。
(4)利用上述表格数据,计算 的
的
_______ (列出计算式)。如果“转化”后的溶液中 浓度为
浓度为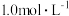 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是_______ 。
(5)硫酸镍在强碱溶液中用 氧化,可沉淀出用作镍镉电池正极材料的
氧化,可沉淀出用作镍镉电池正极材料的 。写出该反应的离子方程式:
。写出该反应的离子方程式:_______ 。
 、
、 、
、 及其氧化物,还有少量其他不溶性物质。采用如下所示工艺流程回收其中的镍制备硫酸镍晶体
及其氧化物,还有少量其他不溶性物质。采用如下所示工艺流程回收其中的镍制备硫酸镍晶体 :
:
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时(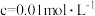 )的 )的 | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(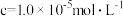 )的 )的 | 8.8 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中
 的两个作用分别是
的两个作用分别是(2)“滤液②”中含有的金属离子是
(3)“转化”中可替代
 的物质是
的物质是 ”后“转化”,即
”后“转化”,即
“滤液③”中可能含有的杂质离子为
(4)利用上述表格数据,计算
 的
的
 浓度为
浓度为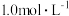 ,则“调
,则“调 ”应控制的
”应控制的 范围是
范围是(5)硫酸镍在强碱溶液中用
 氧化,可沉淀出用作镍镉电池正极材料的
氧化,可沉淀出用作镍镉电池正极材料的 。写出该反应的离子方程式:
。写出该反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】金属钼具有高强度、高熔点、耐腐蚀、耐研磨等优点,主要作为钢的添加剂。工业上常用钼精矿(主要成分是MoS2,含有少量CaO、SiO2等)制备金属钼,其中用氧化焙烧法提取金属钼的工艺流程如图所示。

已知:①焙烧后可得MoO3、钼酸钙(CaMoO4)和SiO2的混合物;其中,MoO3微溶于水和冷的稀酸,可溶于氨水,高温易升华;CaMoO4不溶于氨水。
②钼酸(H2MoO4)微溶于冷水,能溶于热水。
回答下列问题:
(1)在周期表中,钼位于第五周期且与铬同族。基态钼原子的价电子排布式为_______ ,它的核外电子有_______ 种不同的空间运动状态。
(2)若焙烧的主要产物为MoO3,则主要反应的化学方程式为_______ ;钼的提取率与焙烧的温度关系曲线如图所示,造成曲线变化的可能原因是_______ 。

(3)其他条件一定时,钼的浸出率与氨浸温度和时间如图,“氨浸”条件宜采用_______ ,涉及的离子方程式为_______ 。

(4)“沉淀转溶”过程所得滤渣②的成分为_______ (填化学式)。
(5)钼电池未来有可能代替锂电池,成为动力电池的霸主。镁钼蓄电池的总反应为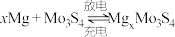 ,则该电池放电时的正极反应为
,则该电池放电时的正极反应为_______ 。
(6)金属钼的晶胞结构如图所示,若晶胞中两个钼原子的最小核间距为anm,则钼晶体的密度为_______ g·cm-3(用NA表示阿伏加德罗常数的值)。


已知:①焙烧后可得MoO3、钼酸钙(CaMoO4)和SiO2的混合物;其中,MoO3微溶于水和冷的稀酸,可溶于氨水,高温易升华;CaMoO4不溶于氨水。
②钼酸(H2MoO4)微溶于冷水,能溶于热水。
回答下列问题:
(1)在周期表中,钼位于第五周期且与铬同族。基态钼原子的价电子排布式为
(2)若焙烧的主要产物为MoO3,则主要反应的化学方程式为

(3)其他条件一定时,钼的浸出率与氨浸温度和时间如图,“氨浸”条件宜采用

(4)“沉淀转溶”过程所得滤渣②的成分为
(5)钼电池未来有可能代替锂电池,成为动力电池的霸主。镁钼蓄电池的总反应为
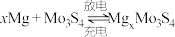 ,则该电池放电时的正极反应为
,则该电池放电时的正极反应为(6)金属钼的晶胞结构如图所示,若晶胞中两个钼原子的最小核间距为anm,则钼晶体的密度为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】硝酸镍可用于电镀镍铬合金、蓄电池、金属表面处理剂。某兴趣小组用含镍废催化剂(主要含有Ni,还含有Al、Al2O3、CuO、SiO2及有机物)制备Ni(NO3)2,其工艺流程如下:
回答下列问题:
(1)能溶解在石油醚中的物质是___________ 。
(2)“过滤1”中用到的硅酸盐仪器有玻璃棒、___________ ,过滤时玻璃棒的作用是___________ 。
(3)滤液2的主要成分是___________ (填化学式)。
(4)“酸浸”时,有同学提出用稀硫酸代替稀硝酸更合理,理由是___________ 。Ni与稀硝酸反应时,氧化剂与还原剂的物质的量之比为___________ 。
(5)常温下,“调pH”时,溶液的pH最小为___________ (离子浓度小于或等于1.0×10-5mol·L-l时认为沉淀完全,lg22=1.34,保留小数点后2位)。
(6)“一系列步骤”包括再次加入稍过量的NaOH溶液、过滤、向滤渣中加入稀硝酸、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。“再次加入稍过量的NaOH溶液、过滤、向滤渣中加入稀硝酸”的目的是___________ 。
(7)用沉淀法测定产品Ni(NO3)2的纯度。
取ag粗品溶于水,加入稍过量的NaOH溶液,过滤、洗涤、干燥,得到bg沉淀。则粗品中Ni(NO3)2的纯度是___________ (用含a、b的代数式表示)。

| 化学式 | Cu(OH)2 | Al(OH)3 | Ni(OH)2 |
| Ksp近似值 | 2.2×10-20 | 1.0×10-34 | 1.0×10-15 |
(1)能溶解在石油醚中的物质是
(2)“过滤1”中用到的硅酸盐仪器有玻璃棒、
(3)滤液2的主要成分是
(4)“酸浸”时,有同学提出用稀硫酸代替稀硝酸更合理,理由是
(5)常温下,“调pH”时,溶液的pH最小为
(6)“一系列步骤”包括再次加入稍过量的NaOH溶液、过滤、向滤渣中加入稀硝酸、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。“再次加入稍过量的NaOH溶液、过滤、向滤渣中加入稀硝酸”的目的是
(7)用沉淀法测定产品Ni(NO3)2的纯度。
取ag粗品溶于水,加入稍过量的NaOH溶液,过滤、洗涤、干燥,得到bg沉淀。则粗品中Ni(NO3)2的纯度是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
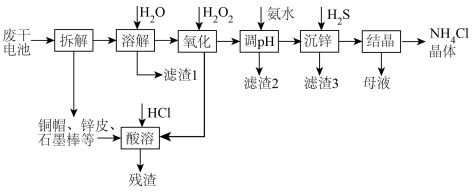
【推荐2】下图是一种处理废锌锰干电池的流程,电池内除铜帽、锌皮(含少量铁)、石墨棒外,还含有MnOOH、 、
、 、C及有机物等糊状填充物。
、C及有机物等糊状填充物。
已知: ,
,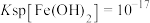 ,
,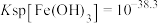
 ,
, ,
,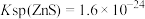
请回答下列问题:
(1)“溶解”过程中为了提高浸出效率,可以采取的措施有_______ (写一条即可)
(2)对于以上流程,下列说法正确的是:_______。
(3)常温下,“调pH”时,应控制溶液pH的范围是_______ 。(已知:“溶解”后的溶液中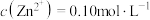 ,一般某离子浓度
,一般某离子浓度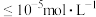 时认为沉淀完全。忽略滴加
时认为沉淀完全。忽略滴加 、氨水后溶液的体积变化。)
、氨水后溶液的体积变化。)
(4)写出“沉锌”的离子方程式_______ ,并计算该反应的平衡常数_______ 。
 、
、 、C及有机物等糊状填充物。
、C及有机物等糊状填充物。
已知:
 ,
,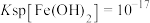 ,
,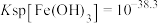
 ,
, ,
,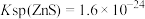
请回答下列问题:
(1)“溶解”过程中为了提高浸出效率,可以采取的措施有
(2)对于以上流程,下列说法正确的是:_______。
A.由 溶液得到 溶液得到 晶体的方式为蒸发结晶 晶体的方式为蒸发结晶 |
B.“调pH”生成“滤渣2”的离子方程式为: |
| C.“酸溶”时的反应速率比同浓度盐酸与同规格纯锌片反应的速率快 |
D.将“滤渣1”在空气中灼烧可能有 生成 生成 |
(3)常温下,“调pH”时,应控制溶液pH的范围是
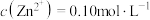 ,一般某离子浓度
,一般某离子浓度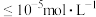 时认为沉淀完全。忽略滴加
时认为沉淀完全。忽略滴加 、氨水后溶液的体积变化。)
、氨水后溶液的体积变化。)(4)写出“沉锌”的离子方程式
您最近一年使用:0次
【推荐3】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7∙10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、Al2O3、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如图所示。

回答下列问题:
(1)硼与浓的氢氧化钠溶液在加热条件下有类似硅的反应,反应后硼元素以 形式存在于溶液中,写出硼与浓的氢氧化钠溶液反应的化学方程式:
形式存在于溶液中,写出硼与浓的氢氧化钠溶液反应的化学方程式:_______ ;
(2)Na2B4O7易溶于水,较易发生水解:B4O +7H2O⇌4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。则滤渣I中除CaSO4外还有
+7H2O⇌4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。则滤渣I中除CaSO4外还有___ (填化学式)。
(3)工艺流程中“调pH"应不低于___ (已知:常温下,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33;当溶液中离子浓度小于等于1×10-6mol∙L-1时认为该离子沉淀完全)。“煮沸"的目的是__ 。
(4)滤渣II中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式:__ 。
(5)该工艺流程中包含多次过滤操作,实验室中过滤后洗涤沉淀的操作为___ 。
(6)我国科学家研发出以惰性电极材料电解NaBO2的碱性溶液制备NaBH4的方法。写出阴极的电极反应式:_______ 。

回答下列问题:
(1)硼与浓的氢氧化钠溶液在加热条件下有类似硅的反应,反应后硼元素以
 形式存在于溶液中,写出硼与浓的氢氧化钠溶液反应的化学方程式:
形式存在于溶液中,写出硼与浓的氢氧化钠溶液反应的化学方程式:(2)Na2B4O7易溶于水,较易发生水解:B4O
 +7H2O⇌4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。则滤渣I中除CaSO4外还有
+7H2O⇌4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。则滤渣I中除CaSO4外还有(3)工艺流程中“调pH"应不低于
(4)滤渣II中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式:
(5)该工艺流程中包含多次过滤操作,实验室中过滤后洗涤沉淀的操作为
(6)我国科学家研发出以惰性电极材料电解NaBO2的碱性溶液制备NaBH4的方法。写出阴极的电极反应式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】海水是一个巨大的资源宝库,工业上提取部分资源采用以下工艺流程。
(Ⅰ)碘的提取
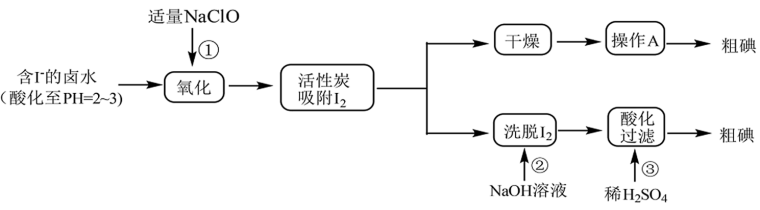
已知: 在碱性溶液中反应生成
在碱性溶液中反应生成 和
和
(1)实际工业生产中用活性炭吸附 相较于传统的
相较于传统的 萃取然后蒸馏提取
萃取然后蒸馏提取 的方式有哪些优点
的方式有哪些优点_______ 。
(2)反应①的离子方程式为_______ 。
(3)根据 的性质,操作A为
的性质,操作A为_______ 。
(4)反应②的离子方程式为_______ 。
(Ⅱ)卤块的主要成分是 ,此外还含
,此外还含 、
、 和
和 等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。

若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
 氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为
氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为 ,生成
,生成 沉淀除去。
沉淀除去。
表2原料价格表
(5)步骤2加入的试剂X,最佳选择是_______ ,目的是_______ 。
(6)沉淀物1主要成分是_______ 。
(7)通过熔融电解 即可制得Mg,但Al的冶炼需要熔融电解
即可制得Mg,但Al的冶炼需要熔融电解 的原因是
的原因是_______ 。
(Ⅰ)碘的提取

已知:
 在碱性溶液中反应生成
在碱性溶液中反应生成 和
和
(1)实际工业生产中用活性炭吸附
 相较于传统的
相较于传统的 萃取然后蒸馏提取
萃取然后蒸馏提取 的方式有哪些优点
的方式有哪些优点(2)反应①的离子方程式为
(3)根据
 的性质,操作A为
的性质,操作A为(4)反应②的离子方程式为
(Ⅱ)卤块的主要成分是
 ,此外还含
,此外还含 、
、 和
和 等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
 | 2.7 | 3.7 |
 | 7.6 | 9.6 |
 | 8.3 | 9.8 |
 | 9.6 | 11.1 |
 氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为
氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为 ,生成
,生成 沉淀除去。
沉淀除去。表2原料价格表
| 物质 | 价格(元/吨) |
| 漂液(含25.2%NaClO) | 450 |
双氧水(含30% ) ) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
纯碱(含99.5% ) ) | 600 |
(6)沉淀物1主要成分是
(7)通过熔融电解
 即可制得Mg,但Al的冶炼需要熔融电解
即可制得Mg,但Al的冶炼需要熔融电解 的原因是
的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】综合利用炼锌矿渣(主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4)获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如下:
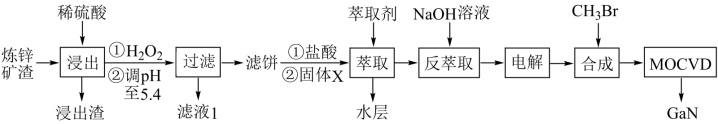
已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH见表1。
表1金属离子浓度及开始沉淀的pH
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表2金属离子的萃取率
(1)ZnFe2O4中Fe的化合价为_______ 。
(2)调pH至5.4的目的是_______ 。
(3)萃取前加入的固体X为_______ ,理由:_______ 。
(4)Ga与Al同主族,化学性质相似。加入NaOH溶液反萃取,发生反应的离子方程式_______ 。
(5)“电解”时,阳极的电极反应式_______ 。
(6)以合成的三甲基镓为原料,使其与NH3发生系列反应得到GaN和另一种产物,该产物为_______ 。
(7)滤液1中残余中Ga3+的浓度为_______ mg·L-1。

已知:①常温下,浸出液中各离子的浓度及其开始形成氢氧化物沉淀的pH见表1。
表1金属离子浓度及开始沉淀的pH
| 金属离子 | 浓度(mol·L-1) | 开始沉淀pH |
| Fe2+ | 1.0×10-3 | 8.0 |
| Fe3+ | 4.0×10-2 | 1.7 |
| Zn2+ | 1.5 | 5.5 |
| Ga3+ | 3.0×10-3 | 3.0 |
②金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表2金属离子的萃取率
| 金属离子 | 萃取率(%) |
| Fe2+ | 0 |
| Fe3+ | 99 |
| Zn2+ | 0 |
| Ga3+ | 97-98.5 |
(1)ZnFe2O4中Fe的化合价为
(2)调pH至5.4的目的是
(3)萃取前加入的固体X为
(4)Ga与Al同主族,化学性质相似。加入NaOH溶液反萃取,发生反应的离子方程式
(5)“电解”时,阳极的电极反应式
(6)以合成的三甲基镓为原料,使其与NH3发生系列反应得到GaN和另一种产物,该产物为
(7)滤液1中残余中Ga3+的浓度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】海洋植物如海带、海藻中含有丰富的碘元素,其中碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如图。
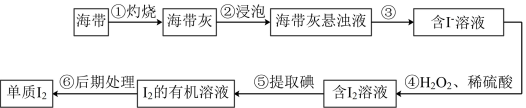
(1)步骤①所用仪器除酒精灯、玻璃棒还有___________ 。
(2)图中操作③名称为___________ ,操作⑤名称为___________ 。
下列试剂中能用于操作⑤的是(填序号)___________ 。
A.酒精 B.四氯化碳 C.氢氧化钠 D.苯
(3)实验室中取20 mL该含碘离子的溶液,用0.2 mol/L的 溶液测量其中
溶液测量其中 的浓度;若消耗
的浓度;若消耗 溶液25 mL,则该溶液中
溶液25 mL,则该溶液中 的含量是
的含量是___________ g⋅L 。
。
(4)流程中后期处理如下:
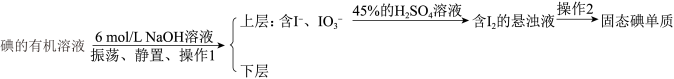
碘的有机溶液到含 的悬浊液的操作名称为
的悬浊液的操作名称为___________ 。 与
与 在45%的
在45%的 溶液中能发生反应,反应的离子方程式为
溶液中能发生反应,反应的离子方程式为___________ 。
(5)某同学欲探究 的性质,进行如图实验:
的性质,进行如图实验:

①该同学推测反应生成了 。设计实施了如下方案,证实了推测。请将方案补充完整:取棕色清液,
。设计实施了如下方案,证实了推测。请将方案补充完整:取棕色清液,___________ 。
②进一步探究发现:棕黑色沉淀中含有CuI.由此推知: 与KI反应过程中,一定发生反应的离子方程式为
与KI反应过程中,一定发生反应的离子方程式为___________ 。

(1)步骤①所用仪器除酒精灯、玻璃棒还有
(2)图中操作③名称为
下列试剂中能用于操作⑤的是(填序号)
A.酒精 B.四氯化碳 C.氢氧化钠 D.苯
(3)实验室中取20 mL该含碘离子的溶液,用0.2 mol/L的
 溶液测量其中
溶液测量其中 的浓度;若消耗
的浓度;若消耗 溶液25 mL,则该溶液中
溶液25 mL,则该溶液中 的含量是
的含量是 。
。(4)流程中后期处理如下:
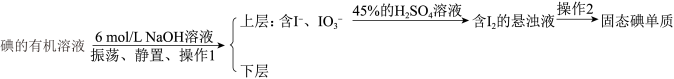
碘的有机溶液到含
 的悬浊液的操作名称为
的悬浊液的操作名称为 与
与 在45%的
在45%的 溶液中能发生反应,反应的离子方程式为
溶液中能发生反应,反应的离子方程式为(5)某同学欲探究
 的性质,进行如图实验:
的性质,进行如图实验:
①该同学推测反应生成了
 。设计实施了如下方案,证实了推测。请将方案补充完整:取棕色清液,
。设计实施了如下方案,证实了推测。请将方案补充完整:取棕色清液,②进一步探究发现:棕黑色沉淀中含有CuI.由此推知:
 与KI反应过程中,一定发生反应的离子方程式为
与KI反应过程中,一定发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:
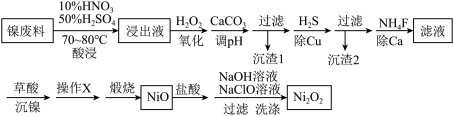
已知0.010mol/L金属离子在不同pH下的沉淀情况如下:
回答下列问题:
(1)加入碳酸钙调pH的目的是____________________________________________ ,“沉渣2”的主要成分是____________ ,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________________________________________________________________ 。
(2)用离子方程式解释加入NH4F“除Ca”的过程_________________ 。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3∶2,此时Ni单质所发生的化学方程式为___________________________________________ 。
(4)“操作X”是__________ 、__________ ,煅烧时产生两种气体的成分是________ 。
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为_________________________________ 。
(6)根据上表数据,计算当0.010mol/LNiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=______ mol/L。

已知0.010mol/L金属离子在不同pH下的沉淀情况如下:
| Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
| 开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
| 完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
(1)加入碳酸钙调pH的目的是
(2)用离子方程式解释加入NH4F“除Ca”的过程
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3∶2,此时Ni单质所发生的化学方程式为
(4)“操作X”是
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为
(6)根据上表数据,计算当0.010mol/LNiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水,不溶于乙醇和稀硫酸;在空气中迅速被氧化成绿色;见光则易分解,变成褐色,下图是实验室制备CuCl的装置:
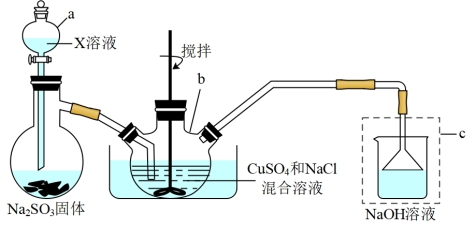
实验步骤:
①将含硫酸铜和氯化钠的水溶液加热至60-70°C,通入二氧化硫气体,直至不再生成氧化亚铜为止。
②过滤得到氯化亚铜,用亚硫酸洗涤,然后用冰醋酸洗涤至洗涤液变成无色,随后将沉淀置于蒸发皿上,用水浴加热蒸发,直到乙酸的气味消失,最后将产物密封保存。
回答下列问题:
(1)仪器a的名称是_______ ;装置c中漏斗的作用为_______ 。
(2)仪器b中发生反应的离子方程式为_______ 。
(3)下列说法正确的是_______。
(4)CuCl晶体用亚硫酸洗涤的目的是_______ 。
(5)氯化亚铜定量分析:
①称取样品0.1000g置于预先放置10mLFeCl3溶液的锥形瓶,不断晃动,待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
②立即用0.1000mol·L-1Ce(SO4)2标准溶液滴定至绿色出现为终点,消耗10.00mLCe(SO4)2溶液,则CuCl的纯度为_______ 。(已知:Fe3++CuCl=Fe2++Cu2++Cl—;Fe2++Ce4+=Fe3++Ce3+)

实验步骤:
①将含硫酸铜和氯化钠的水溶液加热至60-70°C,通入二氧化硫气体,直至不再生成氧化亚铜为止。
②过滤得到氯化亚铜,用亚硫酸洗涤,然后用冰醋酸洗涤至洗涤液变成无色,随后将沉淀置于蒸发皿上,用水浴加热蒸发,直到乙酸的气味消失,最后将产物密封保存。
回答下列问题:
(1)仪器a的名称是
(2)仪器b中发生反应的离子方程式为
(3)下列说法正确的是_______。
| A.X溶液可选用98%浓硫酸 |
| B.搅拌器搅拌的目的是为了加快反应速率 |
| C.装置C中可用Ca(OH)2溶液替代 |
| D.氯化亚铜应保存在棕色细口瓶中 |
(5)氯化亚铜定量分析:
①称取样品0.1000g置于预先放置10mLFeCl3溶液的锥形瓶,不断晃动,待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
②立即用0.1000mol·L-1Ce(SO4)2标准溶液滴定至绿色出现为终点,消耗10.00mLCe(SO4)2溶液,则CuCl的纯度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】由铁铬合金(主要成分Cr、Fe,含少量Co、Ni等)可以制取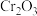 、
、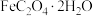 和
和 。实验流程如图:
。实验流程如图:

(1)下列说法正确的是_______。
(2)其他条件相同,实验测得相同时间内铬铁转化率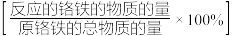 、析出硫酸盐晶体质量随硫酸浓度变化情况如图所示。当硫酸的浓度为
、析出硫酸盐晶体质量随硫酸浓度变化情况如图所示。当硫酸的浓度为 ,铬铁转化率下降的原因:
,铬铁转化率下降的原因:_______ (已知硫酸浓度大于 时铁才会钝化)
时铁才会钝化)

(3)在 的氛围中将
的氛围中将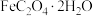 与
与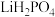 按物质的量之比1∶1混合,360℃条件下反应可获得
按物质的量之比1∶1混合,360℃条件下反应可获得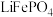 ,同时有CO和
,同时有CO和 生成。写出该反应的化学方程式:
生成。写出该反应的化学方程式:_______ 。
(4)已知:①P507萃取剂密度小于水,P507萃取剂萃取 时萃取率与溶液pH的关系如图所示。
时萃取率与溶液pH的关系如图所示。

②该实验中 在
在 时开始沉淀,
时开始沉淀, 时沉淀完全。
时沉淀完全。 时
时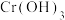 开始溶解。设计由沉铁后的滤液(含
开始溶解。设计由沉铁后的滤液(含 和少量
和少量 )制备
)制备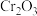 的实验方案,从下列操作正确排序为f→
的实验方案,从下列操作正确排序为f→_______ →a。
a.500℃煅烧
b.向水溶液中滴加NaOH溶液至pH约2.5,过滤
c.向滤液中加入P507萃取剂
d.过滤、洗涤
e.向水溶液中滴加NaOH溶液至pH在8~12之间
f.向水溶液中滴加稍过量的
g.充分振荡、静置、分液
(5)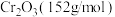 纯度的测定:称取ag制得的样品,先将其溶于浓的强碱溶液中,再配制成100mL溶液,移取20.00mL溶液于锥形瓶中,加入
纯度的测定:称取ag制得的样品,先将其溶于浓的强碱溶液中,再配制成100mL溶液,移取20.00mL溶液于锥形瓶中,加入 ,充分反应,然后加入过量的稀
,充分反应,然后加入过量的稀 至溶液呈强酸性,此时铬以
至溶液呈强酸性,此时铬以 形式存在,充分加热煮沸后,冷却至室温,加入过量KI溶液,塞紧塞子,摇匀,静置,加入2滴淀粉溶液,用碱式滴定管盛装
形式存在,充分加热煮沸后,冷却至室温,加入过量KI溶液,塞紧塞子,摇匀,静置,加入2滴淀粉溶液,用碱式滴定管盛装 硫代硫酸钠标准溶液,滴定至终点。重复滴定多次,平均消耗标准溶液体积为VmL。
硫代硫酸钠标准溶液,滴定至终点。重复滴定多次,平均消耗标准溶液体积为VmL。
已知: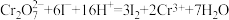 ;
; 。
。
计算样品中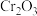 的纯度为
的纯度为_______ (用含a、V和c的代数式表示)。
(6)铬是人体内微量元素之一,是重要的血糖调节剂。
①基态 原子的价层电子排布图为
原子的价层电子排布图为_______ ,第一电离能N_______ O(填“<”或“=”或“>”),键角:
_______  (填“<”或“=”或“>”)。
(填“<”或“=”或“>”)。
②铬的一种氮化物晶体立方晶胞结构如图所示。A点分数坐标为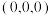 ,则B点分数坐标为
,则B点分数坐标为_______ 。已知晶胞参数为dnm, 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为_______  (用含d和
(用含d和 的代数式表示)。
的代数式表示)。

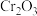 、
、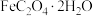 和
和 。实验流程如图:
。实验流程如图:
(1)下列说法正确的是_______。
| A.“酸溶时一次性加入硫酸优于分批次加入 | B.“酸溶”时需要保持强制通风 |
C.加入稍过量的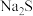 以保证钴镍能被完全除尽 以保证钴镍能被完全除尽 | D.“沉铁”操作得到的滤液中含有 |
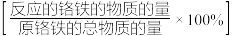 、析出硫酸盐晶体质量随硫酸浓度变化情况如图所示。当硫酸的浓度为
、析出硫酸盐晶体质量随硫酸浓度变化情况如图所示。当硫酸的浓度为 ,铬铁转化率下降的原因:
,铬铁转化率下降的原因: 时铁才会钝化)
时铁才会钝化)
(3)在
 的氛围中将
的氛围中将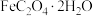 与
与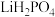 按物质的量之比1∶1混合,360℃条件下反应可获得
按物质的量之比1∶1混合,360℃条件下反应可获得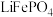 ,同时有CO和
,同时有CO和 生成。写出该反应的化学方程式:
生成。写出该反应的化学方程式:(4)已知:①P507萃取剂密度小于水,P507萃取剂萃取
 时萃取率与溶液pH的关系如图所示。
时萃取率与溶液pH的关系如图所示。
②该实验中
 在
在 时开始沉淀,
时开始沉淀, 时沉淀完全。
时沉淀完全。 时
时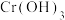 开始溶解。设计由沉铁后的滤液(含
开始溶解。设计由沉铁后的滤液(含 和少量
和少量 )制备
)制备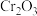 的实验方案,从下列操作正确排序为f→
的实验方案,从下列操作正确排序为f→a.500℃煅烧
b.向水溶液中滴加NaOH溶液至pH约2.5,过滤
c.向滤液中加入P507萃取剂
d.过滤、洗涤
e.向水溶液中滴加NaOH溶液至pH在8~12之间
f.向水溶液中滴加稍过量的

g.充分振荡、静置、分液
(5)
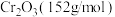 纯度的测定:称取ag制得的样品,先将其溶于浓的强碱溶液中,再配制成100mL溶液,移取20.00mL溶液于锥形瓶中,加入
纯度的测定:称取ag制得的样品,先将其溶于浓的强碱溶液中,再配制成100mL溶液,移取20.00mL溶液于锥形瓶中,加入 ,充分反应,然后加入过量的稀
,充分反应,然后加入过量的稀 至溶液呈强酸性,此时铬以
至溶液呈强酸性,此时铬以 形式存在,充分加热煮沸后,冷却至室温,加入过量KI溶液,塞紧塞子,摇匀,静置,加入2滴淀粉溶液,用碱式滴定管盛装
形式存在,充分加热煮沸后,冷却至室温,加入过量KI溶液,塞紧塞子,摇匀,静置,加入2滴淀粉溶液,用碱式滴定管盛装 硫代硫酸钠标准溶液,滴定至终点。重复滴定多次,平均消耗标准溶液体积为VmL。
硫代硫酸钠标准溶液,滴定至终点。重复滴定多次,平均消耗标准溶液体积为VmL。已知:
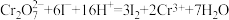 ;
; 。
。计算样品中
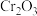 的纯度为
的纯度为(6)铬是人体内微量元素之一,是重要的血糖调节剂。
①基态
 原子的价层电子排布图为
原子的价层电子排布图为
 (填“<”或“=”或“>”)。
(填“<”或“=”或“>”)。②铬的一种氮化物晶体立方晶胞结构如图所示。A点分数坐标为
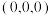 ,则B点分数坐标为
,则B点分数坐标为 为阿伏加德罗常数的值,则晶体密度为
为阿伏加德罗常数的值,则晶体密度为 (用含d和
(用含d和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



