在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g) 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
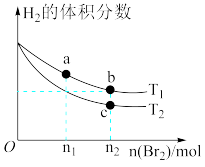
 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
| A.若b、c点的平衡常数分别为K1、K2,则K1>K2 |
| B.a、b两点的反应速率:b>a |
| C.为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法 |
| D.若平衡后保持温度不变,压缩容器体积平衡一定不移动 |
更新时间:2016-12-09 07:46:01
|
【知识点】 化学平衡的移动及其影响因素
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】向恒温恒容的密闭容器中加入固体M(足量),发生反应:反应I为 、反应II为
、反应II为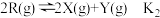 。反应经过t min达到平衡,此时测得
。反应经过t min达到平衡,此时测得 ,
,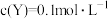 。下列说法不正确的是
。下列说法不正确的是
 、反应II为
、反应II为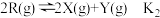 。反应经过t min达到平衡,此时测得
。反应经过t min达到平衡,此时测得 ,
,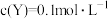 。下列说法不正确的是
。下列说法不正确的是A.反应I中,0~t min的平均反应速率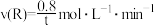 |
B.反应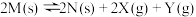 的平衡常数 的平衡常数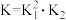 |
C.X(g)的体积分数为 |
| D.tmin后再加入一定量的M(s)和R(g),反应I的逆反应速率增大,平衡逆向移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】在一定条件下,[Zn(CN)4]2-与甲醛发生如下反应:[Zn(CN)4]2-+4HCHO+4H2O=[Zn(OH)4]2-+4HOCH2CN
已知:ⅰ. HCN为剧毒、易挥发的气体,其水溶液有极弱的酸性
ⅱ. Zn2++4CN- [Zn(CN)4]2- K1;Zn2++4OH-
[Zn(CN)4]2- K1;Zn2++4OH- [Zn(OH)4]2- K2
[Zn(OH)4]2- K2
下列说法不正确 的是
已知:ⅰ. HCN为剧毒、易挥发的气体,其水溶液有极弱的酸性
ⅱ. Zn2++4CN-
 [Zn(CN)4]2- K1;Zn2++4OH-
[Zn(CN)4]2- K1;Zn2++4OH- [Zn(OH)4]2- K2
[Zn(OH)4]2- K2下列说法
| A.反应前后Zn2+均提供4个空轨道容纳4对孤电子对 |
| B.HOCH2CN的氰基由CN-与甲醛发生反应而来 |
| C.依据上述[Zn(CN)4]2-与甲醛的反应可以证明:K1<K2 |
| D.上述反应必须在碱性条件下进行,既保证安全性,也能提高反应物转化率 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】一定条件下合成乙烯:6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
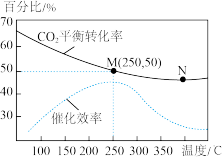
 CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是:
| A.生成乙烯的速率:v(M)有可能小于v(N) |
| B.平衡常数:KM>KN |
| C.当温度高于250℃,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 |
| D.若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
您最近一年使用:0次



