根据我国目前汽车业发展速度,预计2020年汽车保有量超过2亿辆,中国已成为全球最大的汽车市场。因此,如何有效处理汽车排放的尾气,是需要进行研究的一项重要课题。目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表____________ (表中不要留空格)。
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
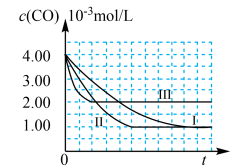
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为______ 。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________ (填“增大”、“减小”、“无影响”)。
 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表
| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g | |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4. 00×10-3 | 80 | |
| Ⅱ | ① | ② | ③ | ④ | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | ⑤ | ⑥ | 80 | |

(2)计算第Ⅰ组实验中,达平衡时NO的浓度为
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率
13-14高一下·安徽安庆·期末 查看更多[2]
更新时间:2016-12-09 08:15:26
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如图:
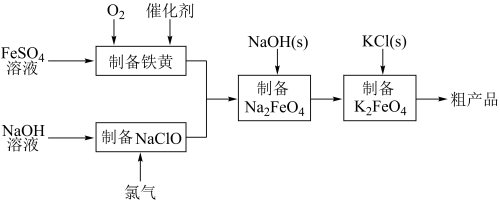
回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式______ 。
(2)实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择______ ;pH大于4.5时铁黄产率降低的主要原因可能是______ 。

(3)用高铁酸钾处理水时,不仅能消毒杀菌,还能将水体中的NH3、CN-转化成CO2、N2等无毒的物质,生成的氢氧化铁胶体粒子还能吸附水中悬浮杂质。试写出高铁酸钾处理含CN-废水时除去CN-的离子方程式______ 。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10-38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=______ mol·L-1。
(5)K2FeO4可作锌铁碱性高能电池的正极材料,电池反应原理:2K2FeO4+3Zn+8H2O 2Fe(OH)3+3Zn(OH)2+4KOH。充电时阴极的电极反应为
2Fe(OH)3+3Zn(OH)2+4KOH。充电时阴极的电极反应为______ 。

回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式
(2)实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择

(3)用高铁酸钾处理水时,不仅能消毒杀菌,还能将水体中的NH3、CN-转化成CO2、N2等无毒的物质,生成的氢氧化铁胶体粒子还能吸附水中悬浮杂质。试写出高铁酸钾处理含CN-废水时除去CN-的离子方程式
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10-38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)=
(5)K2FeO4可作锌铁碱性高能电池的正极材料,电池反应原理:2K2FeO4+3Zn+8H2O
 2Fe(OH)3+3Zn(OH)2+4KOH。充电时阴极的电极反应为
2Fe(OH)3+3Zn(OH)2+4KOH。充电时阴极的电极反应为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某同学在实验室研究化学反应快慢的影响因素。
(1)研究催化剂对化学反应快慢的影响,实验步骤如下:
I.向3支大小相同的试管a、b、c中各加入2mL5%H2O2溶液;
II.向试管a中加入少量MnO2粉末,向试管b中滴加1~2滴1mol•L-1FeCl3溶液。实验后,得出结论:MnO2与FeCl3均能加快H2O2的分解,且前者的催化效率更高。
①步骤I中分别向3支试管中加入相同体积的溶液的目的是___ 。
②设计试管c的目的是___ 。
③若继续用上述实验药品研究温度对H2O2分解快慢的影响,为了便于观察,选择的催化剂是___ ;原因是___ 。
(2)现提供下列实验用品,研究化学反应快慢的影响因素。实验仪器:试管、烧杯、量筒、天平、秒表、酒精灯实验药品:铝片、铝粉、0.5mol·L-1盐酸、5mol·L-1盐酸、蒸馏水。
①利用所提供实验用品,可研究的化学反应快慢的影响因素有温度、___ (写两个),通过___ (实验现象)判断反应的快慢。
②设计实验探究温度对化学反应快慢的影响,写出实验步骤(实验仪器和药品任选):___ 。
(1)研究催化剂对化学反应快慢的影响,实验步骤如下:
I.向3支大小相同的试管a、b、c中各加入2mL5%H2O2溶液;
II.向试管a中加入少量MnO2粉末,向试管b中滴加1~2滴1mol•L-1FeCl3溶液。实验后,得出结论:MnO2与FeCl3均能加快H2O2的分解,且前者的催化效率更高。
①步骤I中分别向3支试管中加入相同体积的溶液的目的是
②设计试管c的目的是
③若继续用上述实验药品研究温度对H2O2分解快慢的影响,为了便于观察,选择的催化剂是
(2)现提供下列实验用品,研究化学反应快慢的影响因素。实验仪器:试管、烧杯、量筒、天平、秒表、酒精灯实验药品:铝片、铝粉、0.5mol·L-1盐酸、5mol·L-1盐酸、蒸馏水。
①利用所提供实验用品,可研究的化学反应快慢的影响因素有温度、
②设计实验探究温度对化学反应快慢的影响,写出实验步骤(实验仪器和药品任选):
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】由废铅蓄电池的铅膏采用氯盐法制备PbCl2的工艺流程如图:
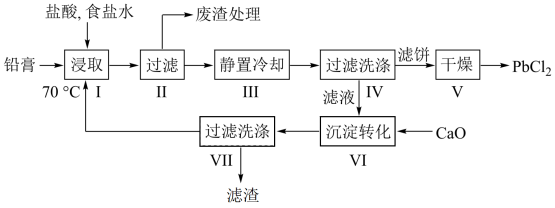
已知:①铅膏的组成如表:
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
回答下列问题:
(1)铅膏“浸取”时浓盐酸与水的配比(浓盐酸和水的体积比)及氯化钠的浓度均对铅浸取率有较大影响(如图所示):
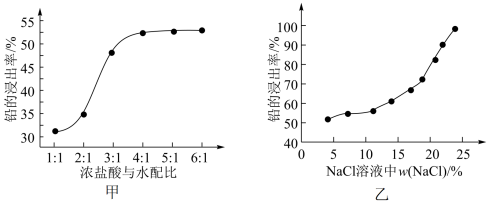
①由图甲确定适宜的配比为_______ 。
②已知70 °C时,NaCl的溶解度为37.8 g,由图乙可知铅的浸出率与NaCl质量分数的关系是_______ ,工业上采用质量分数约为24%的食盐水,不能采用无限制提高w(NaCl)来提高铅的浸出率,其原因是_______ 。
③提高铅的浸出率除浓盐酸与水的配比和w(NaC)外,还可采取的措施有_______ (至少写2种)。
(2)步骤Ⅵ加入CaCl2的目的是_______ .步骤Ⅶ滤液中溶质的主要成分为_______ 。
(3)“浸取”时会发生一系列反应。
①硫酸铅溶于氯化钠生成PbCl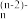 的离子方程式为
的离子方程式为_______ 。
②产生氯气的化学方程式为_______ 。

已知:①铅膏的组成如表:
| 物相 | PbO | PbO2 | PbSO4 | Pb | 总铅 |
| 质量分数/% | 15.89 | 4.86 | 33.74 | 34.03 | 76.05 |
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
回答下列问题:
(1)铅膏“浸取”时浓盐酸与水的配比(浓盐酸和水的体积比)及氯化钠的浓度均对铅浸取率有较大影响(如图所示):

①由图甲确定适宜的配比为
②已知70 °C时,NaCl的溶解度为37.8 g,由图乙可知铅的浸出率与NaCl质量分数的关系是
③提高铅的浸出率除浓盐酸与水的配比和w(NaC)外,还可采取的措施有
(2)步骤Ⅵ加入CaCl2的目的是
(3)“浸取”时会发生一系列反应。
①硫酸铅溶于氯化钠生成PbCl
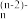 的离子方程式为
的离子方程式为②产生氯气的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】研究发现NOx和SO2是雾霾的主要成分。
I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) 2NO(g) △H=+180 kJ·mol-1
2NO(g) △H=+180 kJ·mol-1
2CO(g)+O2(g) 2CO2(g) △H=-564 kJ·mol-1
2CO2(g) △H=-564 kJ·mol-1
(1)2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=
2CO2(g)+N2(g) △H=___________ ,该反应在___________ 下能自发进行(填“高温”低温”或“任意温度”)
(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程0-5min中NO的物质的量随时间变化如右图所示。
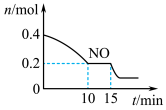
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为P=14MPa,则T℃时该反应的压力平衡常数Kp=___________ MPa-1;平衡后,再向容器中充入NO和CO2各0.1mol,平衡将___________ (填“向左”“向右”或“不")移动
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是___________ (填字母)
A.升温 B.增大CO浓度 C.加入催化剂 D减小容器体积
Ⅱ.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(1)已知:亚硫酸的电离常数为Ka1=2.0×10-2,Ka2=6.0×10-7。则NaSO3溶液呈___________ (填“酸性”、“中性”或“碱性”)
(2)如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为___________ ;若通入的N体积为4.48L(标况下),则另外一个电极通入SO2的质量理论上应为__________ g。

I.NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g)
 2NO(g) △H=+180 kJ·mol-1
2NO(g) △H=+180 kJ·mol-12CO(g)+O2(g)
 2CO2(g) △H=-564 kJ·mol-1
2CO2(g) △H=-564 kJ·mol-1(1)2NO(g)+2CO(g)
 2CO2(g)+N2(g) △H=
2CO2(g)+N2(g) △H=(2)T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程0-5min中NO的物质的量随时间变化如右图所示。

①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为P=14MPa,则T℃时该反应的压力平衡常数Kp=
②15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是
A.升温 B.增大CO浓度 C.加入催化剂 D减小容器体积
Ⅱ.SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
(1)已知:亚硫酸的电离常数为Ka1=2.0×10-2,Ka2=6.0×10-7。则NaSO3溶液呈
(2)如图所示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】如图所示的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。

请回答下列问题:
(1)用电子式表示X的形成过程:____________________ 。
(2)写出D、H、X反应生成A的离子反应方程式:____________________ 。
(3)已知:2H(g)+Y(g)⇌2I(g)△H=-196.6 kJ•mol-1.当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
(4)写出D与K反应生成的正盐溶液中的离子浓度大小关系:__________________ 。
(5)一定温度下,有可逆反应:Ad(g)+bY(g)⇌cE(g)+dX(g)。在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了 ,则前2min内用E表示的平均反应速率为
,则前2min内用E表示的平均反应速率为________ mol•L-1•min-1,平衡时D的浓度为__________ mol•L-1。

请回答下列问题:
(1)用电子式表示X的形成过程:
(2)写出D、H、X反应生成A的离子反应方程式:
(3)已知:2H(g)+Y(g)⇌2I(g)△H=-196.6 kJ•mol-1.当加入4 mol H和2 mol Y后,放出345 kJ的热量时,H的转化率最接近于__________(填字母)。
| A.40% | B.50% | C.80% | D.90% |
(5)一定温度下,有可逆反应:Ad(g)+bY(g)⇌cE(g)+dX(g)。在2L密闭容器中,充入4mol D和5mol Y,有催化剂存在下,2min后反应达到平衡,测得平衡时容器内的压强比反应前增加了
 ,则前2min内用E表示的平均反应速率为
,则前2min内用E表示的平均反应速率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】以CO2为原料合成CH3OH和CH3OCH3是实现碳中和的重要途径之一。有关反应如下:
反应I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49.0kJ·mol-1
反应Ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-25.0kJ·mol-1
反应Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3=+41.2kJ·mol-1
回答下列问题:
(1)反应Ⅳ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH4=___________ 。
(2)在Cu-ZnO-ZrO2催化剂上CO2氢化合成甲醇(反应I)的历程如图所示。

在反应气中加入少量水能够提升甲醇产率的原因是___________ 。
(3)催化条件下,某密闭容器中投入CO2和H2发生反应I和反应Ⅱ,实验测得温度对平衡体系中甲醇、甲醚含量的影响如图所示。
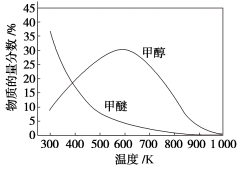
600K以下,甲醇百分含量变化的可能原因是___________ ;一定温度下,增大压强,甲醚的百分含量___________ (填“增大”“减小”或“不变”)。
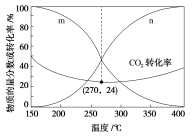
(4)在5MPa下,CO2和H2按物质的量之比为1∶3进行投料,发生反应I和反应Ⅲ,平衡时CO和CH3OH在含碳产物中的物质的量分数及CO2转化率随温度的变化如图所示。图中n代表的物质是___________ ;150~400℃范围内,随温度升高,H2O的平衡产量变化趋势是___________ ;270℃时CH3OH的分压为___________ (保留2位有效数字,下同),反应Ⅲ的平衡常数Kp=___________ (Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
反应I.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49.0kJ·mol-1
反应Ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ΔH2=-25.0kJ·mol-1
反应Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3=+41.2kJ·mol-1
回答下列问题:
(1)反应Ⅳ:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH4=
(2)在Cu-ZnO-ZrO2催化剂上CO2氢化合成甲醇(反应I)的历程如图所示。

在反应气中加入少量水能够提升甲醇产率的原因是
(3)催化条件下,某密闭容器中投入CO2和H2发生反应I和反应Ⅱ,实验测得温度对平衡体系中甲醇、甲醚含量的影响如图所示。

600K以下,甲醇百分含量变化的可能原因是
(4)在5MPa下,CO2和H2按物质的量之比为1∶3进行投料,发生反应I和反应Ⅲ,平衡时CO和CH3OH在含碳产物中的物质的量分数及CO2转化率随温度的变化如图所示。图中n代表的物质是

您最近一年使用:0次



