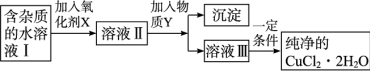
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体,为制取纯净的CuCl2•2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)化学上通常认为残留在溶液中的离子浓度小于1×10﹣5mol/L时,沉淀就达到完全。已知Fe(OH)2的Ksp约为1.0×10﹣15,则a= 。
(2)加入氧化剂的目的是 ,X应选择 。
A.K2Cr2O7 B.浓HNO3 C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)设计实验从溶液Ⅲ中获得纯净的CuCl2•2H2O。简要描述实验步骤 。

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 完全沉淀的pH | 3.2 | a | 6.7 |
请回答下列问题:
(1)化学上通常认为残留在溶液中的离子浓度小于1×10﹣5mol/L时,沉淀就达到完全。已知Fe(OH)2的Ksp约为1.0×10﹣15,则a= 。
(2)加入氧化剂的目的是 ,X应选择 。
A.K2Cr2O7 B.浓HNO3 C.H2O2 D.KMnO4
(3)加入的物质Y是 。
(4)设计实验从溶液Ⅲ中获得纯净的CuCl2•2H2O。简要描述实验步骤 。
更新时间:2016-12-09 10:41:08
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】按要求回答下列问题。
(1)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为___________ 。
(2)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=___________ 。
(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中 c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为___________ 。
(1)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为
(2)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略
 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=(3)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中 c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因_______ 。
(2)亚硝酸的电离平衡常数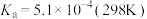 。它的性质和硝酸很类似。
。它的性质和硝酸很类似。
①已知 时,
时, 的
的 ;
; 。向含有
。向含有 碳酸钠的溶液中加入
碳酸钠的溶液中加入 的
的 后,则溶液中
后,则溶液中 、
、 和
和 的离子浓度由大到小是
的离子浓度由大到小是_______ 。
②将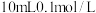 的亚硝酸溶液加入到
的亚硝酸溶液加入到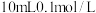 氨水(已知在25℃时,一水合氨的
氨水(已知在25℃时,一水合氨的 )中,最后所得溶液为
)中,最后所得溶液为_______ (填“酸性”、“碱性”或者“中性”)。
(3) 气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在
气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在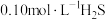 溶液中,通入
溶液中,通入 气体或加入
气体或加入 固体以调节溶液
固体以调节溶液 ,溶液
,溶液 与
与 关系如图所示(忽略溶液体积的变化、
关系如图所示(忽略溶液体积的变化、 的挥发)。
的挥发)。
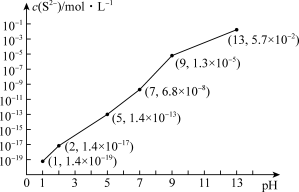
① 时,溶液中的
时,溶液中的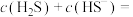
_______  ;
;
②某溶液含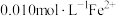 和
和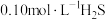 ,当溶液
,当溶液
_______ 时, 开始沉淀。[已知:
开始沉淀。[已知: ]
]
(4) 可用作处理含
可用作处理含 的污水的沉淀剂,已知25℃时,反应
的污水的沉淀剂,已知25℃时,反应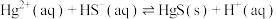 的平衡常数
的平衡常数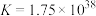 ,
, 的电离平衡常数
的电离平衡常数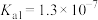 ,
,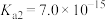 ,则
,则
_______ 。
(1)航天领域中常用
 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱 。用电离方程式表示
。用电离方程式表示 显碱性的原因
显碱性的原因(2)亚硝酸的电离平衡常数
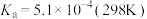 。它的性质和硝酸很类似。
。它的性质和硝酸很类似。①已知
 时,
时, 的
的 ;
; 。向含有
。向含有 碳酸钠的溶液中加入
碳酸钠的溶液中加入 的
的 后,则溶液中
后,则溶液中 、
、 和
和 的离子浓度由大到小是
的离子浓度由大到小是②将
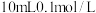 的亚硝酸溶液加入到
的亚硝酸溶液加入到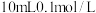 氨水(已知在25℃时,一水合氨的
氨水(已知在25℃时,一水合氨的 )中,最后所得溶液为
)中,最后所得溶液为(3)
 气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在
气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在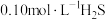 溶液中,通入
溶液中,通入 气体或加入
气体或加入 固体以调节溶液
固体以调节溶液 ,溶液
,溶液 与
与 关系如图所示(忽略溶液体积的变化、
关系如图所示(忽略溶液体积的变化、 的挥发)。
的挥发)。
①
 时,溶液中的
时,溶液中的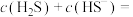
 ;
;②某溶液含
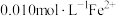 和
和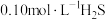 ,当溶液
,当溶液
 开始沉淀。[已知:
开始沉淀。[已知: ]
](4)
 可用作处理含
可用作处理含 的污水的沉淀剂,已知25℃时,反应
的污水的沉淀剂,已知25℃时,反应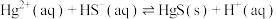 的平衡常数
的平衡常数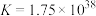 ,
, 的电离平衡常数
的电离平衡常数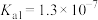 ,
,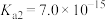 ,则
,则
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】(1)下表是几种常见弱酸的电离平衡常数(25℃)
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是___ ;下列反应不能发生的是___ (填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.CO32-+2HClO=CO2↑+H2O+2ClO-
c.ClO-+CH3COOH=CH3COO-+HClO
d.2ClO-+CO2+H2O=CO32-+2HClO
②碳酸钠溶液中各离子浓度从大到小的顺序依次为:___ 。
(2)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)__ (填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);
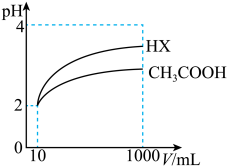
(3)25℃时,向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__ mol·L-1。
②完全沉淀后,溶液的pH=__ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.CO32-+2HClO=CO2↑+H2O+2ClO-
c.ClO-+CH3COOH=CH3COO-+HClO
d.2ClO-+CO2+H2O=CO32-+2HClO
②碳酸钠溶液中各离子浓度从大到小的顺序依次为:
(2)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)

(3)25℃时,向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=
②完全沉淀后,溶液的pH=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】某化工厂生产化工原料的同时会产生多右种废液,其有机废液的主要成分为苯胺、苯酚、苯甲醇(都微溶于水),其无机废液的主要污染成分为Cr2O72-,该工厂处理废液的方法如下:
I.利用物质的酸碱性,从有机废液中分离、回收有机物

(1)物质A为______ ,物质B为______ , 物质C为_________ 。(填写化学式)
(2)若想选用一种试剂仅仅将苯甲酸与其他种物质分开,则应选用的试剂是______ 。
II.利用纳米级Cu2O处理含有Cr2O72-的酸性废水
已知:Cu2O Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
(3)工业上用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________ 。
(4)光照时,会在形成的微电极上发生电极反应,反应原理如下图所示,
对Cu2O的作用提出两种假设:
a. Cu2O作光催化剂;
b. Cu2O与Cr2O72-发生氧化还原反应
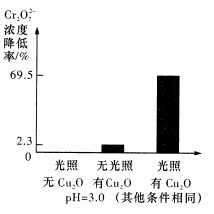
已知:Cu2O的添加量是1.74×10-4mol/L,Cr2O72-的初始浓度是9.60×10-4mol/L;对比实验,反应1.5小时结果如右图所示。结合试剂用量数据和实验结果可得到的结论是假设_____ 成立,写出该过程的正极反应方程式:_______________ 。
(5)溶液的pH对Cr2O72-降解率的影响如下图所示。
由上图可知,pH=3时,Cr2O72-的降解率最大;pH=2与pH=5时,Cr2O72-的降解率低的原因分别可能是___________ 、______________ 。
I.利用物质的酸碱性,从有机废液中分离、回收有机物

(1)物质A为
(2)若想选用一种试剂仅仅将苯甲酸与其他种物质分开,则应选用的试剂是
II.利用纳米级Cu2O处理含有Cr2O72-的酸性废水
已知:Cu2O
 Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀(3)工业上用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为
(4)光照时,会在形成的微电极上发生电极反应,反应原理如下图所示,
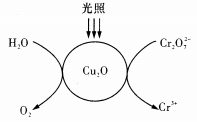
对Cu2O的作用提出两种假设:
a. Cu2O作光催化剂;
b. Cu2O与Cr2O72-发生氧化还原反应
已知:Cu2O的添加量是1.74×10-4mol/L,Cr2O72-的初始浓度是9.60×10-4mol/L;对比实验,反应1.5小时结果如右图所示。结合试剂用量数据和实验结果可得到的结论是假设
(5)溶液的pH对Cr2O72-降解率的影响如下图所示。
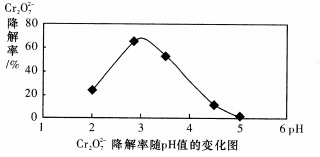
由上图可知,pH=3时,Cr2O72-的降解率最大;pH=2与pH=5时,Cr2O72-的降解率低的原因分别可能是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】硼镁泥是一种工业废料,主要成分是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4∙7H2O的工艺流程如下:

(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________ (填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO‾ + H2O = MnO2↓+ 2H+ + Cl‾,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________ 。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________________ 。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________ 。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤_____________________________ 。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______ ,便得到了MgSO4∙7H2O .

(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO‾ + H2O = MnO2↓+ 2H+ + Cl‾,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾晶体,具体流程如下:
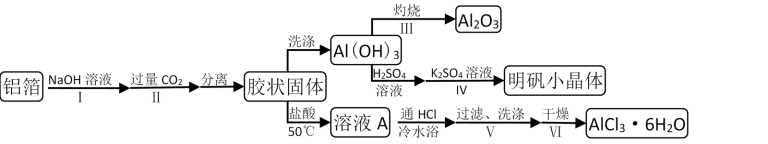
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;请回答:
(1)步骤I中发生的化学方程式______ ;步骤II中发生的离子方程式________
(2)步骤III,下列操作合理的是________ (多选)
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.需用坩埚钳移动灼热的坩埚
D.坩埚取下后放在石棉网上冷却待用
(3)依次加入硫酸溶液、硫酸钾溶液后,步骤IV的操作是__ 、________ 过滤、洗涤、干燥。
(4)步骤V,过滤时,用到的玻璃仪器有________ ;
(5)步骤VI,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是________
A.常温干燥B.低温干燥C.高温干燥

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;请回答:
(1)步骤I中发生的化学方程式
(2)步骤III,下列操作合理的是
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.需用坩埚钳移动灼热的坩埚
D.坩埚取下后放在石棉网上冷却待用
(3)依次加入硫酸溶液、硫酸钾溶液后,步骤IV的操作是
(4)步骤V,过滤时,用到的玻璃仪器有
(5)步骤VI,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是
A.常温干燥B.低温干燥C.高温干燥
您最近一年使用:0次
【推荐1】合理利用工业烟尘,变废为宝,对保护环境具有重要意义。一种铜冶炼烟尘(主要成分是CuO、ZnO、PbO、SiO2、As2O3)为原料回收铜和锌的流程如图。回答下列问题:
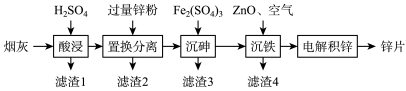
(1)写出能提高“酸浸”浸出率的两个措施____ 。
(2)“滤渣1”的主要成分是____ 。
(3)已知As2O3是一种两性氧化物,“滤渣3”的成分为FeAsO4,则“沉砷”过程中发生的离子反应方程式为____ 。
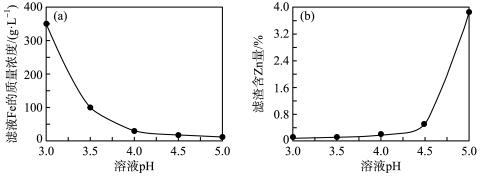
(4)“沉铁”通入过量空气的目的是____ 。
(5)加入ZnO的目的是调节溶液的pH,如图所示是溶液pH与滤液中Fe元素及滤渣中Zn元素的含量关系,则“沉铁”过程中溶液最合适的pH为____ 。
(6)“电解积锌”后的电解液可返回____ 工序继续使用。
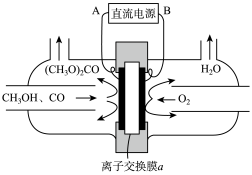
(7)合成碳酸二甲酯的工作原理如图所示。阳极的电极反应式为____ 。

(1)写出能提高“酸浸”浸出率的两个措施
(2)“滤渣1”的主要成分是
(3)已知As2O3是一种两性氧化物,“滤渣3”的成分为FeAsO4,则“沉砷”过程中发生的离子反应方程式为
(4)“沉铁”通入过量空气的目的是
(5)加入ZnO的目的是调节溶液的pH,如图所示是溶液pH与滤液中Fe元素及滤渣中Zn元素的含量关系,则“沉铁”过程中溶液最合适的pH为

(6)“电解积锌”后的电解液可返回
(7)合成碳酸二甲酯的工作原理如图所示。阳极的电极反应式为

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】孔雀石主要成分是Cu2(OH)2CO3,还含少量FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:

(1)步骤I中涉及的主要反应用离子方程式表示为__________ .
(2)步骤Ⅱ中试剂①是_______ (填代号).
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
(3)步骤Ⅲ加入CuO 的目的是_________
(4)步骤Ⅳ获得硫酸铜晶体,需要经过_____________ 冷却结晶、过滤等操作.
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在坩埚中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=______ (计算结果精确到0.1)

(1)步骤I中涉及的主要反应用离子方程式表示为
(2)步骤Ⅱ中试剂①是
A.KMnO4 B.H2O2 C.Fe粉 D.KSCN
(3)步骤Ⅲ加入CuO 的目的是
(4)步骤Ⅳ获得硫酸铜晶体,需要经过
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.41g硫酸铜晶体,在坩埚中加热至质量不再改变时,称量粉末的质量为1.6g.则计算得x=
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】《联合国评估报告》(联合国政府间气候变化专门委员会于2014年发布的第五份评估报告)指出,温室气体累积排放量与全球平均气温上升之间存在正相关关系。
为了缓解全球变暖和气候变化对人类的共同威胁,一项直接而有效的措施是控制和减少大气中温室气体的浓度。近年来,全世界都在努力减少二氧化碳排放。
在2020年第75届联合国大会上,中国提出力争在2030年前实现碳达峰,在2060年前实现碳中和。碳中和的技术战略包括植树造林、捕获和储存二氧化碳、扩大电动汽车等清洁能源的使用、推广可再生能源等。
使用二氧化碳作为化学原料可以通过“把废物变成财富”来增加其价值。在工业纯碱生产中, 、
、 和
和 NaCl为原料。中国著名科学家和化学工程师侯德榜发明了改进索尔维工艺的侯氏制碱法。下图显示了侯氏制碱工艺的简化流程图(Soda指纯碱,crystal指晶体)。
NaCl为原料。中国著名科学家和化学工程师侯德榜发明了改进索尔维工艺的侯氏制碱法。下图显示了侯氏制碱工艺的简化流程图(Soda指纯碱,crystal指晶体)。
(1)写出反应1的化学方程式_______ 。
(2)过程A获得的溶液中,比较离子的数量: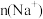 _______
_______ 
(3)侯氏制碱法工艺特点是氯化钠的利用率高。关键是 在室温下的溶解度比
在室温下的溶解度比 的溶解度
的溶解度_______ (填“高”“低”或“相等”,下同),而在低温下,前者比后者_______ 。
(4)金属—二氧化碳电池分别在阳极和阴极中使用金属和 作为活性材料,是一种具有吸引力的装置,同时固定/利用
作为活性材料,是一种具有吸引力的装置,同时固定/利用 和发电。
和发电。
以 电池为例,假设总反应为:
电池为例,假设总反应为: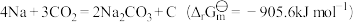 ,阳极在放电期间释放电子,金属Na在充电时沉积。
,阳极在放电期间释放电子,金属Na在充电时沉积。
①写出 电池两极的电极方程式
电池两极的电极方程式_______ 。
②在标准状态下计算该电池的标准电动势_______ 。
(5)二氧化碳被视为人类活动排放的主要温室气体。减少温室气体浓度的重要途径之一是捕获和储存 。假设1mol
。假设1mol (视为理想气体)在273.15K的温度(T)下进行等温膨胀,如果膨胀过程是可逆的,已知膨胀功
(视为理想气体)在273.15K的温度(T)下进行等温膨胀,如果膨胀过程是可逆的,已知膨胀功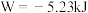 ,熵变
,熵变 。计算该过程的热量
。计算该过程的热量 、焓变
、焓变 和自由能变
和自由能变
_______ 。
为了缓解全球变暖和气候变化对人类的共同威胁,一项直接而有效的措施是控制和减少大气中温室气体的浓度。近年来,全世界都在努力减少二氧化碳排放。
在2020年第75届联合国大会上,中国提出力争在2030年前实现碳达峰,在2060年前实现碳中和。碳中和的技术战略包括植树造林、捕获和储存二氧化碳、扩大电动汽车等清洁能源的使用、推广可再生能源等。
使用二氧化碳作为化学原料可以通过“把废物变成财富”来增加其价值。在工业纯碱生产中,
 、
、 和
和 NaCl为原料。中国著名科学家和化学工程师侯德榜发明了改进索尔维工艺的侯氏制碱法。下图显示了侯氏制碱工艺的简化流程图(Soda指纯碱,crystal指晶体)。
NaCl为原料。中国著名科学家和化学工程师侯德榜发明了改进索尔维工艺的侯氏制碱法。下图显示了侯氏制碱工艺的简化流程图(Soda指纯碱,crystal指晶体)。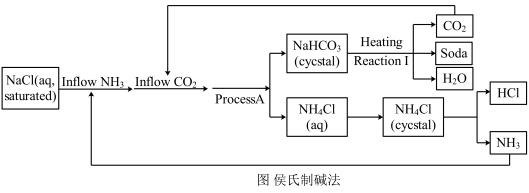
(1)写出反应1的化学方程式
(2)过程A获得的溶液中,比较离子的数量:
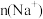 _______
_______ 
| A.多于 | B.少于 | C.等于 | D.无法确定 |
 在室温下的溶解度比
在室温下的溶解度比 的溶解度
的溶解度(4)金属—二氧化碳电池分别在阳极和阴极中使用金属和
 作为活性材料,是一种具有吸引力的装置,同时固定/利用
作为活性材料,是一种具有吸引力的装置,同时固定/利用 和发电。
和发电。以
 电池为例,假设总反应为:
电池为例,假设总反应为: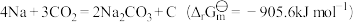 ,阳极在放电期间释放电子,金属Na在充电时沉积。
,阳极在放电期间释放电子,金属Na在充电时沉积。①写出
 电池两极的电极方程式
电池两极的电极方程式②在标准状态下计算该电池的标准电动势
(5)二氧化碳被视为人类活动排放的主要温室气体。减少温室气体浓度的重要途径之一是捕获和储存
 。假设1mol
。假设1mol (视为理想气体)在273.15K的温度(T)下进行等温膨胀,如果膨胀过程是可逆的,已知膨胀功
(视为理想气体)在273.15K的温度(T)下进行等温膨胀,如果膨胀过程是可逆的,已知膨胀功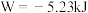 ,熵变
,熵变 。计算该过程的热量
。计算该过程的热量 、焓变
、焓变 和自由能变
和自由能变
您最近一年使用:0次



