元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl→4FeCl2+N2O↑+6HCl+H2O
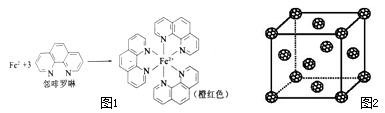
①Fe2+在基态时,核外电子排布式 1 ;
②羟胺中(NH2OH)采用SP3杂化的原子有 2 ;
③Fe2+与邻啡罗啉形成的配合物中,配位数为 3 ;
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,该晶体中含有的化学键类型是 4 ;
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 5 ;
(4)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 6 晶体;
(5)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。现把C60抽象成质点,该晶体的晶胞结构如图2所示,若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为 7
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl→4FeCl2+N2O↑+6HCl+H2O

①Fe2+在基态时,核外电子排布式
②羟胺中(NH2OH)采用SP3杂化的原子有
③Fe2+与邻啡罗啉形成的配合物中,配位数为
(2)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,该晶体中含有的化学键类型是
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+,已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(4)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于
(5)如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C60晶体的空隙中,形成具有良好的超导性的掺杂C60化合物。现把C60抽象成质点,该晶体的晶胞结构如图2所示,若每个四面体空隙填入一个原子,则全部填满C60晶体的四面体空隙后,所形成的掺杂C60化合物的化学式为
更新时间:2016-12-09 11:22:30
|
相似题推荐
【推荐1】Ⅰ.回答下列问题:
(1)写出溴原子的核外电子排布式___________ ,写出Fe的原子结构示意图___________
(2)元素金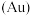 处于周期表中的第六周期,与
处于周期表中的第六周期,与 同族,一种铜金合金晶体的晶胞中
同族,一种铜金合金晶体的晶胞中 原子处于面心,
原子处于面心, 原子处于顶角位置,则该合金中
原子处于顶角位置,则该合金中 原子与
原子与 原子数目之比为
原子数目之比为___________ ;该晶体中,原子之间的相互作用是___________ 。
(3)某钙钛型复合氧化物如图所示,以 原子为晶胞的顶角,
原子为晶胞的顶角, 位可以是
位可以是 、
、 、
、 或
或 ,当
,当 位是
位是 、
、 、
、 、
、 等时,这种化合物具有
等时,这种化合物具有 效应。
效应。

①用 、
、 、
、 表示这类特殊晶体的化学式
表示这类特殊晶体的化学式___________ 。
②下列有关说法正确的是___________ 。
A.镧、锰、氧分别位于周期表 、
、 、
、 区
区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的价层电子排布与钾相同
Ⅱ.如图所示为金属原子的四种基本堆积(分别为:简单立方堆积、六方最密堆积、面心立方最密堆积、体心立方堆积、)模型,请回答以下问题:

(4)某金属的晶胞为C型,其堆积方式的名称 为___________ 。
(5)某金属R的晶胞为D型,已知R原子半径为rcm,相对原子质量为M,阿伏加德罗常数为NA,则R金属的密度___________ 。(用含r、M、NA字母的式子表示)
(1)写出溴原子的核外电子排布式
(2)元素金
 处于周期表中的第六周期,与
处于周期表中的第六周期,与 同族,一种铜金合金晶体的晶胞中
同族,一种铜金合金晶体的晶胞中 原子处于面心,
原子处于面心, 原子处于顶角位置,则该合金中
原子处于顶角位置,则该合金中 原子与
原子与 原子数目之比为
原子数目之比为(3)某钙钛型复合氧化物如图所示,以
 原子为晶胞的顶角,
原子为晶胞的顶角, 位可以是
位可以是 、
、 、
、 或
或 ,当
,当 位是
位是 、
、 、
、 、
、 等时,这种化合物具有
等时,这种化合物具有 效应。
效应。
①用
 、
、 、
、 表示这类特殊晶体的化学式
表示这类特殊晶体的化学式②下列有关说法正确的是
A.镧、锰、氧分别位于周期表
 、
、 、
、 区
区B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的价层电子排布与钾相同
Ⅱ.如图所示为金属原子的四种基本堆积(分别为:简单立方堆积、六方最密堆积、面心立方最密堆积、体心立方堆积、)模型,请回答以下问题:

(4)某金属的晶胞为C型,其堆积方式的
(5)某金属R的晶胞为D型,已知R原子半径为rcm,相对原子质量为M,阿伏加德罗常数为NA,则R金属的密度
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
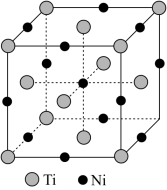
【推荐2】钛镍形状记忆合金(TiNi)被广泛用于人选卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题
(1)写出基态Ni原子的电子排布式:_________ 。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,其中阴离子的立体构型为______ ,中心原子的轨道杂化类型是__________ 。
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔沸点比TiCl4高得多,其原因是_______ 。②原子半径r(Cl)_____ (填“>”、“<”或“=”,下同)r(Mg),离子半径r(O2-)______ r(Mg2+)。
(4)金属镍能与CO反应生成一种配合物Ni(CO)4(常温下为无色液体)。Ni(CO)4的固体属于_____ 晶体,Ni与CO之间的化学键称为_________ 。
(5)一种钛镍合金的立方晶胞结构如右图所示。该合金中Ti的配位数为_______ 。
(1)写出基态Ni原子的电子排布式:
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,其中阴离子的立体构型为
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔沸点比TiCl4高得多,其原因是
(4)金属镍能与CO反应生成一种配合物Ni(CO)4(常温下为无色液体)。Ni(CO)4的固体属于
(5)一种钛镍合金的立方晶胞结构如右图所示。该合金中Ti的配位数为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___ (填元素符号),其中C原子的核外电子排布式为___________ 。
(2)单质A有两种同素异形体,其中沸点高的是___________ (填分子式),原因是___________ 。写出A的氢化物的结构式:___________ ;B的氢化物的电子式:___________ 。
(3)C和D反应可生成组成比为1:3的化合物E,E的中心原子的杂化轨道类型为___________ 。
(4)化合物D2A的立体构型为___________ ,中心原子的价层电子对数为___________ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为___________ 。
(5)C和D形成的分子中每个原子外层都满足8电子稳定结构,则该分子的分子式为:___________ ,该分子为___________ (极性或非极性)分子,立体构型为___________ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1:3的化合物E,E的中心原子的杂化轨道类型为
(4)化合物D2A的立体构型为
(5)C和D形成的分子中每个原子外层都满足8电子稳定结构,则该分子的分子式为:
您最近一年使用:0次
【推荐1】已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
(1)请用元素符号完成下列空白:
①元素:A_______ 、B_______ 、C_______ 、D______ 、E______ 、F______ 。
②A、B、C三种元素的电负性大小顺序是:___________ 。
③B、C、D、E四种元素的第一电离能大小顺序是:___________ 。
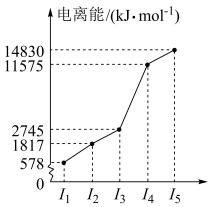
(2)如图是A~F元素中某种元素的部分电离能,由此可判断该元素是___________ 。F元素位于周期表的___________ 区,此区元素的价电子层结构特点是___________ 。
 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。(1)请用元素符号完成下列空白:
①元素:A
②A、B、C三种元素的电负性大小顺序是:
③B、C、D、E四种元素的第一电离能大小顺序是:
(2)如图是A~F元素中某种元素的部分电离能,由此可判断该元素是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】太阳能电池的核心材料——硅
Ⅰ.能源是人类物质文明发展的基石。太阳能是一种清洁、绿色的能量。基于太阳能广泛应用的太阳能电池主要类型有硅太阳能电池、薄膜太阳能电池、钙钛矿太阳能电池。
(1)关于太阳能电池的下列说法中,正确的是_______。
(2)硅是构成硅太阳能电池的主要材料,下列关于硅的说法中不正确的是______。
(3)晶体硅的晶胞结构如图1所示。下列关于硅晶胞的叙述错误的是_______。
Ⅱ .工业上高纯晶体硅可由下图所示流程制备。_______ ,其中处于同一周期的两元素第一电离能大小关系为_____ 。SiHCl3分子的空间结构是_____ ,属于_____ 分子(选填“极性”或“非极性”)。
(5)由纯的SiHCl3制备高纯硅的化学方程式为_________ 。若制备2.80g硅,则消耗标准状况下的氢气_______ L。
(6)关于晶体硅及其性质的下列描述中,不正确的是___________。
(7)CaTiO3是钙钛矿太阳能电池的主要成分,CaTiO3晶胞结构如图所示:________ ,C代表_______ ,B微粒配位数是_______ 。
Ⅰ.能源是人类物质文明发展的基石。太阳能是一种清洁、绿色的能量。基于太阳能广泛应用的太阳能电池主要类型有硅太阳能电池、薄膜太阳能电池、钙钛矿太阳能电池。
(1)关于太阳能电池的下列说法中,正确的是_______。
| A.太阳能电池能将太阳能百分之百地转化为电能 |
| B.太阳能电池与锂电池一样可以反复充电 |
| C.漆黑的夜晚太阳能电池也能实现太阳能向电能的转化 |
| D.戈壁、沙漠等日照充足、干旱少雨的地区适合大规模安装太阳能电池 |
(2)硅是构成硅太阳能电池的主要材料,下列关于硅的说法中不正确的是______。
| A.硅原子的价层电子排布式为3s23p2 | B.硅原子核外有5种不同的空间运动状态 |
| C.硅原子核外有14种不同的电子运动状态 | D.硅元素属于s区元素 |
(3)晶体硅的晶胞结构如图1所示。下列关于硅晶胞的叙述错误的是_______。
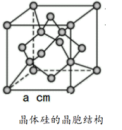
| A.硅原子采用了sp3杂化 | B.每一个晶胞中包含8个硅原子 |
| C.晶体硅采用了紧密堆积的方式 | D.晶体硅的密度是 224/a3NA g·cm-3 |
Ⅱ .工业上高纯晶体硅可由下图所示流程制备。

(5)由纯的SiHCl3制备高纯硅的化学方程式为
(6)关于晶体硅及其性质的下列描述中,不正确的是___________。
| A.晶体硅是常用的半导体 | B.硅既可与酸反应又可与强碱反应 |
| C.晶体硅熔点高、硬度大,属分子晶体 | D.晶体硅与无定形硅均具各向异性 |
(7)CaTiO3是钙钛矿太阳能电池的主要成分,CaTiO3晶胞结构如图所示:

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为_____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
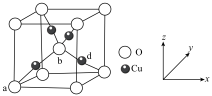
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为____________ ,已知该晶体的密度为ρg/cm3,NA是阿伏伽德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为
(2)MgO的熔点高于CuO的原因是
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的基态原子的电子排布式:____ ,Y元素原子最外层电子的轨道表示式:____ 。
(2)若X、Y两元素电负性分别为1.8和3.0,试判断XY4中X与Y之间的化学键为____ (填“共价键”或“离子键”)。
(3)该化合物的空间结构为____ 形,中心原子的轨道杂化类型为____ ,分子为____ (填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____ 。
(5)该化合物的沸点与SiCl4比较:____ (填化学式)的高,原因是____ 。
(1)X元素的基态原子的电子排布式:
(2)若X、Y两元素电负性分别为1.8和3.0,试判断XY4中X与Y之间的化学键为
(3)该化合物的空间结构为
(4)该化合物在常温下为液体,该液体微粒间的作用力是
(5)该化合物的沸点与SiCl4比较:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】2021年5月15日,天问一号探测器成功着陆于火星。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。请回答下列问题:
(1)邻氨基吡啶( )的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由小到大的顺序为
)的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由小到大的顺序为___________ (填元素符号)。基态N原子核外电子的运动状态有___________ 种,设NA为阿伏加德罗常数的值,1 mol 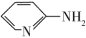 中含有σ键的数目为
中含有σ键的数目为___________ 。
(2)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。SiCl4可发生水解反应,机理如下:

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为___________ (填标号)。SiCl4的熔沸点___________ (填“高于”或“低于”)CCl4,原因是___________ 。
(3)一种鸟嘌呤和吡咯的结构如图。
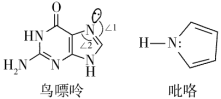
①鸟嘌呤中轨道之间的夹角∠1___________ ∠2(填“>”或“<”)
②分子中的大π键可以用符号π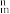 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡咯中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡咯中的大π键可表示为___________ 。
(4)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。

若该晶体密度为d g·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=___________ nm(写出代数式)。
(1)邻氨基吡啶(
 )的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由小到大的顺序为
)的铜配合物在有机不对称合成中起催化诱导效应。邻氨基吡啶中所有元素的电负性由小到大的顺序为 中含有σ键的数目为
中含有σ键的数目为(2)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(3)一种鸟嘌呤和吡咯的结构如图。

①鸟嘌呤中轨道之间的夹角∠1
②分子中的大π键可以用符号π
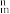 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡咯中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡咯中的大π键可表示为(4)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。

若该晶体密度为d g·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】当下新能源汽车电池的发展加大了对金属钻(Co)的需求。回答下列问题:
(1)基态Co原子价电子排布式为__________ ,Co2+有___ 个未成对电子。
(2)Co的第四电离能比Fe的第四电离能要小很多,原因是________________ 。
(3)Na3[Co(NO2)6]中的 中N原子为
中N原子为_______ 杂化,空间构型名称为_________ 形。
(4)一种Co(Ⅱ)的配合物结构如图所示,下列说法错误的是______(填序号)。
(5)金属钴晶胞结构及参数如图所示,该晶胞中Co的配位数为________ 。已知金属Co晶体密度为ρ g/cm3,则阿伏加德罗常数NA=___________ mol-1。
(1)基态Co原子价电子排布式为
(2)Co的第四电离能比Fe的第四电离能要小很多,原因是
(3)Na3[Co(NO2)6]中的
 中N原子为
中N原子为(4)一种Co(Ⅱ)的配合物结构如图所示,下列说法错误的是______(填序号)。
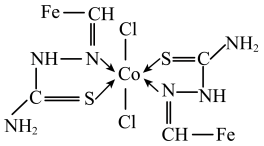
| A.配合物中的氯元素是Cl- |
| B.配合物中Co2+配位数为4 |
| C.结构中所有N原子有sp2、sp3杂化 |
D.结构 中所有原子共平面 中所有原子共平面 |
(5)金属钴晶胞结构及参数如图所示,该晶胞中Co的配位数为
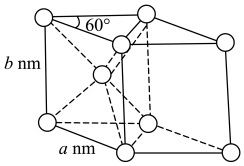
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号)。A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子。短周期元素B的一种常见单质为淡黄色粉末。元素C的原子最外层电子数是其内层电子数的3倍。
(1)在第3周期中,第一电离能大于B的元素有_______ 种;A与B形成晶体的晶胞如图所示,该晶胞实际拥有Bn-的数目为_______ ;
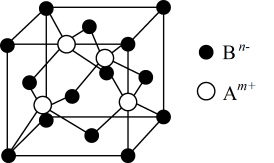
(2)B的氢化物(H2B)分子的空间构型为__________ ;
在乙醇中的溶解度:sH2C)>s(H2B),其原因是_______ 。
(3)B与C可形成BC
①BC 中,B原子轨道的杂化类型是
中,B原子轨道的杂化类型是________ 。
②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为_______ (写出一种即可)。
(4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有 键的物质的量为
键的物质的量为___ mol。
(1)在第3周期中,第一电离能大于B的元素有

(2)B的氢化物(H2B)分子的空间构型为
在乙醇中的溶解度:sH2C)>s(H2B),其原因是
(3)B与C可形成BC

①BC
 中,B原子轨道的杂化类型是
中,B原子轨道的杂化类型是②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC
 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为(4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有
 键的物质的量为
键的物质的量为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO═Fe(CO)5。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3═Cu(NH3)3(CO)OOCCH3。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最低的是______ (填字母序号)。
a.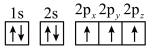 b.
b.
c.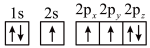 d.
d.
(2)写出CO的一种常见等电子体的结构式:_______ ;C、N、O的电负性由大到小的顺序为______ (用元素符号表示)。
(3)与O同族的元素还有S、Se、Te,它们简单氢化物的沸点从高到低的顺序为______ ,其原因为______ 。
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价, [Cu(NH3)2]+中中心离子的电子排布式为______ ,其中碳原子的杂化轨道类型是______ ,NH3分子的VSEPR模型为______ 。
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:
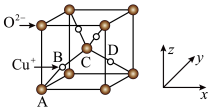
①若以A点为原点建立坐标系,A的坐标为(0,0,0),B的坐标为(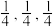 ),则D的坐标为
),则D的坐标为______ ;
②若阿伏加 德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为______ g•cm-3。
(1)下列氮原子的电子排布图表示的状态中,能量最低的是
a.
 b.
b.
c.
 d.
d.
(2)写出CO的一种常见等电子体的结构式:
(3)与O同族的元素还有S、Se、Te,它们简单氢化物的沸点从高到低的顺序为
(4)配合物[Cu(NH3)2]OOCCH3中,铜显+1价, [Cu(NH3)2]+中中心离子的电子排布式为
(5)已知铜的一种氧化物Cu2O晶体的晶胞结构如图所示:

①若以A点为原点建立坐标系,A的坐标为(0,0,0),B的坐标为(
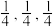 ),则D的坐标为
),则D的坐标为②若阿伏加 德罗常数为NA,该晶胞的边长为a pm,则晶体的密度为
您最近一年使用:0次
【推荐3】综合利用二氧化碳可以缓解温室效应。
(1)利用二氧化碳催化氢化获得甲酸的部分反应历程如图,该反应历程的决速步骤是


(2)二氧化碳与氢气反应过程涉及的主要反应如下:
①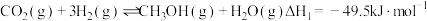
②
向 恒容密闭容器中通入
恒容密闭容器中通入 和
和 发生上述反应①和②,起始总压强为
发生上述反应①和②,起始总压强为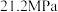 ,实验测得
,实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性(转化的
的选择性(转化的 中生成
中生成 的百分比)随温度变化如图。表示
的百分比)随温度变化如图。表示 选择性的曲线是
选择性的曲线是 ”或“
”或“ ”),a、c两点中
”),a、c两点中 的产率最高的是
的产率最高的是 时反应①的压强平衡常数
时反应①的压强平衡常数
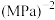 ,
, 曲线如此变化的原因是
曲线如此变化的原因是
(3)二氧化碳与氢气反应生成的水在温度低于
 时可形成多种冰的晶体,其中两种冰晶体的晶胞如图,冰晶体中微粒间的作用力有
时可形成多种冰的晶体,其中两种冰晶体的晶胞如图,冰晶体中微粒间的作用力有 晶胞和
晶胞和 晶胞的体积比为
晶胞的体积比为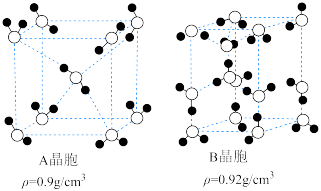
(4)工业上采用以熔融碳酸盐作为电解质的氢氧燃料电池可综合利用二氧化碳,工作原理如图,则通入氢气的电极反应式为

您最近一年使用:0次



