硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在___________ 的郊区(填选项的标号)
a. 有丰富黄铁矿资源的城市 b. 风光秀丽的旅游城市
c. 消耗硫酸甚多的工业城市 d. 人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应:SO2(g)+1/2O2(g) ⇌SO3(g);△H=-98.3kJ·mol-1;放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出)__________ 千焦能量;
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为____________________ 。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因________________________________________ 。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在
a. 有丰富黄铁矿资源的城市 b. 风光秀丽的旅游城市
c. 消耗硫酸甚多的工业城市 d. 人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应:SO2(g)+1/2O2(g) ⇌SO3(g);△H=-98.3kJ·mol-1;放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出)
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因
10-11高三上·河南新乡·阶段练习 查看更多[1]
(已下线)2011届河南省卫辉市第一中学高三1月月考(理综)化学部分
更新时间:2016-12-09 01:25:45
|
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】高砷煤中含有砷硫铁(FeAsS)等物质。燃煤产生的烟气中含NO、 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
(1)燃煤固硫
①燃用高砷煤时加入生石灰将大部分硫元素转化为___________ (填化学式)留在煤渣中。
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为________________ 。
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将 、NO、
、NO、 转化为
转化为 。烟气中含有的
。烟气中含有的 会使钒氧化物催化剂中毒。
会使钒氧化物催化剂中毒。
①在SCR脱硝的反应中还原剂为_______________ (填化学式)。
②研究发现砷中毒机理主要是 分子破坏了催化剂的Lewis酸位点,使
分子破坏了催化剂的Lewis酸位点,使 数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构
数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构__________ 。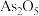 不易使催化剂中毒。但与
不易使催化剂中毒。但与 相比,
相比,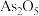 更不利于脱硝反应的进行,其原因是
更不利于脱硝反应的进行,其原因是_______________ 。
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量( 或铵盐)会影响水泥的性能。
或铵盐)会影响水泥的性能。
①取50.00 g粉煤灰加入NaOH蒸出 ,用20 mL 0.1000 mol⋅L
,用20 mL 0.1000 mol⋅L 的
的 溶液吸收
溶液吸收 ,用0.2000mol⋅L
,用0.2000mol⋅L NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以 计的氨含量
计的氨含量___________ (用mg⋅g 表示,写出计算过程)。
表示,写出计算过程)。
②相同烟气所得脱硝粉煤灰(经过SCR脱硝后获得)与未脱硝粉煤灰(直接沉降获得)加水后溶解后,所得浆液pH随时间的变化如图所示。脱硝粉煤灰pH始终比未脱硝粉煤灰低的原因是___________ 。
 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。(1)燃煤固硫
①燃用高砷煤时加入生石灰将大部分硫元素转化为
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成
 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将
 、NO、
、NO、 转化为
转化为 。烟气中含有的
。烟气中含有的 会使钒氧化物催化剂中毒。
会使钒氧化物催化剂中毒。①在SCR脱硝的反应中还原剂为
②研究发现砷中毒机理主要是
 分子破坏了催化剂的Lewis酸位点,使
分子破坏了催化剂的Lewis酸位点,使 数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构
数量减少(产物中As化合价为+3、+5)。请补充完整产物的结构
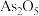 不易使催化剂中毒。但与
不易使催化剂中毒。但与 相比,
相比,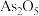 更不利于脱硝反应的进行,其原因是
更不利于脱硝反应的进行,其原因是(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(
 或铵盐)会影响水泥的性能。
或铵盐)会影响水泥的性能。①取50.00 g粉煤灰加入NaOH蒸出
 ,用20 mL 0.1000 mol⋅L
,用20 mL 0.1000 mol⋅L 的
的 溶液吸收
溶液吸收 ,用0.2000mol⋅L
,用0.2000mol⋅L NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00 mL,计算粉煤灰中的以 计的氨含量
计的氨含量 表示,写出计算过程)。
表示,写出计算过程)。②相同烟气所得脱硝粉煤灰(经过SCR脱硝后获得)与未脱硝粉煤灰(直接沉降获得)加水后溶解后,所得浆液pH随时间的变化如图所示。脱硝粉煤灰pH始终比未脱硝粉煤灰低的原因是

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】某兴趣小组设计相关实验方案对Cu2+、Ag+氧化性的强弱进行探究。
已知:①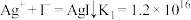 ;
;
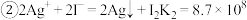
I.溶液准备
(1)配制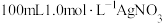 溶液,需使用的玻璃仪器有烧杯、胶头滴管、
溶液,需使用的玻璃仪器有烧杯、胶头滴管、___________ 、___________ ,测得该溶液的pH≈4。
II.通过置换反应比较
(2)向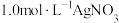 溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性
溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性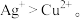 写出该反应的化学方程式是
写出该反应的化学方程式是___________ 。
Ⅲ.通过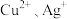 分别与同一物质反应进行比较
分别与同一物质反应进行比较
(3)①经检验,实验i中反应后溶液不含I2,则该反应产生的黄色沉淀是___________ 。
②经检验,实验ii中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认白色沉淀A的实验iii如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有___________ (填离子符号)。
b.白色沉淀A与AgNO3溶液反应的离子方程式是___________ ,说明氧化性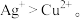
(4)分析“实验i”中Ag+未能氧化I-,而“实验ii”中Cu2+能氧化I-的原因。
①结合K值分析:因___________ ,Ag+更易与I-发生复分解反应,生成AgI,故Ag+未能氧化I-;
②结合实验ii的反应方程式及其特点分析:___________ ,促进反应向正反应方向进行,故Cu2+能更易氧化I⁻。
IV.通过设计原电池装置进行比较
电极均为石墨,KI和AgNO3溶液浓度均为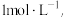 d中是
d中是 Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
(5)①实验v的现象说明Ag+能氧化Γ,a中溶液呈棕黄色的原因是___________ (用电极反应式表示)。
②实验vi的实验现象不足以说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,小组同学设计实验并证实该依据,他们的实验方案是___________ ,现象是c中溶液较慢变浅黄色;电流计指针偏转。
小组同学根据实验v和实验vi,可推断氧化性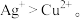
已知:①
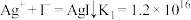 ;
;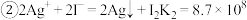
I.溶液准备
(1)配制
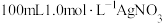 溶液,需使用的玻璃仪器有烧杯、胶头滴管、
溶液,需使用的玻璃仪器有烧杯、胶头滴管、II.通过置换反应比较
(2)向
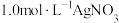 溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性
溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性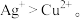 写出该反应的化学方程式是
写出该反应的化学方程式是Ⅲ.通过
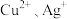 分别与同一物质反应进行比较
分别与同一物质反应进行比较| 编号 | 实验操作 | 现象 |
| 实验i | 向1.0mL1.0mol·L-1KI溶液中滴加1.0mL1.0mol·L-1AgNO3溶液 | 产生黄色沉淀,溶液无色 |
| 实验ii | 向1.0mL1.0mol·L-1KI溶液中滴加1.0mL0.5mol·L-1Cu(NO3)2溶液 | 产生白色沉淀A,溶液变黄色 |
②经检验,实验ii中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认白色沉淀A的实验iii如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有
b.白色沉淀A与AgNO3溶液反应的离子方程式是
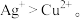
(4)分析“实验i”中Ag+未能氧化I-,而“实验ii”中Cu2+能氧化I-的原因。
①结合K值分析:因
②结合实验ii的反应方程式及其特点分析:
IV.通过设计原电池装置进行比较
电极均为石墨,KI和AgNO3溶液浓度均为
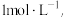 d中是
d中是 Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:| 编号 | 实验iv | 实验v | 实验vi |
| 装置 |  | 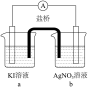 | 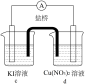 |
| 现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转 | c中溶液较慢变浅黄色;电流计指针偏转 |
②实验vi的实验现象不足以说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,小组同学设计实验并证实该依据,他们的实验方案是
小组同学根据实验v和实验vi,可推断氧化性
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】(1)①一定温度下,在密闭容器中充入 1molN2和 3molH2 发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=
2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=_____ ;
②若向该容器中再加入 1molN2和 3molH2,达到平衡状态时,N2的转化率为 a2,则a2_____ a1(填“>”、“<”或“=”)。
(2)对于反应 2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。
_____ P2(填“>”、“<”或“=”)。
②该反应的平衡常数 K 的表达式为_____ ,随温度升高,该反应平衡常 数变化的趋势是_____ 。(填“增大”、“减小”或“不变”)。
③下列措施中能够同时满足增大反应速率和提高 NO 转化率的是_____ 。(填写相应字母)
A.使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入 O2 D.降低温度E. 压缩容器体积
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用 H 2 将 NO2还原为 N2。
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+67kJ/mol
则 H2还原 NO2生成 N2的热化学方程式是_____
 2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=
2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=②若向该容器中再加入 1molN2和 3molH2,达到平衡状态时,N2的转化率为 a2,则a2
(2)对于反应 2NO(g)+O2(g)
 2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。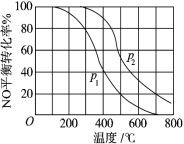
②该反应的平衡常数 K 的表达式为
③下列措施中能够同时满足增大反应速率和提高 NO 转化率的是
A.使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入 O2 D.降低温度E. 压缩容器体积
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用 H 2 将 NO2还原为 N2。
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+67kJ/mol
则 H2还原 NO2生成 N2的热化学方程式是
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】工厂烟气(主要污染物 SO2、NO)直接排放会造成空气污染,需处理后才能排放。
(1)O3 氧化:O3 氧化过程中部分反应的能量变化如图所示, Ea1 是反应的活化能,一定条件下,活化能越大反应速 率越慢,反应越困难。

①写出 NO 与 O3 反应的热化学方程式:___________ 。
②在相同条件下,O3 与 SO2 反应的速率___________ O3 与 NO 的反应速率。(填“>”“<”或“=”)
③其他条件不变时,工厂烟气处理主要发生 NO 与 O3 反应,即使增加 n(O3),O3 氧化 SO2 的反应几乎不受影响, 可能原因是___________ 。
(2)NaClO2 氧化:40 ℃时向一定量 NaClO2 溶液中按一定流速持续通入工厂烟气,溶液的 pH 与 ORP 值(氧化还原 电位)随时间变化如图所示。

①写出溶液中 NO 与 反应生成
反应生成 和 Cl-的离子方程式:
和 Cl-的离子方程式:___________ 。
②烟气中含有少量 SO2,NO 的脱除率比不含 SO2 的烟气高,可能原因是___________ 。
(1)O3 氧化:O3 氧化过程中部分反应的能量变化如图所示, Ea1 是反应的活化能,一定条件下,活化能越大反应速 率越慢,反应越困难。

①写出 NO 与 O3 反应的热化学方程式:
②在相同条件下,O3 与 SO2 反应的速率
③其他条件不变时,工厂烟气处理主要发生 NO 与 O3 反应,即使增加 n(O3),O3 氧化 SO2 的反应几乎不受影响, 可能原因是
(2)NaClO2 氧化:40 ℃时向一定量 NaClO2 溶液中按一定流速持续通入工厂烟气,溶液的 pH 与 ORP 值(氧化还原 电位)随时间变化如图所示。

①写出溶液中 NO 与
 反应生成
反应生成 和 Cl-的离子方程式:
和 Cl-的离子方程式:②烟气中含有少量 SO2,NO 的脱除率比不含 SO2 的烟气高,可能原因是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】碳和氧元素及其化合物与人类的生产、生活密切相关。
I.氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备气态氯胺(NH2Cl),已知部分化学键的键能:
则上述反应的热化学方程式为:__________________ 。
(2)氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为_____________ 。
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(3)在三个容积均为1L的密闭容器中以不同的氢碳比 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
请回答下列问题:
①反应的△H______ 0,氢碳比α____ β,Q点v(正)_____ v(逆)(填“>”或“<”、“=”)
②若起始时,CO2的浓度分别为0.5mol/L,则P点对应温度度的平衡常数的值为________ 。
(4)已知:碳酸 H2CO3: K1=4.3×10-7、K2=5.6×10-11;
草酸 H2C2O4: K1=6.0×10-2、K2=6.0×10-5
①下列微粒可以大量共存的是_______ (填字母)。
a.CO32-、HC2O4-b.H2CO3、C2O42-c. C2O42-、HCO3-d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________ 。
I.氯的化合物合成、转化一直是科学研究的热点。
(1)一定条件下,氯气与氨气反应可以制备气态氯胺(NH2Cl),已知部分化学键的键能:
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能/KJ•mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
则上述反应的热化学方程式为:
(2)氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为
II.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(3)在三个容积均为1L的密闭容器中以不同的氢碳比
 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示。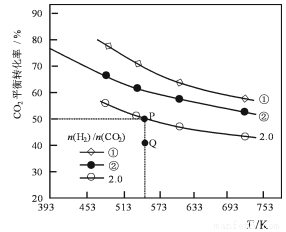
请回答下列问题:
①反应的△H
②若起始时,CO2的浓度分别为0.5mol/L,则P点对应温度度的平衡常数的值为
(4)已知:碳酸 H2CO3: K1=4.3×10-7、K2=5.6×10-11;
草酸 H2C2O4: K1=6.0×10-2、K2=6.0×10-5
①下列微粒可以大量共存的是
a.CO32-、HC2O4-b.H2CO3、C2O42-c. C2O42-、HCO3-d.H2C2O4、HCO3-
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】“C化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)⇌CH3OH g)+H2O(g)△H=﹣49.0kJ/mol.
相关数据如下:
请回答:
①c1__ c2(填“>”、“<”或“=”);c=__ kJ.
②同温同体积甲、乙达平衡时:a+b=_____ ,若甲、乙为体积相同的绝热容器,达平衡时a+b__________
(2)压强为p1时,向体积为1L的密闭容器中充入b mol CO 和2b mol H2,发生反应CO (g)+2H2(g)⇌CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示.请回答:该反应属于__ (填“吸热”或“放热”)反应;p1__ p2(填“>”、“<”或“=”)

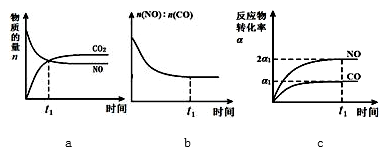
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)⇋2CO2(g)+N2(g)△H<0.在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是__ (选填字母).
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)⇌CH3OH g)+H2O(g)△H=﹣49.0kJ/mol.
相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时转化率 | a | b |
| 平衡时能量变化 | 放出29.4kJ | 吸收 c kJ |
请回答:
①c1
②同温同体积甲、乙达平衡时:a+b=
(2)压强为p1时,向体积为1L的密闭容器中充入b mol CO 和2b mol H2,发生反应CO (g)+2H2(g)⇌CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示.请回答:该反应属于

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)⇋2CO2(g)+N2(g)△H<0.在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2),在催化剂的作用下合成甲醇,可能发生的反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1 = -49.5 kJ· mol−1
Ⅱ.CO2(g)+ H2(g)⇌CO(g)+H2O(g) ΔH2 = +40.9 kJ· mol−1
Ⅲ.CO (g)+2H2(g)⇌CH3OH(g) ΔH3 = -90.4 kJ· mol−1
回答下列问题:
(1)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CO (g)和CH3OH (g)的物质的量分别为ɑ mol、b mol,此时H2O(g)的浓度为________ mol﹒L−1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数K为________ 。
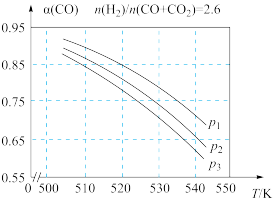
(2)如图为合成气的组成n(H2)/n(CO+CO2)=2.6时,体系中CO的平衡转化率α(CO)与温度和压强的关系,图中的压强由大到小的顺序为________ 。
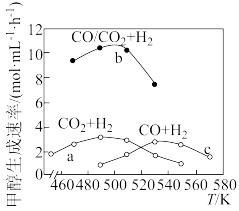
(3)如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是________ 。(填“A”或“B” )
A.CO CO2
CO2 CH3OH+H2O
CH3OH+H2O
B.CO2 CO
CO CH3OH
CH3OH
(4)如图为一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系。
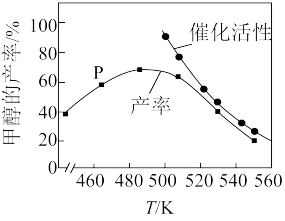
①温度为470K时,图中P点的v正________ v逆。(填“>”“<”或“=”)
②下列说法错误的是________ 。(填标号)
A.增大压强或加入大量催化剂均一定能提高甲醇的产率
B.490K之前,甲醇的产率随温度升高而增大的原因可能是升高温度使反应Ⅰ的平衡正向移动
C.490K之后,甲醇的产率随温度升高而减小的原因可能是因为催化剂活性降低
D.490K之后,甲醇的产率随温度的升高而减小的原因可能是升高温度使反应Ⅲ的平衡逆向移动
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1 = -49.5 kJ· mol−1
Ⅱ.CO2(g)+ H2(g)⇌CO(g)+H2O(g) ΔH2 = +40.9 kJ· mol−1
Ⅲ.CO (g)+2H2(g)⇌CH3OH(g) ΔH3 = -90.4 kJ· mol−1
回答下列问题:
(1)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CO (g)和CH3OH (g)的物质的量分别为ɑ mol、b mol,此时H2O(g)的浓度为
(2)如图为合成气的组成n(H2)/n(CO+CO2)=2.6时,体系中CO的平衡转化率α(CO)与温度和压强的关系,图中的压强由大到小的顺序为

(3)如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是

A.CO
 CO2
CO2 CH3OH+H2O
CH3OH+H2OB.CO2
 CO
CO CH3OH
CH3OH(4)如图为一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系。

①温度为470K时,图中P点的v正
②下列说法错误的是
A.增大压强或加入大量催化剂均一定能提高甲醇的产率
B.490K之前,甲醇的产率随温度升高而增大的原因可能是升高温度使反应Ⅰ的平衡正向移动
C.490K之后,甲醇的产率随温度升高而减小的原因可能是因为催化剂活性降低
D.490K之后,甲醇的产率随温度的升高而减小的原因可能是升高温度使反应Ⅲ的平衡逆向移动
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
试回答下列问题:
(1)上述反应的正反应是________ 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________ (填“增大”、“减小”或“不变”),容器内混合气体的压强________ (填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______ (选填字母).
(4)在830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________ 。
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数/K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应的正反应是
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有
| A | B | C | D | |
| n(CO2)/mol | 3 | 2.4 | 3.2 | 1 |
| n(H2)/mol | 2 | 1.5 | 2.5 | 1 |
| n(CO)/mol | 1 | 2 | 3.5 | 0.5 |
| n(H2O)/mol | 5 | 2 | 2 | 2 |
(4)在830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是
您最近一年使用:0次




