以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。请回答:
(1)已知:2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3351 kJ·molˉ1
2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·molˉ1
2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是________ ,该反应自发进行的条件________ 。
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g) CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
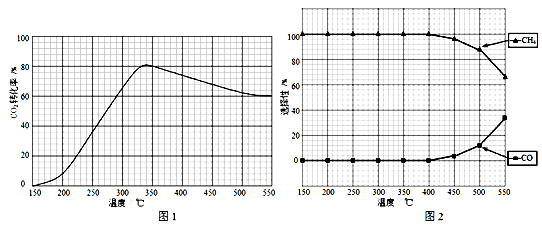
①下列说法不正确 的是________
A.ΔH 4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
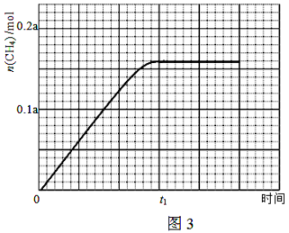
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应Ⅰ的平衡常数为________ (用a、V表示)
③350℃下CH4物质的量随时间的变化曲线如图3所示。画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是________ 。
(1)已知:2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3351 kJ·molˉ1
2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·molˉ1
2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是
(2)在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4反应Ⅱ CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
①下列说法
A.ΔH 4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应Ⅰ的平衡常数为
③350℃下CH4物质的量随时间的变化曲线如图3所示。画出400℃下0~t1时刻CH4物质的量随时间的变化曲线。

(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是
更新时间:2017-08-13 07:40:43
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】硫化氢为易燃危化品,与空'气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸,并且硫化氢有剧毒。油开气采、石油化工、煤化工等行业废气普遍含有硫化氢,需要回收处理并加以利用。
回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g) S2(g) +2H2(g) ΔH1= + 180kJ·mol-1 Kp1=a
S2(g) +2H2(g) ΔH1= + 180kJ·mol-1 Kp1=a
②CS2(g)+2H2(g) CH4(g) +S2(g) ΔH2=-81kJ·mol-1 Kp2= b
CH4(g) +S2(g) ΔH2=-81kJ·mol-1 Kp2= b
则反应③CH4(g) +2H2S(g) CS2(g) +4H2(g) 的 ΔH3=
CS2(g) +4H2(g) 的 ΔH3=___________ kJ·mol-1,Kp3=________ (不写单位)。
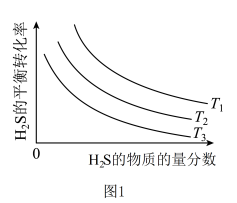
(2)在不同温度、反应压强为100kPn,进料H2S的摩尔分数(可看成体积分数)为0.1%~20% (其余为N2)的条件下,对于反应①,H2S 分解平衡转化率的结果如图1所示。则T1、T2和T3由大到小的顺序为___________ ,同温同压下H2S的摩尔分数越大,H2S 分解平衡转化率越小的原因是______________________ 。
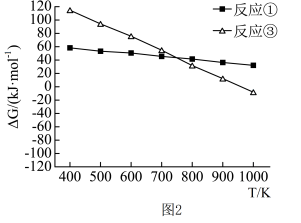
(3)反应①和③的 ΔG随温度的影响如图2所示,已知ΔG =-RTlnK (R为常数,T为温度,K为平衡常数),则在1000°C时,反应的自发趋势①___________ ③(填“>”、“<”或“=”)。在1000°C、100kPa反应条件下,将一定量的H2S和CH4混合进行反应(不考虑反应②),达到平衡时n(CS2):n(H2)约为1:4, n(S2)微乎其微,其原因是___________ 。
(4)在1000°C、100kPa反应条件下,将H2S、CH4、N2摩尔分数比为3:3:2的混合气进行反应③,达到平衡时,CS2分压与H2S的分压相同。则反应③的Kp=___________ (不写单位)。
回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g)
 S2(g) +2H2(g) ΔH1= + 180kJ·mol-1 Kp1=a
S2(g) +2H2(g) ΔH1= + 180kJ·mol-1 Kp1=a②CS2(g)+2H2(g)
 CH4(g) +S2(g) ΔH2=-81kJ·mol-1 Kp2= b
CH4(g) +S2(g) ΔH2=-81kJ·mol-1 Kp2= b 则反应③CH4(g) +2H2S(g)
 CS2(g) +4H2(g) 的 ΔH3=
CS2(g) +4H2(g) 的 ΔH3=(2)在不同温度、反应压强为100kPn,进料H2S的摩尔分数(可看成体积分数)为0.1%~20% (其余为N2)的条件下,对于反应①,H2S 分解平衡转化率的结果如图1所示。则T1、T2和T3由大到小的顺序为

(3)反应①和③的 ΔG随温度的影响如图2所示,已知ΔG =-RTlnK (R为常数,T为温度,K为平衡常数),则在1000°C时,反应的自发趋势①

(4)在1000°C、100kPa反应条件下,将H2S、CH4、N2摩尔分数比为3:3:2的混合气进行反应③,达到平衡时,CS2分压与H2S的分压相同。则反应③的Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】液相催化还原法去除水体中 是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂
是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂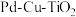 的制备和性能,结果如下。
的制备和性能,结果如下。
Ⅰ.制备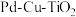 的反应过程如下图所示,光照使
的反应过程如下图所示,光照使 发生电荷分离,电子随机扩散到颗粒表面,将
发生电荷分离,电子随机扩散到颗粒表面,将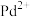 转化为
转化为 沉积到颗粒上。再用类似方法在
沉积到颗粒上。再用类似方法在 上沉积
上沉积 ,得到在
,得到在 纳米颗粒表面紧密接触的
纳米颗粒表面紧密接触的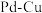 纳米簇。
纳米簇。

(1)该过程中,乙醇发生_______ (填“氧化”或“还原”)反应。
(2)结合图示说明②中 仅沉积在
仅沉积在 上的原因
上的原因_______ 。
Ⅱ.液相催化还原机理如图a所示。其他条件相同,不同 时,反应1小时后
时,反应1小时后 转化率和不同还原产物中在总的比例如图b所示。
转化率和不同还原产物中在总的比例如图b所示。

(3)液相催化还原法中所用的还原剂是_______ 。
(4)为了避免对水体的二次污染, 的理想还原产物是
的理想还原产物是_______ 。
(5)研究表明, 在
在 表面竞争吸附,会降低
表面竞争吸附,会降低 吸附
吸附 的能力,但对
的能力,但对 吸附H的能力影响不大。
吸附H的能力影响不大。
①结合还原机理和催化剂结构分析,反应中 的移动方向是
的移动方向是_______ 。
②随 减小,还原产物中
减小,还原产物中 增大,结合离子方程式解释原因:
增大,结合离子方程式解释原因:_______ 。
(6)控制溶液 可在一定时间内将
可在一定时间内将 尽可能多地转化为
尽可能多地转化为 ,具体方法是
,具体方法是_______ 。
 是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂
是一项很有前景的技术。某科研小组研究该方法中使用的固体催化剂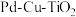 的制备和性能,结果如下。
的制备和性能,结果如下。Ⅰ.制备
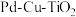 的反应过程如下图所示,光照使
的反应过程如下图所示,光照使 发生电荷分离,电子随机扩散到颗粒表面,将
发生电荷分离,电子随机扩散到颗粒表面,将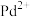 转化为
转化为 沉积到颗粒上。再用类似方法在
沉积到颗粒上。再用类似方法在 上沉积
上沉积 ,得到在
,得到在 纳米颗粒表面紧密接触的
纳米颗粒表面紧密接触的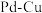 纳米簇。
纳米簇。
(1)该过程中,乙醇发生
(2)结合图示说明②中
 仅沉积在
仅沉积在 上的原因
上的原因Ⅱ.液相催化还原机理如图a所示。其他条件相同,不同
 时,反应1小时后
时,反应1小时后 转化率和不同还原产物中在总的比例如图b所示。
转化率和不同还原产物中在总的比例如图b所示。
(3)液相催化还原法中所用的还原剂是
(4)为了避免对水体的二次污染,
 的理想还原产物是
的理想还原产物是(5)研究表明,
 在
在 表面竞争吸附,会降低
表面竞争吸附,会降低 吸附
吸附 的能力,但对
的能力,但对 吸附H的能力影响不大。
吸附H的能力影响不大。①结合还原机理和催化剂结构分析,反应中
 的移动方向是
的移动方向是②随
 减小,还原产物中
减小,还原产物中 增大,结合离子方程式解释原因:
增大,结合离子方程式解释原因:(6)控制溶液
 可在一定时间内将
可在一定时间内将 尽可能多地转化为
尽可能多地转化为 ,具体方法是
,具体方法是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】CH3OH是一种绿色燃料,可由CO或CO2制备。工业上制备CH3OH发生如下反应:反应1:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.2kJ/mol
CO(g)+H2O(g) ΔH=+41.2kJ/mol
请回答:
(1)CO(g)+2H2(g) CH3OH(g),该反应的ΔH=
CH3OH(g),该反应的ΔH=___________ kJ/mol。
(2)将CO2和H2按1︰3通入密闭容器中发生反应1和反应2,改变反应温度,分别测得1MPa、3MPa、5MPa下CO2的平衡转化率(α)以及3MPa时生成CH3OH、CO选择性(S)的变化如图甲(选择性为目标产物在总产物中的比率)。___________ (填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数Kp=___________ 。
④分子筛膜反应器可提高反应1的平衡转化率,原理如图乙所示。分子筛膜反应器可提高转化率的原因是___________ 。__________
 CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol反应2:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.2kJ/mol
CO(g)+H2O(g) ΔH=+41.2kJ/mol请回答:
(1)CO(g)+2H2(g)
 CH3OH(g),该反应的ΔH=
CH3OH(g),该反应的ΔH=(2)将CO2和H2按1︰3通入密闭容器中发生反应1和反应2,改变反应温度,分别测得1MPa、3MPa、5MPa下CO2的平衡转化率(α)以及3MPa时生成CH3OH、CO选择性(S)的变化如图甲(选择性为目标产物在总产物中的比率)。

②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数Kp=
④分子筛膜反应器可提高反应1的平衡转化率,原理如图乙所示。分子筛膜反应器可提高转化率的原因是


您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】综合治理NO和CO污染时,涉及的反应有:
I. 2NO(g)+2CO(g) N2(g)+2CO2 (g) △H=-746.5 kJ·mol-1
N2(g)+2CO2 (g) △H=-746.5 kJ·mol-1
II. C(s)+ 2NO(g) N2(g)+ CO2 (g) △H=+172.5 kJ·mol-1
N2(g)+ CO2 (g) △H=+172.5 kJ·mol-1
(1)高温下,C(s)与CO2反应生成CO的热化学方程式为__________________________________ 。
(2)将NO与CO以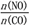 =2的起始投料比充入一个密闭容器中,发生反应I,反应过程中各物质的浓度变化如图所示。
=2的起始投料比充入一个密闭容器中,发生反应I,反应过程中各物质的浓度变化如图所示。
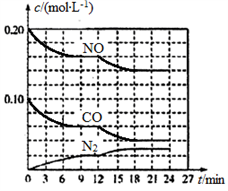
①第12 min时改变的反应条件可能为______________ 。
A.保持恒容,升高温度 B.保持恒容,降低温度
C.充入NO D.保持恒温,缩小容器体积,增大压强
②假设12 min时未改变CO2的含量。该反应在第24 min时达到新的平衡状态时,CO2的体积分数为_________ ,此时该反应的化学平衡常数K的值为___________ (保留两位有效数字)。
(3)向某恒温恒压密闭容器中加入1 mol C(s)和2 mol NO(g),发生反应II。平衡时,N2的体积分数为35%。若保持条件不变,起始向该容器中按下列配比加入物质,达到平衡时,N2的体积分数仍为35%的是________ (填选项字母)。
A.0.5 mol C和2 mol NO B.2 mol N2和2 mol CO2
C.1 mol C、1 mol N2和1 mol CO2 D.1 mol C、1 mol NO和1 mol N2
(4)工业上用石灰乳吸收含NO与NO2的尾气,来制取亚硝酸钙Ca(NO2)2,既能得到重要的化工原料,又能减轻污染。通常要控制NO与NO2的体积比,最理想的体积比为_____ 。若体积比V(NO):V(NO2)过大,会导致_______________________ ;若体积比V(NO):V(NO2)过小,会导致_______________________ 。
I. 2NO(g)+2CO(g)
 N2(g)+2CO2 (g) △H=-746.5 kJ·mol-1
N2(g)+2CO2 (g) △H=-746.5 kJ·mol-1II. C(s)+ 2NO(g)
 N2(g)+ CO2 (g) △H=+172.5 kJ·mol-1
N2(g)+ CO2 (g) △H=+172.5 kJ·mol-1(1)高温下,C(s)与CO2反应生成CO的热化学方程式为
(2)将NO与CO以
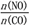 =2的起始投料比充入一个密闭容器中,发生反应I,反应过程中各物质的浓度变化如图所示。
=2的起始投料比充入一个密闭容器中,发生反应I,反应过程中各物质的浓度变化如图所示。
①第12 min时改变的反应条件可能为
A.保持恒容,升高温度 B.保持恒容,降低温度
C.充入NO D.保持恒温,缩小容器体积,增大压强
②假设12 min时未改变CO2的含量。该反应在第24 min时达到新的平衡状态时,CO2的体积分数为
(3)向某恒温恒压密闭容器中加入1 mol C(s)和2 mol NO(g),发生反应II。平衡时,N2的体积分数为35%。若保持条件不变,起始向该容器中按下列配比加入物质,达到平衡时,N2的体积分数仍为35%的是
A.0.5 mol C和2 mol NO B.2 mol N2和2 mol CO2
C.1 mol C、1 mol N2和1 mol CO2 D.1 mol C、1 mol NO和1 mol N2
(4)工业上用石灰乳吸收含NO与NO2的尾气,来制取亚硝酸钙Ca(NO2)2,既能得到重要的化工原料,又能减轻污染。通常要控制NO与NO2的体积比,最理想的体积比为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】石油炼厂气(小分子烷烃和烯烃)的综合利用是当今社会发展的需要。
(1)已知一些物质的燃烧热如下表:
写出丙烷与氢气反应生成甲烷的热化学方程式:___________ 。
(2)1,2-二氯乙烷(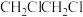 )常用于制造乙酰纤维、烟草萃取剂、熏蒸剂。工业上可用乙烯加成法制备1,2-二氯乙烷,主要副产物为氯乙烯(
)常用于制造乙酰纤维、烟草萃取剂、熏蒸剂。工业上可用乙烯加成法制备1,2-二氯乙烷,主要副产物为氯乙烯(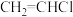 ),反应原理如下:
),反应原理如下:
I.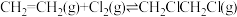
II.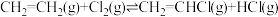
 下,向某恒容密闭容器中充入等物质的量的
下,向某恒容密闭容器中充入等物质的量的 和
和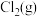 ,在催化剂作用下发生反应,容器内气体的压强随时间的变化如图1所示。
,在催化剂作用下发生反应,容器内气体的压强随时间的变化如图1所示。

①前 内用
内用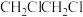 表示的平均反应速率
表示的平均反应速率
___________  。
。
②该温度下,各有机物组分占总有机物的含量 随时间的变化曲线如图2所示,
随时间的变化曲线如图2所示, 表示
表示___________ (填有机物的结构简式),理由是___________ 。反应II的平衡常数
___________ ( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。

③为提高平衡时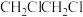 的产率,可采取的措施是
的产率,可采取的措施是___________ (填两条)。
(1)已知一些物质的燃烧热如下表:
| 物质 |  |  | 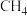 |  |  |
燃烧热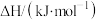 | -393.5 | -285.8 | -890.3 | -1559.8 | -2219.9 |
(2)1,2-二氯乙烷(
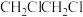 )常用于制造乙酰纤维、烟草萃取剂、熏蒸剂。工业上可用乙烯加成法制备1,2-二氯乙烷,主要副产物为氯乙烯(
)常用于制造乙酰纤维、烟草萃取剂、熏蒸剂。工业上可用乙烯加成法制备1,2-二氯乙烷,主要副产物为氯乙烯(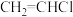 ),反应原理如下:
),反应原理如下:I.
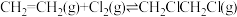
II.
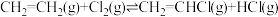
 下,向某恒容密闭容器中充入等物质的量的
下,向某恒容密闭容器中充入等物质的量的 和
和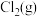 ,在催化剂作用下发生反应,容器内气体的压强随时间的变化如图1所示。
,在催化剂作用下发生反应,容器内气体的压强随时间的变化如图1所示。
①前
 内用
内用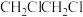 表示的平均反应速率
表示的平均反应速率
 。
。②该温度下,各有机物组分占总有机物的含量
 随时间的变化曲线如图2所示,
随时间的变化曲线如图2所示, 表示
表示
 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
③为提高平衡时
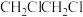 的产率,可采取的措施是
的产率,可采取的措施是
您最近一年使用:0次
【推荐3】我国科学家研发的“液态阳光”计划通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢制备甲醇。
(1)制备甲醇的主反应:
 。
。
该过程中还存在一个生成CO的副反应,结合反应: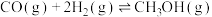
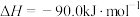 写出该副反应的热化学方程式:
写出该副反应的热化学方程式:______ 。
(2)将 和
和 按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/AI/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如右图所示。
按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/AI/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如右图所示。
①催化剂活性最好的温度为______ (填字母序号)。
a.483K b.503K c.523K d.543K
②温度由523K升到543K, 的平衡转化率降低,解释其原因:
的平衡转化率降低,解释其原因:______ 。
(3)使用 薄膜电极作阴极,通过电催化法将二氧化碳转化为甲醇。
薄膜电极作阴极,通过电催化法将二氧化碳转化为甲醇。
①将铜箔放入煮沸的饱和硫酸铜溶液中,制得 薄膜电极。反应的离子方程式为
薄膜电极。反应的离子方程式为______ 。
②用 薄膜电极作阴极,
薄膜电极作阴极, 溶液作电解液,采用电沉积法制备
溶液作电解液,采用电沉积法制备 薄膜电极,制备完成后电解液中检测到了
薄膜电极,制备完成后电解液中检测到了 。制备ZnO薄膜的电极反应式为
。制备ZnO薄膜的电极反应式为______ 。
③电催化法制备甲醇如图所示。______ 。
(1)制备甲醇的主反应:

 。
。该过程中还存在一个生成CO的副反应,结合反应:
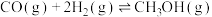
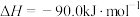 写出该副反应的热化学方程式:
写出该副反应的热化学方程式:(2)将
 和
和 按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/AI/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如右图所示。
按物质的量比1∶3混合,以固定流速通过盛放Cu/Zn/AI/Zr催化剂的反应器,在相同时间内,不同温度下的实验数据如右图所示。

①催化剂活性最好的温度为
a.483K b.503K c.523K d.543K
②温度由523K升到543K,
 的平衡转化率降低,解释其原因:
的平衡转化率降低,解释其原因:(3)使用
 薄膜电极作阴极,通过电催化法将二氧化碳转化为甲醇。
薄膜电极作阴极,通过电催化法将二氧化碳转化为甲醇。①将铜箔放入煮沸的饱和硫酸铜溶液中,制得
 薄膜电极。反应的离子方程式为
薄膜电极。反应的离子方程式为②用
 薄膜电极作阴极,
薄膜电极作阴极, 溶液作电解液,采用电沉积法制备
溶液作电解液,采用电沉积法制备 薄膜电极,制备完成后电解液中检测到了
薄膜电极,制备完成后电解液中检测到了 。制备ZnO薄膜的电极反应式为
。制备ZnO薄膜的电极反应式为③电催化法制备甲醇如图所示。

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意图如下:
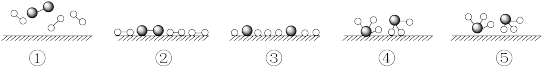
下列说法正确的是_____ (填标号)。
a.①表示N2、H2分子中均是单键
b.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
c.③→④需要吸收能量
d.②→③需要吸收能量
(2)已知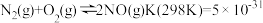 ;
;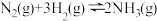
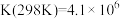 ,请分析工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
,请分析工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是_____ 。
(3)对于反应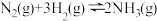 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。
哈伯选用的条件是 、
、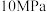 ,而非
,而非 、
、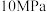 ,可能的原因是
,可能的原因是_____ 。(提示:温度会影响催化剂的活性)
(4)一定温度下,向容积恒定的密闭容器中充入1mol氮气和3mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1mol氮气和3mol氢气,氮气的平衡转化率_____ (填“变大”“变小”或“不变”)。
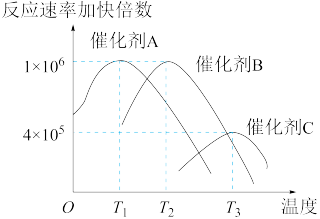
(5)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如下图所示(其他条件相同),则实际生产中适宜选择的催化剂是_____ (填“A"“B”或“C”)。
(6)下图是当反应器中按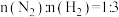 投料后,在
投料后,在 、
、 、
、 反应达到平衡时,混合物中
反应达到平衡时,混合物中 的物质的量分数随总压强的变化曲线。
的物质的量分数随总压强的变化曲线。

①曲线a、b、c对应温度较高的是______ (填“a”或“b”或“c”)。
②列出b点平衡常数的计算式
_____ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;不要求计算结果)。
(1)化学家Gethard Ertl证实了氢气与氮气在固体催化剂表面合成氨的过程,示意图如下:

下列说法正确的是
a.①表示N2、H2分子中均是单键
b.该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
c.③→④需要吸收能量
d.②→③需要吸收能量
(2)已知
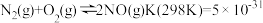 ;
;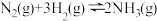
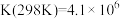 ,请分析工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是
,请分析工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反应固氮的原因是(3)对于反应
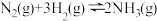 ,在一定条件下氨的平衡含量如下表。
,在一定条件下氨的平衡含量如下表。| 温度/℃ | 压强/ | 氨的平衡含量 |
| 200 | 10 | 81.5% |
| 550 | 10 | 8.25% |
哈伯选用的条件是
 、
、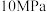 ,而非
,而非 、
、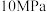 ,可能的原因是
,可能的原因是(4)一定温度下,向容积恒定的密闭容器中充入1mol氮气和3mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1mol氮气和3mol氢气,氮气的平衡转化率
(5)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行实验,所得结果如下图所示(其他条件相同),则实际生产中适宜选择的催化剂是

(6)下图是当反应器中按
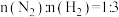 投料后,在
投料后,在 、
、 、
、 反应达到平衡时,混合物中
反应达到平衡时,混合物中 的物质的量分数随总压强的变化曲线。
的物质的量分数随总压强的变化曲线。
①曲线a、b、c对应温度较高的是
②列出b点平衡常数的计算式

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】对苯二甲酸(TPA)是生产聚酯的主要原料。实验中,将初始浓度为0.08mol/L对甲基苯甲酸(p-TA)放入反应器中(用醋酸作为溶剂),在Co-Mn-Br的复合催化剂作用下进行反应,反应温度为186℃,反应过程中有充足的氧气供应,对甲基苯甲酸(p-TA)按照如下的路径发生反应:
 且有
且有
已知对甲基苯甲酸(p-TA)氧化的活化能比对醛基苯甲酸(4-CBA)氧化的活化能大得多。反应10min后,取样分析,对甲基苯甲酸(p-TA)和对醛基苯甲酸(4-CBA)含量基本为零。请回答:
(1)下列说法正确的是___________
(2)画出上述过程中p-TA制备TPA的物质相对能量-反应过程的示意图_________

(3)某研究小组进行了186℃下p-TA液相氧化反应并绘制了各物质浓度随时间的变化图像。
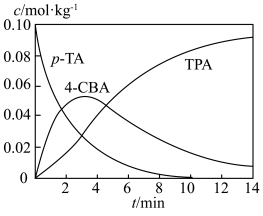
Ⅰ.已知图像中4-CBA的曲线有误,请说明错误的理由:___________ 。
Ⅱ.已知有两种溶剂a与b,p-TA、4-CBA和TPA在其中的溶解情况如下表所示,现欲收集反应的中间产物,选择溶剂___________ (填“a”或“b”)
(4)已知原料对甲基苯甲酸(p-TA)可通过对二甲苯(PX)制取,PX液相氧化遵循自由基机理,部分反应历程如下所示,下列说法正确的是___________
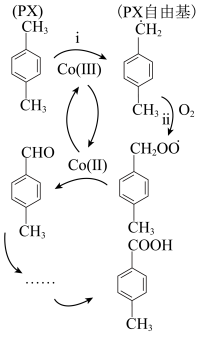
 且有
且有
已知对甲基苯甲酸(p-TA)氧化的活化能比对醛基苯甲酸(4-CBA)氧化的活化能大得多。反应10min后,取样分析,对甲基苯甲酸(p-TA)和对醛基苯甲酸(4-CBA)含量基本为零。请回答:
(1)下列说法正确的是___________
A.反应Ⅰ 的平衡常数表达式 的平衡常数表达式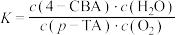 |
| B.CO-Mn-Br催化剂能改变反应历程 |
| C.相同条件下温度升高,反应Ⅰ的速率减慢,反应Ⅱ的速率加快 |
D.升高温度,副产物 的含量会增大 的含量会增大 |

(3)某研究小组进行了186℃下p-TA液相氧化反应并绘制了各物质浓度随时间的变化图像。

Ⅰ.已知图像中4-CBA的曲线有误,请说明错误的理由:
Ⅱ.已知有两种溶剂a与b,p-TA、4-CBA和TPA在其中的溶解情况如下表所示,现欲收集反应的中间产物,选择溶剂
| 溶解度 | 反应物质 | |||
| p-TA | 4-CBA | TPA | ||
| 溶剂 | a | 可溶 | 易溶 | 可溶 |
| b | 易溶 | 难溶 | 可溶 | |

A.Co(Ⅲ)使苯环上甲基的C-H键断裂生成PX自由基和 |
| B.该反应中Co(Ⅲ)作为催化剂 |
| C.PX自由基在反应ⅱ中发生还原反应 |
| D.该历程中原料的原子利用率达到100% |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】硫及其化合物对人类的生产和生活有着重要的作用。一种由含硫化合物参与的制氢示意图如下:

(1)①反应2的化学方程式为___________ ;该反应能量转化的主要方式为_________ 。
②反应4的热化学方程式为2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
已知:a. H2SO4(l) SO3(g)+H2O(g) △H=X
SO3(g)+H2O(g) △H=X
b.2SO3(g) 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol
则X=____________ 。
(2)SO2是一种大气污染物,已知: 2SO2(g)+O2(g) 2SO3(g) △H<0。
2SO3(g) △H<0。
①下列有关该反应速率的叙述正确的是_____________ (填字母)。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强能增大活化分子百分数,加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
②该反应的化学平衡常数表达式为K=____________ 。
③下列有关图象一定正确的是__________ (填字母)。
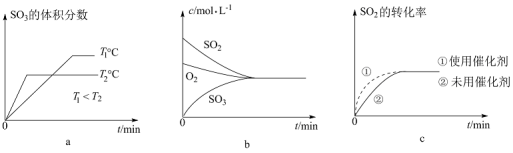
(3)现有甲、乙两个体积相等的恒容容器,甲容器中充入1molSO2和1molO2,乙容器中充入1molSO3和0.5molO2,发生反应:2SO2(g)+O2(g) 2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
①a+b__________ 1(填“<”、“>”或“=”)。
②下列叙述能说明甲容器中反应达平衡状态的是_______________ (填字母)。
A.v正(O2)=2v逆(SO3) B.混合气体的密度不变
C.c(SO2)=c(SO3) D.混合气体的总物质的量不变
E.容器内温度不变 F.SO2和O2的质量比不变

(1)①反应2的化学方程式为
②反应4的热化学方程式为2H2SO4(l)
 2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol已知:a. H2SO4(l)
 SO3(g)+H2O(g) △H=X
SO3(g)+H2O(g) △H=Xb.2SO3(g)
 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol则X=
(2)SO2是一种大气污染物,已知: 2SO2(g)+O2(g)
 2SO3(g) △H<0。
2SO3(g) △H<0。①下列有关该反应速率的叙述正确的是
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强能增大活化分子百分数,加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
②该反应的化学平衡常数表达式为K=
③下列有关图象一定正确的是

(3)现有甲、乙两个体积相等的恒容容器,甲容器中充入1molSO2和1molO2,乙容器中充入1molSO3和0.5molO2,发生反应:2SO2(g)+O2(g)
 2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:
2SO3(g) △H<0,甲、乙容器起始反应温度相同,两容器均为绝热容器,平衡时,甲容器中SO2的转化率为a,乙容器中SO3的分解率为b,则:①a+b
②下列叙述能说明甲容器中反应达平衡状态的是
A.v正(O2)=2v逆(SO3) B.混合气体的密度不变
C.c(SO2)=c(SO3) D.混合气体的总物质的量不变
E.容器内温度不变 F.SO2和O2的质量比不变
您最近一年使用:0次
【推荐1】甲烷是天然气的主要成分,是一种重要的清洁能源和化工原料。
(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:
C(s)+2H2(g)⇌CH4(g)△H=-73kJ•mol-1
2CO(g)⇌C(s)+CO2(g)△H=-171kJ•mol-1
CO(g)+3H2(g)⇌CH4(g)+H2O(g)△H=-203kJ•mol-1
写出CO与H2O(g)反应生成H2和CO2的热化学方程式_______________ 。
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃K(NH3•H2O)=1.74×10-5,K1(H2S)=1.07×10-7,K2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是__________ 。
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b.c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5s后达平衡,生成0.2molCO,用H2表示该反应的速率为_________ ,此反应的平衡常数为___________ (结果保留到小数点后三位)
②下列说法中能说明此反应达到平衡状态的是______________ 。
A.体系的压强不再发生变化 B.生成1molCH4的同时消耗3molH2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.反应速率v(CH4):v(H2O):v(CO):v(H2)=1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H=+49kJ•mol-1
①分析适当增大水醇比[n(H2O):n(CH3OH)]对甲醇水蒸气重整制氢的好处________ 。
②某温度下,将[n(H2O):n(CH3OH)]=l:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为________ 。
(5)如图所示,直接甲醇燃料电池是质子交换膜燃料电池的一种变种,它直接使用甲醇而无需预先重整。请写出电池工作时的负极反应式:_____________________ 。

(1)用煤制天然气时会发生多个反应,通过多种途径生成CH4。
已知:
C(s)+2H2(g)⇌CH4(g)△H=-73kJ•mol-1
2CO(g)⇌C(s)+CO2(g)△H=-171kJ•mol-1
CO(g)+3H2(g)⇌CH4(g)+H2O(g)△H=-203kJ•mol-1
写出CO与H2O(g)反应生成H2和CO2的热化学方程式
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,已知T℃K(NH3•H2O)=1.74×10-5,K1(H2S)=1.07×10-7,K2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是
a.c(NH4+)>c(HS-)>c(OH-)>c(H+) b.c(HS-)>c(NH4+)>c(S2-)>c(H+)
c.c(NH4+)>c(HS-)>c(H2S)>c(H+) d.c(HS-)>c(S2-)>c(H+)>c(OH-)
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。
①一定温度时,在一个体积为2L的恒容密闭容器中,加入1molCH4和1.4mol水蒸气发生上述反应,5s后达平衡,生成0.2molCO,用H2表示该反应的速率为
②下列说法中能说明此反应达到平衡状态的是
A.体系的压强不再发生变化 B.生成1molCH4的同时消耗3molH2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.反应速率v(CH4):v(H2O):v(CO):v(H2)=1:1:1:3
(4)甲醇水蒸气重整制氢反应:CH3OH(g)+H2O(g)⇌CO2(g)+3H2(g)△H=+49kJ•mol-1
①分析适当增大水醇比[n(H2O):n(CH3OH)]对甲醇水蒸气重整制氢的好处
②某温度下,将[n(H2O):n(CH3OH)]=l:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为
(5)如图所示,直接甲醇燃料电池是质子交换膜燃料电池的一种变种,它直接使用甲醇而无需预先重整。请写出电池工作时的负极反应式:

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】我国提出“CO2排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。研发CO2的利用技术,降低空气中CO2的含量是实现该目标的重要途径。
(1)下面是用H2捕捉CO2时发生两个反应:
I.
Ⅱ.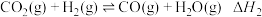
①反应I、Ⅱ的lnK随 的变化如图所示,则
的变化如图所示,则
_______ 0(填“>”“<”或“=”)0;有利于该反应自发进行的温度是___________ (填“高温”或“低温”)。

②将一定量的CO2和H2的混合气体充入密闭容器中, 、
、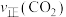 与温度的关系如图所示,400℃之后
与温度的关系如图所示,400℃之后 降低的原因是
降低的原因是_______ ;而速率仍然增大的可能原因是________ 。
③220℃时,将4molH2与1molCO2的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡,CO2的转化率为80%,CH4的选择性为50%,则生成的CH4平均速率为_______ ,反应Ⅱ的平衡常数 为
为________ 。[已知CH4的选择性 ]
]

(2)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工物质Na2CO3.若某次捕捉后得到pH=10的溶液,则溶液中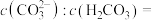
___________ 。(已知常温下 :
: 、
、 )
)
(3)Na-CO2电池可以实现对CO2的利用,该类电池放电的反应方程式为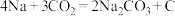 。其工作原理如图所示,请写出正极的反应方程式:
。其工作原理如图所示,请写出正极的反应方程式:________ 。

(1)下面是用H2捕捉CO2时发生两个反应:
I.

Ⅱ.
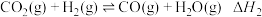
①反应I、Ⅱ的lnK随
 的变化如图所示,则
的变化如图所示,则

②将一定量的CO2和H2的混合气体充入密闭容器中,
 、
、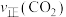 与温度的关系如图所示,400℃之后
与温度的关系如图所示,400℃之后 降低的原因是
降低的原因是③220℃时,将4molH2与1molCO2的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡,CO2的转化率为80%,CH4的选择性为50%,则生成的CH4平均速率为
 为
为 ]
]
(2)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工物质Na2CO3.若某次捕捉后得到pH=10的溶液,则溶液中
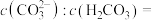
 :
: 、
、 )
)(3)Na-CO2电池可以实现对CO2的利用,该类电池放电的反应方程式为
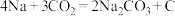 。其工作原理如图所示,请写出正极的反应方程式:
。其工作原理如图所示,请写出正极的反应方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】“低碳经济”备受关注, 的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:
的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:
(1)已知某反应的平衡常数表达式为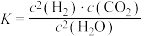 ,所对应的化学反应方程式为
,所对应的化学反应方程式为___________ 。
(2)科学家提出由 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。

①工艺过程中的能量转化形式为___________ 。
②已知“重整系统”发生的反应中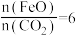 ,则
,则 的化学式为
的化学式为___________ ,“热分解系统”中每转移2mol电子,需消耗
___________ mol。
(3)业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:



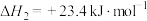
①反应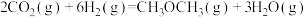

___________
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时, 的转化率如图所示。
的转化率如图所示。 温度下,将4mol
温度下,将4mol  和8mol
和8mol  充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
___________ ; 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为___________ 。

③利用二甲醚设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨作电极,该电池的负极反应式为___________ 。
 的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:
的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:(1)已知某反应的平衡常数表达式为
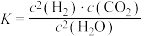 ,所对应的化学反应方程式为
,所对应的化学反应方程式为(2)科学家提出由
 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。
①工艺过程中的能量转化形式为
②已知“重整系统”发生的反应中
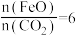 ,则
,则 的化学式为
的化学式为
(3)业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:


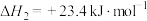
①反应
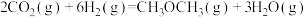

②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,
 的转化率如图所示。
的转化率如图所示。 温度下,将4mol
温度下,将4mol  和8mol
和8mol  充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为
③利用二甲醚设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨作电极,该电池的负极反应式为
您最近一年使用:0次



