NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4 (g) ⇌ N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ⇌ 2NH3(g) △H2
③7N2H4(g) ⇌ 8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________ (用含△H1和△H2的代数式表示),反应③的平衡行数表达式为K=___________ 。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。
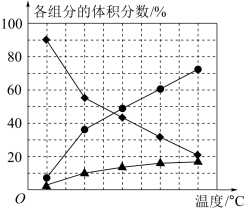
该反应的△H_____________ (填“>”或“<”)0,N2H4发生分解反应的化学方程式为________ 。
(1)①N2H4 (g) ⇌ N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ⇌ 2NH3(g) △H2
③7N2H4(g) ⇌ 8NH3(g)+3N2(g)+2H2(g) △H3
△H3=
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H
更新时间:2017-09-02 13:29:42
|
相似题推荐
填空题
|
较难
(0.4)
解题方法
【推荐1】以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料。工艺流程如下:
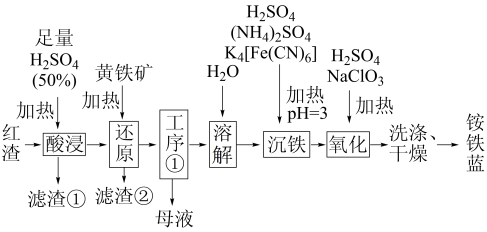
(1)还原工序中,不生成S单质的反应的化学方程式为_______ 。
(2)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为_______ ,氧化工序发生反应的离子方程式为_______ 。

(1)还原工序中,不生成S单质的反应的化学方程式为
(2)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】某兴趣小组设计相关实验方案对Cu2+、Ag+氧化性的强弱进行探究。
已知:①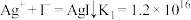 ;
;
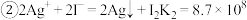
I.溶液准备
(1)配制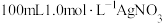 溶液,需使用的玻璃仪器有烧杯、胶头滴管、
溶液,需使用的玻璃仪器有烧杯、胶头滴管、___________ 、___________ ,测得该溶液的pH≈4。
II.通过置换反应比较
(2)向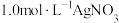 溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性
溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性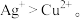 写出该反应的化学方程式是
写出该反应的化学方程式是___________ 。
Ⅲ.通过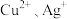 分别与同一物质反应进行比较
分别与同一物质反应进行比较
(3)①经检验,实验i中反应后溶液不含I2,则该反应产生的黄色沉淀是___________ 。
②经检验,实验ii中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认白色沉淀A的实验iii如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有___________ (填离子符号)。
b.白色沉淀A与AgNO3溶液反应的离子方程式是___________ ,说明氧化性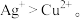
(4)分析“实验i”中Ag+未能氧化I-,而“实验ii”中Cu2+能氧化I-的原因。
①结合K值分析:因___________ ,Ag+更易与I-发生复分解反应,生成AgI,故Ag+未能氧化I-;
②结合实验ii的反应方程式及其特点分析:___________ ,促进反应向正反应方向进行,故Cu2+能更易氧化I⁻。
IV.通过设计原电池装置进行比较
电极均为石墨,KI和AgNO3溶液浓度均为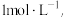 d中是
d中是 Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
(5)①实验v的现象说明Ag+能氧化Γ,a中溶液呈棕黄色的原因是___________ (用电极反应式表示)。
②实验vi的实验现象不足以说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,小组同学设计实验并证实该依据,他们的实验方案是___________ ,现象是c中溶液较慢变浅黄色;电流计指针偏转。
小组同学根据实验v和实验vi,可推断氧化性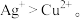
已知:①
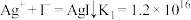 ;
;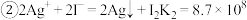
I.溶液准备
(1)配制
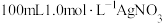 溶液,需使用的玻璃仪器有烧杯、胶头滴管、
溶液,需使用的玻璃仪器有烧杯、胶头滴管、II.通过置换反应比较
(2)向
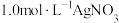 溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性
溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性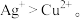 写出该反应的化学方程式是
写出该反应的化学方程式是Ⅲ.通过
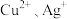 分别与同一物质反应进行比较
分别与同一物质反应进行比较| 编号 | 实验操作 | 现象 |
| 实验i | 向1.0mL1.0mol·L-1KI溶液中滴加1.0mL1.0mol·L-1AgNO3溶液 | 产生黄色沉淀,溶液无色 |
| 实验ii | 向1.0mL1.0mol·L-1KI溶液中滴加1.0mL0.5mol·L-1Cu(NO3)2溶液 | 产生白色沉淀A,溶液变黄色 |
②经检验,实验ii中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认白色沉淀A的实验iii如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有
b.白色沉淀A与AgNO3溶液反应的离子方程式是
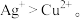
(4)分析“实验i”中Ag+未能氧化I-,而“实验ii”中Cu2+能氧化I-的原因。
①结合K值分析:因
②结合实验ii的反应方程式及其特点分析:
IV.通过设计原电池装置进行比较
电极均为石墨,KI和AgNO3溶液浓度均为
 d中是
d中是 Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:| 编号 | 实验iv | 实验v | 实验vi |
| 装置 | 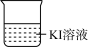 | 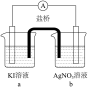 | 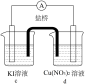 |
| 现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转 | c中溶液较慢变浅黄色;电流计指针偏转 |
②实验vi的实验现象不足以说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,小组同学设计实验并证实该依据,他们的实验方案是
小组同学根据实验v和实验vi,可推断氧化性
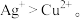
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。(部分产品未标出)
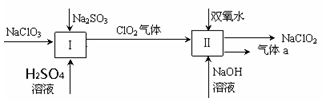
(1)Ⅰ中发生反应的还原剂是____________ 、Ⅱ中的氧化剂是________ (填化学式)。
(2)Ⅱ中反应的离子方程式是______________________________________ 。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+ 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是________ 。
②研究表明:在上述过程中会发生副反应:NaClO2+4HCl=NaCl+2Cl2↑+2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因是______ 。

(1)Ⅰ中发生反应的还原剂是
(2)Ⅱ中反应的离子方程式是
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+ 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是
②研究表明:在上述过程中会发生副反应:NaClO2+4HCl=NaCl+2Cl2↑+2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】(1)已知:2SO2(g)+ O2 (g)  2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) SO3 (g) +NO(g)的△H =
SO3 (g) +NO(g)的△H =_______ kJ·mol-1
一定条件下,将NO2与SO2按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______ 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d。每消耗1molSO3的同时生成1molNO2
(2)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g) CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _______ 0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_______ 。
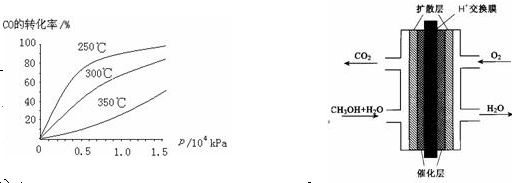
(3)甲醇(CH3OH)燃料电池的结构示意图如右上。甲醇进入_______ 极(填“正”或“负”),正极发生的电极反应为_______ 。
(4)101 kPa时,若16 gCH3OH完全燃烧生成液态水,放出热量为363.25 kJ/mol,则甲醇燃烧的热化学方程式为_______ 。
 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-12NO(g)+ O2 (g)
 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1则反应NO2(g)+ SO2 (g)
 SO3 (g) +NO(g)的△H =
SO3 (g) +NO(g)的△H =一定条件下,将NO2与SO2按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d。每消耗1molSO3的同时生成1molNO2
(2)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g)
 CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H 
(3)甲醇(CH3OH)燃料电池的结构示意图如右上。甲醇进入
(4)101 kPa时,若16 gCH3OH完全燃烧生成液态水,放出热量为363.25 kJ/mol,则甲醇燃烧的热化学方程式为
您最近一年使用:0次
【推荐2】氮氧化物是主要大气污染物,可采用多种方法消除,其中氢气选择性催化还原(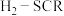 )是一种理想的方法。其相关反应如下:
)是一种理想的方法。其相关反应如下:
主反应: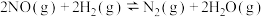

副反应: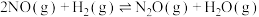

(1)已知:
 ,
,
 ,则
,则
_______ (用含有 和
和 的代数式表示)
的代数式表示)
(2)恒温条件下,将 、
、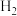 充入某恒容密闭容器中,在催化剂作用下进行反应。
充入某恒容密闭容器中,在催化剂作用下进行反应。
①下列有关说法错误 的是_______ 。(填字母序号)
a.当容器内的压强不再变化时说明主、副反应均达到平衡
b.平衡后,若向容器内再充入少量 ,主、副反应平衡常数均增大
,主、副反应平衡常数均增大
c.平衡后, 、
、 和
和 三者的物质的量之比保持不变
三者的物质的量之比保持不变
d.平衡后,
②在不同温度下,反应相同时间时测得混合气体中N2、 的体积分数随温度的变化关系如图所示,温度高于205℃时,
的体积分数随温度的变化关系如图所示,温度高于205℃时, 的体积分数随温度的升高而减小的原因可能
的体积分数随温度的升高而减小的原因可能_______ 。(答一点) 、
、 按物质的量比1:3充入某恒容密闭容器中,若平衡后
按物质的量比1:3充入某恒容密闭容器中,若平衡后 与
与 物质的量之比为3:1,
物质的量之比为3:1, 的转化率为80%,则
的转化率为80%,则 的有效去除率(转化为
的有效去除率(转化为 的
的 的量与起始量的比值)为
的量与起始量的比值)为_______ %, 的物质的量分数为
的物质的量分数为_______ %。(结果保留两位有效数字)
(4)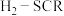 在
在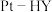 催化剂表面的反应机理如下图:
催化剂表面的反应机理如下图: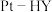 催化剂中,
催化剂中, 表面上形成的
表面上形成的 以
以 的形式被储存。随后在
的形式被储存。随后在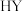 载体上,
载体上, 与
与 和
和 产生
产生 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。(已知发生反应的 、
、 物质的量之比为1:1)
物质的量之比为1:1)
(5)除了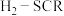 ,还有其他有效的方法消除氮氧化物,例如可用电解法将
,还有其他有效的方法消除氮氧化物,例如可用电解法将 转变为
转变为 ,其工作原理如图。M极为电解池的
,其工作原理如图。M极为电解池的_______ 极,N极的电极反应式为_______ 。
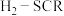 )是一种理想的方法。其相关反应如下:
)是一种理想的方法。其相关反应如下:主反应:
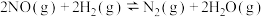

副反应:
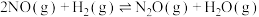

(1)已知:

 ,
,
 ,则
,则
 和
和 的代数式表示)
的代数式表示)(2)恒温条件下,将
 、
、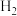 充入某恒容密闭容器中,在催化剂作用下进行反应。
充入某恒容密闭容器中,在催化剂作用下进行反应。①下列有关说法
a.当容器内的压强不再变化时说明主、副反应均达到平衡
b.平衡后,若向容器内再充入少量
 ,主、副反应平衡常数均增大
,主、副反应平衡常数均增大c.平衡后,
 、
、 和
和 三者的物质的量之比保持不变
三者的物质的量之比保持不变d.平衡后,

②在不同温度下,反应相同时间时测得混合气体中N2、
 的体积分数随温度的变化关系如图所示,温度高于205℃时,
的体积分数随温度的变化关系如图所示,温度高于205℃时, 的体积分数随温度的升高而减小的原因可能
的体积分数随温度的升高而减小的原因可能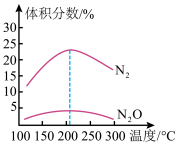
 、
、 按物质的量比1:3充入某恒容密闭容器中,若平衡后
按物质的量比1:3充入某恒容密闭容器中,若平衡后 与
与 物质的量之比为3:1,
物质的量之比为3:1, 的转化率为80%,则
的转化率为80%,则 的有效去除率(转化为
的有效去除率(转化为 的
的 的量与起始量的比值)为
的量与起始量的比值)为 的物质的量分数为
的物质的量分数为(4)
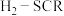 在
在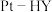 催化剂表面的反应机理如下图:
催化剂表面的反应机理如下图: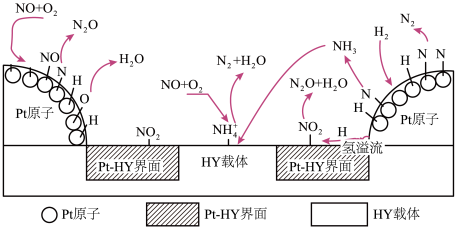
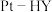 催化剂中,
催化剂中, 表面上形成的
表面上形成的 以
以 的形式被储存。随后在
的形式被储存。随后在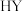 载体上,
载体上, 与
与 和
和 产生
产生 ,该反应的离子方程式为
,该反应的离子方程式为 、
、 物质的量之比为1:1)
物质的量之比为1:1)(5)除了
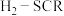 ,还有其他有效的方法消除氮氧化物,例如可用电解法将
,还有其他有效的方法消除氮氧化物,例如可用电解法将 转变为
转变为 ,其工作原理如图。M极为电解池的
,其工作原理如图。M极为电解池的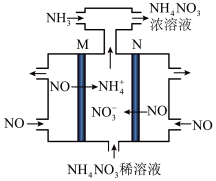
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】研究硫元素及其化合物的性质具有重要意义。
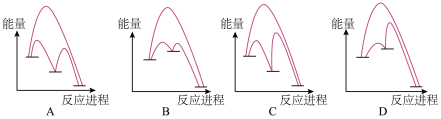
Ⅰ.已知I-可以催化二氧化硫与水溶液中发生的歧化反应:
3SO2(g)+2H2O(l) =2H2SO4(aq)+ S(s) △H<0,催化原理分为两步,
第一步反应为吸热的慢反应:SO2 + 4I-+ 4H+ = 2H2O + S↓+ 2I2
第二步反应为放热的快反应:2H2O + I2 +________ = ________ +________ + 2I-
(1)请补充第二步反应
(2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为_______________
Ⅱ. 工业制硫酸,在接触室发生反应2SO2(g) +O2(g) 2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:

(3)能证明反应已经达到平衡状态的是________________
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2V(SO3)正= V(O2)逆
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(4)反应的△H____________ 0(填“>”“<”或“=”)
(5)反应开始到10min时SO2的平均反应速率V(SO2) =_____________ mol/(L.min).
T2时该反应的平衡常数K=________________
(6)一定条件下在恒温恒容的密闭容器中按一定比例充入SO2 (g)和O2 (g),平衡时SO3的体积分数随n(SO2)/n(O2) 的变化图象如图B,则A、B、C 三状态中,SO2的转化率最小的是______________ 点,当n(SO2)/n(O2) =3 时,达到平衡状态SO3的体积分数可能是D、E、F三点中的_____ 点
Ⅰ.已知I-可以催化二氧化硫与水溶液中发生的歧化反应:
3SO2(g)+2H2O(l) =2H2SO4(aq)+ S(s) △H<0,催化原理分为两步,
第一步反应为吸热的慢反应:SO2 + 4I-+ 4H+ = 2H2O + S↓+ 2I2
第二步反应为放热的快反应:2H2O + I2 +
(1)请补充第二步反应
(2)能正确表示I-催化SO2歧化反应原理的能量变化示意图为

Ⅱ. 工业制硫酸,在接触室发生反应2SO2(g) +O2(g)
 2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
2SO3(g) 在1L的恒容密闭容器中充入2mol SO2和1mol O2,在不同温度下测得c(SO3)与时间的关系如图A:
(3)能证明反应已经达到平衡状态的是
①c(SO2):c(O2):c(SO3)=2:1:2
②单位时间内生成nmol SO3的同时消耗nmol SO2
③反应速率2V(SO3)正= V(O2)逆
④温度和体积一定时,容器内压强不再变化
⑤温度和压强一定时,混合气体的密度不再变化
(4)反应的△H
(5)反应开始到10min时SO2的平均反应速率V(SO2) =
T2时该反应的平衡常数K=
(6)一定条件下在恒温恒容的密闭容器中按一定比例充入SO2 (g)和O2 (g),平衡时SO3的体积分数随n(SO2)/n(O2) 的变化图象如图B,则A、B、C 三状态中,SO2的转化率最小的是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
(1)CO2的电子式是_____________ 。
(2)反应Ⅰ的平衡常数表达式是 K=______ 。
(3)对比①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________ ;
对比①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________ 。
(4)有利于提高CO2转化为CH3OH平衡 转化率的措施有____ 。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
反应Ⅰ CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1 反应Ⅱ CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
| 反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
| ① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| ② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
| ③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| ④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
(1)CO2的电子式是
(2)反应Ⅰ的平衡常数
(3)对比①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因
对比①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因
(4)有利于提高CO2转化为CH3OH
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】常温下,Ksp(BaCO3)=2.5×10-9,Ksp(BaSO4)=1.0×10-10,控制条件可实现如下沉淀转换:BaSO4(s)+CO (aq)
(aq) BaCO3(s)+SO
BaCO3(s)+SO (aq) ,该反应平衡常数K的表达式为:K=
(aq) ,该反应平衡常数K的表达式为:K=___________ ,欲用1LNa2CO3 溶液将0.01 mol BaSO4 全部转化为BaCO3,则Na2CO3 溶液的最初浓度应不低于___________ 。
 (aq)
(aq) BaCO3(s)+SO
BaCO3(s)+SO (aq) ,该反应平衡常数K的表达式为:K=
(aq) ,该反应平衡常数K的表达式为:K=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。
①该反应在常温下____________ 自发进行(填“能”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是______________ (填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
①实验1中以v(CO2) 表示的反应速率为________________ 。(取小数二位,下同)
②该反应为_____ (填“吸”或“放”)热反应,实验2条件下平衡常数K=________ 。
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是________________________ (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是___________ 。
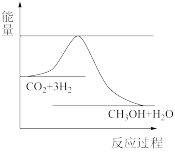
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:C(s)+H2O(g)
 CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1。①该反应在常温下
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.c(CO)=c(H2) d.密闭容器的容积不再改变
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)
 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为
②该反应为
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3min,则a、b应满足的关系是
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应: CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是
CH3OH(g)+H2O(g) ,如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c(CH3OH)增大的是
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
您最近一年使用:0次



