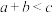利用催化技术可将汽车尾气中的 NO和 CO转变成CO2和N2,化学方程式:2NO(g)+2CO(g)  2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
下列说法中不正确的是
 2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
2CO2(g)+N2(g)。某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:
下列说法中不正确的是
| A.2 s内的平均反应速率 v(N2)=1.875×10-4 mol·L-1·s-1 |
| B.在该温度下,反应的平衡常数 K=5 |
| C.若将容积缩小为原来的一半, NO 转化率大于 90% |
| D.使用催化剂可以提高整个过程中 CO 和 NO 的处理量 |
更新时间:2017/10/20 08:21:18
|
相似题推荐
【推荐1】由γ-羟基丁酸生成γ-丁内酯的反应为HOCH2CH2CH2COOH
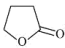 +H2O
+H2O  H<0,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如图所示:
H<0,在298K下,γ-羟基丁酸水溶液的初始浓度为0.180 mol·L-1,测得γ-丁内酯的浓度随时间变化的数据如图所示:
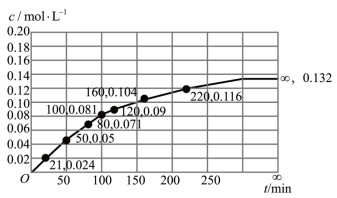
A.在50~80min内,以γ-丁内酯的浓度变化表示的反应速率为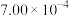 mol/(L⋅min) mol/(L⋅min) |
B.在25℃时,该反应的平衡常数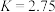 |
| C.加水降低γ-羟基丁酸的初始浓度,γ-羟基丁酸的平衡转化率减小 |
| D.使用非水溶剂并通过共沸回流移除体系中的水,有助于提高γ-丁内酯的平衡产率 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】在1 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
下列说法错误的是
 M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
| A.实验①中,若5 min时测得n(M) =0.05 mol,则0至5 min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min) |
| B.实验②中,该反应的平衡常数K=1.0 |
| C.实验③中,达到平衡时,X的转化率为60% |
| D.实验④中,达到平衡时,b>0.06 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】用 和
和 催化合成乙烯的反应原理为:
催化合成乙烯的反应原理为: ,向1L恒容密闭的催化反应器中充入
,向1L恒容密闭的催化反应器中充入 和
和 ,测得温度对
,测得温度对 的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
 和
和 催化合成乙烯的反应原理为:
催化合成乙烯的反应原理为: ,向1L恒容密闭的催化反应器中充入
,向1L恒容密闭的催化反应器中充入 和
和 ,测得温度对
,测得温度对 的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是
的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是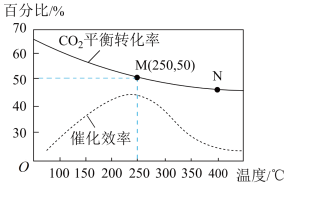
| A.容器内气体密度不变可以作为判断反应达到平衡状态的标志 |
| B.生成乙烯的速率:M点一定大于N点 |
C.250℃时,反应5min后达到平衡状态,则5min内 |
| D.升高温度,催化剂的催化效率降低 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】一个质量可不计的活塞将一定量的理想气体封闭在上端开口的直立圆筒形气缸内,活塞上堆放着铁砂,如图所示,气体柱的高度为H0,压强等于大气压强p0(状态一),此时活塞被下方的卡扣挡住,无法继续下落。后续操作中活塞可自由移动,现对气体缓慢加热,当气体温度升高了△T=60 K时,活塞开始上升(状态二),继续加热直到气柱高度为H=1.5H0(状态三)。 此后,维持温度不变,取走铁砂,气柱高度变为H2=1.8H0(状态四),求此时气体的温度(不计活塞与气缸之间的摩擦)
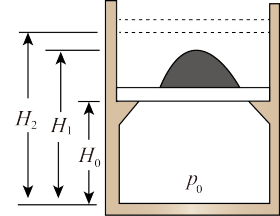

| A.480K | B.420 K | C.540 K | D.600 K |
您最近一年使用:0次
单选题-单题
|
较难
(0.4)
解题方法
【推荐2】向恒容密闭容器中通入物质的量浓度均为1.0 的
的 与
与 ,一定条件下发生反应:
,一定条件下发生反应:
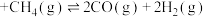 。测得平衡时
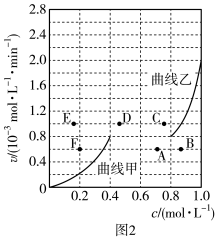
。测得平衡时 的体积分数与温度及压强的关系如图1所示。为探究速率与浓度的关系,根据相关实验数据,粗略地绘制出了两条速率—浓度关系曲线:
的体积分数与温度及压强的关系如图1所示。为探究速率与浓度的关系,根据相关实验数据,粗略地绘制出了两条速率—浓度关系曲线: ~
~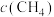 和
和 ~
~ ,如图2。
,如图2。
 的
的 与
与 ,一定条件下发生反应:
,一定条件下发生反应:
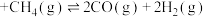 。测得平衡时
。测得平衡时 的体积分数与温度及压强的关系如图1所示。为探究速率与浓度的关系,根据相关实验数据,粗略地绘制出了两条速率—浓度关系曲线:
的体积分数与温度及压强的关系如图1所示。为探究速率与浓度的关系,根据相关实验数据,粗略地绘制出了两条速率—浓度关系曲线: ~
~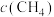 和
和 ~
~ ,如图2。
,如图2。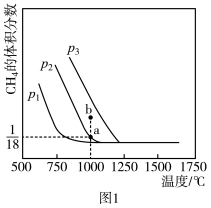
A.压强为 时,b点处 时,b点处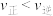 |
B.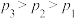 |
C.与曲线 ~ ~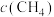 相对应的是图2中曲线甲 相对应的是图2中曲线甲 |
D.降低温度,反应重新达到平衡时, 、 、 相应的平衡点分别为B、F 相应的平衡点分别为B、F |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】在温度均为T℃的密闭容器中发生反应: 2SO2(g) + O2(g)  2SO3(g) ΔH<0。下列说法正确的是
2SO3(g) ΔH<0。下列说法正确的是
 2SO3(g) ΔH<0。下列说法正确的是
2SO3(g) ΔH<0。下列说法正确的是| 容器编号 | 容器类型 | 初始体积 | 起始物质的量/mol | 达平衡时SO3 物质的量/mol | 达平衡需要的时间/min | ||
| SO2 | O2 | SO3 | |||||
| Ⅰ | 恒温恒容 | 1.0 L | 2 | 1 | 0 | 1.6 | 5 |
| Ⅱ | 恒温恒压 | 1.0 L | 2 | 1 | 0 | a | t |
| A.a < 1.6 t < 5 |
| B.选择不同的催化剂,该反应的反应速率和平衡转化率都将不同 |
| C.反应达到平衡时,装置Ⅱ中SO2平均反应速率v = 0.32 mol·L-1·min-1 |
| D.若起始时向容器Ⅰ中充入1 mol SO2、0.2 mol O2和4 mol SO3,则反应不移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】甲、乙均为1 L的恒容密闭容器,向甲中充入1 mol CH4和1 mol CO2,乙中充入1 mol CH4和n mol CO2,在催化剂存在下发生反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是
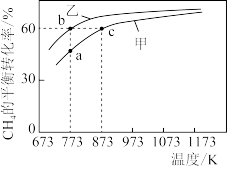

| A.该反应的正反应是放热反应 |
| B.773K时,该反应的平衡常数小于12.96 |
| C.H2的体积分数:φ(b)=φ(c) |
| D.873K时,向甲的平衡体系中再充入CO2、CH4各0.4mol,CO、H2各1.2 mol,平衡不发生移动 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】200℃时,向体积可变的密闭容器中加入足量草酸锰固体(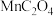 ),发生反应:
),发生反应: 。达到平衡时,
。达到平衡时,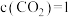 mol·L
mol·L 。温度不变,将体积缩小至原来的一半且保持不变,达到二次平衡。与第一次平衡相比,第二次平衡时,下列说法错误的是
。温度不变,将体积缩小至原来的一半且保持不变,达到二次平衡。与第一次平衡相比,第二次平衡时,下列说法错误的是
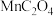 ),发生反应:
),发生反应: 。达到平衡时,
。达到平衡时,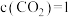 mol·L
mol·L 。温度不变,将体积缩小至原来的一半且保持不变,达到二次平衡。与第一次平衡相比,第二次平衡时,下列说法错误的是
。温度不变,将体积缩小至原来的一半且保持不变,达到二次平衡。与第一次平衡相比,第二次平衡时,下列说法错误的是| A.平衡常数不变 | B. 不变 不变 | C.MnO的质量不变 | D.逆反应速率增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
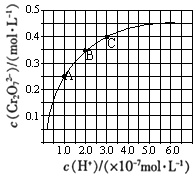
【推荐1】已知:2CrO42-+2H+ Cr2O72-+H2O。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法正确的是
Cr2O72-+H2O。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法正确的是
 Cr2O72-+H2O。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法正确的是
Cr2O72-+H2O。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法正确的是 
| A.平衡时,pH越小,c(Cr2O72-)越小 |
| B.A点CrO42-转化为Cr2O72-反应的平衡常数的数量级为1014 |
| C.C点CrO42-的平衡转化率为40% |
| D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7 mol•L-1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】在容积为2 L的恒容密闭容器中充入P(g)和Q(g),发生反应P(g)+2Q(g)⇌3R(g)+4S(s) ΔH。所得数据如下表:
下列说法正确的是
| 组号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| n(P) | n(Q) | n(R) | n(S) | ||
| ① | 500 | 0.10 | 0.80 | 0.24 | 0.32 |
| ② | 500 | 0.20 | 1.60 | x | 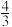 x x |
| ③ | 700 | 0.10 | 0.30 | 0.18 | 0.24 |
| A.该反应的ΔH>0 | B.反应达到平衡后增大压强,平衡逆向移动 |
| C.②中反应的平衡常数K=6.0 | D.根据题目信息不能确定x的值 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】已知某化学反应的平衡常数表达式为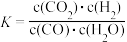 ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
下列有关叙述不正确的是
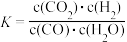 ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:| t/°C | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
A.该反应的化学方程式是CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) |
| B.上述反应的正反应是放热反应 |
C.若平衡浓度符合下列关系式: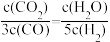 ,则此时的温度为1 000 °C ,则此时的温度为1 000 °C |
| D.在1L的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830°C,此时测得CO为0.4 mol,则该反应达到平衡状态 |
您最近一年使用:0次

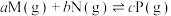 ,达到平衡时,测得M的浓度为
,达到平衡时,测得M的浓度为 ,在温度不变的条件下,仅将容器的体积压缩至原来的一半,反应再次达到平衡时,测得M的浓度为
,在温度不变的条件下,仅将容器的体积压缩至原来的一半,反应再次达到平衡时,测得M的浓度为 ,下列有关判断正确的是
,下列有关判断正确的是