碳酸氢钠广泛地应用于生产、实验和日常生活中。某课外小组同学通过查阅资料对碳酸氢钠的性质和制法进行了系列实验,请你参与探究。
(1)向NaHCO3溶液滴加MnCl2溶液生成沉淀MnCO3,离子方程式为______ 。
(2)向NaHCO3溶液加入少量的镁粉,观察到有气体和白色沉淀生成,则该气体一定是______ (填化学式),白色沉淀可能是:①MgCO3;②Mg(OH)2;③Mg2(OH)2CO3。欲证明白色沉淀为②,简单的实验方法为______ (操作、现象和结论)。
(3)电解Na2CO3溶液制NaHCO3的原理如左下图所示.
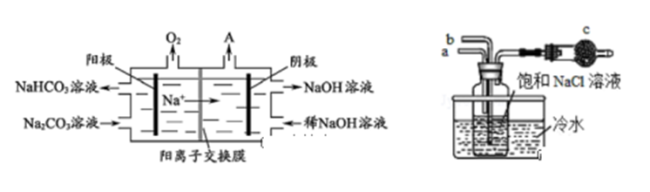
①电解初期,电解池中总反应方程式为______ 。
②若电解过程中透过交换膜的Na+为 0.4 mol,则阳极收集到 O2_____ L(标况)。
③电解后期溶液中的含碳微粒逐渐减少,此阶段阳极反应式为______ 。
(4)“侯氏制碱法”的原理是: NaCl+NH3+ CO2+H2O= NaHCO3+NH4Cl,模拟该制法的部分装置如右上图所示.
① 正确的操作是______ (填序号)。
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b通入NH3,然后a通入CO2,c中放碱石灰
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
② 水槽中的冷水起降温作用,这样有利于______ 。
(1)向NaHCO3溶液滴加MnCl2溶液生成沉淀MnCO3,离子方程式为
(2)向NaHCO3溶液加入少量的镁粉,观察到有气体和白色沉淀生成,则该气体一定是
(3)电解Na2CO3溶液制NaHCO3的原理如左下图所示.

①电解初期,电解池中总反应方程式为
②若电解过程中透过交换膜的Na+为 0.4 mol,则阳极收集到 O2
③电解后期溶液中的含碳微粒逐渐减少,此阶段阳极反应式为
(4)“侯氏制碱法”的原理是: NaCl+NH3+ CO2+H2O= NaHCO3+NH4Cl,模拟该制法的部分装置如右上图所示.
① 正确的操作是
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b通入NH3,然后a通入CO2,c中放碱石灰
D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
② 水槽中的冷水起降温作用,这样有利于
更新时间:2017-10-18 20:02:34
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】工业上利用生产磷肥的副产品高磷镍铁制备硫酸镍晶体NiSO4·6H2O。
(1)制备含Ni2+溶液
高磷镍铁 镍铁合金
镍铁合金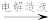 含Ni2+溶液
含Ni2+溶液
已知:i.高磷镍铁和镍铁合金中元素的百分含量:
ii.金属活动性:Fe>Co>Ni>H
①依据数据,“转炉吹炼”的主要目的是:富集镍元素,除去部分___________ 。
②“电解造液”时,用镍铁合金作阳极,H2SO4溶液作电解质溶液。电解过程中阴极产生的气体是___________ 。电解一段时间后,有少量Ni在阴极析出,为防止Ni析出降低NiSO4·6H2O的产率,可向电解质溶液中加入___________ (填试剂)。
(2)制备NiSO4·6H2O
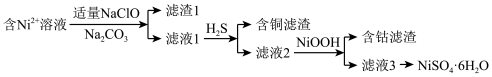
已知:常温下,金属离子完全转化为氢氧化物沉淀的pH:
①在酸性条件下,NaClO和Fe2+反应生成Fe3+和Cl—的离子方程式是___________ 。
②已知Ni(OH)2的Ksp为5.48×10-16,滤液1中c(Ni2+)=1.37mol/L。结合数据说明不能通过调节溶液的pH除去Cu2+的原因:___________ 。(已知:lg5=0.7)
③从滤液3中获取NiSO4·6H2O的操作是___________ 、洗涤、干燥。
(1)制备含Ni2+溶液
高磷镍铁
 镍铁合金
镍铁合金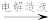 含Ni2+溶液
含Ni2+溶液已知:i.高磷镍铁和镍铁合金中元素的百分含量:
| 元素/% | Ni/% | Fe/% | P/% | Co/% | Cu/% |
| 高磷镍铁 | 4.58 | 70.40 | 16.12 | 0.22 | 0.34 |
| 镍铁合金 | 52.49 | 38.30 | 5.58 | 1.73 | 1.52 |
①依据数据,“转炉吹炼”的主要目的是:富集镍元素,除去部分
②“电解造液”时,用镍铁合金作阳极,H2SO4溶液作电解质溶液。电解过程中阴极产生的气体是
(2)制备NiSO4·6H2O

已知:常温下,金属离子完全转化为氢氧化物沉淀的pH:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | Co2+ | Ni2+ |
| 完全沉淀的pH | 2.8 | 8.3 | 6.7 | 9.4 | 8.9 |
②已知Ni(OH)2的Ksp为5.48×10-16,滤液1中c(Ni2+)=1.37mol/L。结合数据说明不能通过调节溶液的pH除去Cu2+的原因:
③从滤液3中获取NiSO4·6H2O的操作是
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ.在“碳达峰”、“碳中和”的国家战略下,工业生产废气和汽车尾气中的NOx和CO的减排及有效处理,显得尤为重要。在汽车上安装三元催化转化器可将NO和CO转化为无污染的气体。
(1)已知:
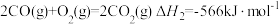

则三元转化器转化的热化学方程式为:___________ ,该反应在___________ (填“高温”“低温”或“任何温度”)下能自发进行。
Ⅱ.环氧乙烷(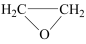 ,简称EO)是一种重要的工业原料和消毒剂。出乙烯经电解制备EO的原理示意图如下。
,简称EO)是一种重要的工业原料和消毒剂。出乙烯经电解制备EO的原理示意图如下。
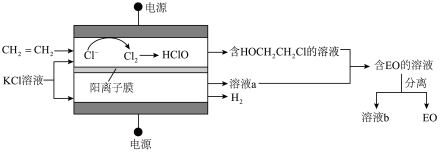
(2)阳极室产生Cl2后发生的反应有:___________ 、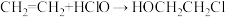 。
。
(3)一定条件下,反应物按一定流速通过该装置。电解效率和选择性S的定义: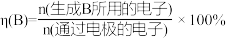 ,
, 。
。
①若η(EO)=100%,则溶液b的溶质为___________ 。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%,推测n(EO)≈70%的原因:
Ⅰ.阳极有H2O放电
Ⅱ.阳极有乙烯放电
Ⅲ.阳极室流出液中含有Cl2和HClO
i.检验电解产物,推测Ⅰ不成立。需要检验的物质是___________ 。
ii.假设没有生成EO的乙烯全部在阳极放电生成CO2,η(CO2)≈___________ %。经检验阳极放电产物没有CO2。
iii.实验证实推测Ⅲ成立,所用试剂及现象是___________ 。(可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液。)
(1)已知:

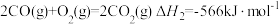

则三元转化器转化的热化学方程式为:
Ⅱ.环氧乙烷(
 ,简称EO)是一种重要的工业原料和消毒剂。出乙烯经电解制备EO的原理示意图如下。
,简称EO)是一种重要的工业原料和消毒剂。出乙烯经电解制备EO的原理示意图如下。
(2)阳极室产生Cl2后发生的反应有:
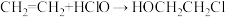 。
。(3)一定条件下,反应物按一定流速通过该装置。电解效率和选择性S的定义:
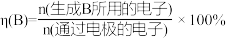 ,
, 。
。①若η(EO)=100%,则溶液b的溶质为
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%,推测n(EO)≈70%的原因:
Ⅰ.阳极有H2O放电
Ⅱ.阳极有乙烯放电
Ⅲ.阳极室流出液中含有Cl2和HClO
i.检验电解产物,推测Ⅰ不成立。需要检验的物质是
ii.假设没有生成EO的乙烯全部在阳极放电生成CO2,η(CO2)≈
iii.实验证实推测Ⅲ成立,所用试剂及现象是
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】 是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
Ⅰ.干法脱硫
(1)已知 的燃烧热
的燃烧热 (a>0),S的燃烧热
(a>0),S的燃烧热 (b>0),则常温下空气直接氧化脱除
(b>0),则常温下空气直接氧化脱除 的反应:
的反应: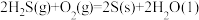

___________ kJ/mol。
(2)常用脱硫剂反应条件如下表,最佳脱硫剂为___________ 。
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的 气体,发生分解反应
气体,发生分解反应 ,控制不同的温度和压强,实验结果如图。
,控制不同的温度和压强,实验结果如图。
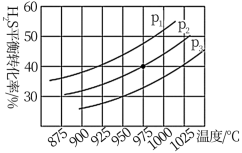
(3)图中压强P1、P2、P3由大到小的顺序为___________ ,该反应为___________ (填吸热”或“放热”)反应,若要进一步提高 的平衡转化率,可以采取的措施有
的平衡转化率,可以采取的措施有___________ (任写一种)。
(4)若压强为P2、温度为975℃, 的平衡常数
的平衡常数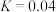 ,则起始
,则起始 的物质的量浓度c=
的物质的量浓度c=___________ mol/L,若向容器中再加入 气体,相同温度下再次达到平衡时,K
气体,相同温度下再次达到平衡时,K___________ 0.04(填“>”“<”或“=”)。
Ⅲ.间接电解法脱硫
通过 溶液吸收并氧化
溶液吸收并氧化 气体,再通过电解再生,实现循环使用,该法处理过程如图。
气体,再通过电解再生,实现循环使用,该法处理过程如图。
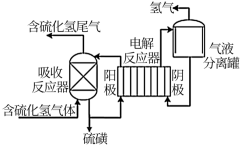
(5)电解反应器中总反应的离子方程式为___________ 。
 是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。
是石油化工行业产生的污染性气体,工业上采取多种方式进行处理。Ⅰ.干法脱硫
(1)已知
 的燃烧热
的燃烧热 (a>0),S的燃烧热
(a>0),S的燃烧热 (b>0),则常温下空气直接氧化脱除
(b>0),则常温下空气直接氧化脱除 的反应:
的反应: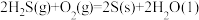

(2)常用脱硫剂反应条件如下表,最佳脱硫剂为
| 脱硫剂 | 出口硫(mg/m3) | 脱硫温度 | 操作压力 | 再生条件 |
| 一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸气再生 |
| 活性炭 | <1.33 | 常温 | 0~3.0 | 蒸气再生 |
| 氧化锌 | <1.33 | 350~400 | 0~3.0 | 不再生 |
在密闭容器中,充入一定量的
 气体,发生分解反应
气体,发生分解反应 ,控制不同的温度和压强,实验结果如图。
,控制不同的温度和压强,实验结果如图。
(3)图中压强P1、P2、P3由大到小的顺序为
 的平衡转化率,可以采取的措施有
的平衡转化率,可以采取的措施有(4)若压强为P2、温度为975℃,
 的平衡常数
的平衡常数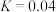 ,则起始
,则起始 的物质的量浓度c=
的物质的量浓度c= 气体,相同温度下再次达到平衡时,K
气体,相同温度下再次达到平衡时,KⅢ.间接电解法脱硫
通过
 溶液吸收并氧化
溶液吸收并氧化 气体,再通过电解再生,实现循环使用,该法处理过程如图。
气体,再通过电解再生,实现循环使用,该法处理过程如图。
(5)电解反应器中总反应的离子方程式为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2,装置如下图所示(有些夹持装置省略)。已知SO2Cl2的熔点为-54.1 ℃,沸点为69.1 ℃,遇水能发生剧烈的水解反应,并产生白雾。
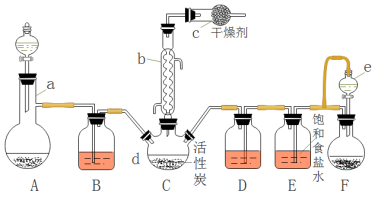
(1)仪器a的名称:____________ ,仪器e中的导管的作用是:_______________________ 。
(2)C中发生的反应方程式是:___________________________________ ,仪器c(注:小写字母表示)的作用是:___________________________________________________________ 。
(3)A装置是实验室制无色气体甲,其离子方程式:________________________ 。
(4)B中装的试剂是:________________ 。
(5)反应结束后,将C中产物分离的实验操作是____________ 。
(6)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静止得到无色溶液乙。写出该反应的离子方程式:_____________________________________ 。

(1)仪器a的名称:
(2)C中发生的反应方程式是:
(3)A装置是实验室制无色气体甲,其离子方程式:
(4)B中装的试剂是:
(5)反应结束后,将C中产物分离的实验操作是
(6)分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静止得到无色溶液乙。写出该反应的离子方程式:
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】乙酰乙酸乙酯是有机合成的中间体,用乙酸乙酯合成乙酰乙酸乙酯的原理如下:

主要反应试剂及产物的物理常数如下表:
已知:乙酰乙酸乙酯在95℃开始分解。
现用乙酸乙酯(含 乙醇)合成乙酰乙酸乙酯的步骤如下:
乙醇)合成乙酰乙酸乙酯的步骤如下:
①制钠珠:将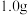 金属
金属 迅速切成薄片,放入
迅速切成薄片,放入 的三颈烧瓶中,并加入
的三颈烧瓶中,并加入 经过干燥的溶剂A,加热回流至熔融,装置如图1,拆去回流装置,用橡皮塞塞住瓶口,用力振摇即得细粒状钠珠。稍冷分离回收溶剂A。
经过干燥的溶剂A,加热回流至熔融,装置如图1,拆去回流装置,用橡皮塞塞住瓶口,用力振摇即得细粒状钠珠。稍冷分离回收溶剂A。
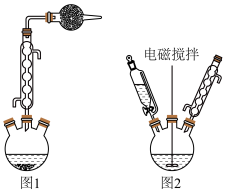
②加酯回流:从图2装置的恒压滴液漏斗中加入10mL乙酸乙酯于盛有钠珠的三颈烧瓶中,装上回流装置,开启电磁搅拌棒,回流至钠消失,得橘红色溶液。
③酸化:向橘红色溶液中加入50%醋酸使其呈弱酸性(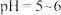 )。
)。
④分液:将反应液转入分液漏斗,加入等体积的饱和氯化钠溶液,振摇,静置,分液。将有机层倒入锥形瓶中,并加适量的无水 充分振荡。
充分振荡。
⑤蒸馏:将步骤④所得有机混合液水浴加热蒸馏出未反应的乙酸乙酯,停止蒸馏,冷却。再将蒸馏得到的剩余物进行减压蒸馏,收集馏分。
回答下列问题:
(1)步骤①中溶剂A最好选择_______ (填标号)。
a.乙醇 b.水 c.二甲苯 d.苯
(2)分离回收溶剂A采用的方法是_______ (填标号)。
a.蒸馏 b.分液 c.蒸发 d.倾倒法
(3)乙醇钠是制备乙酰乙酸乙酯的催化剂,写出生成乙醇钠的化学方程式_______ ,乙酸乙酯中乙醇含量过少或过多均不利于乙酰乙酸乙酯的生成,原因是_______ 。
(4)步骤④中加入饱和氯化钠溶液的目的是_______ ,加入无水 的作用是
的作用是_______ 。
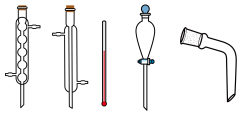
(5)下列仪器在步骤⑤中无需使用的是_______ (填名称);采用减压蒸馏获得乙酰乙酸乙酯的原因_______ 。

主要反应试剂及产物的物理常数如下表:
| 名称 | 熔点 | 沸点 | 密度 | 溶解度 | ||
 | 乙醇 | 乙醚 | ||||
| 苯 | 5.5 | 80.1 | 0.88 | 不溶 | 互溶 | 互溶 |
| 二甲苯 |  | 144.4 | 0.8802 | 不溶 | 互溶 | 互溶 |
| 乙酸乙酯 | 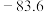 | 77.1 | 0.9003 | 难溶 | 互溶 | 互溶 |
| 金属钠 | 97.82 | 881.4 | 0.968 | 反应 | 反应 | 不溶 |
| 乙酰乙酸乙酯 |  | 180.4 | 1.0282 | 微溶 | 互溶 | 互溶 |
现用乙酸乙酯(含
 乙醇)合成乙酰乙酸乙酯的步骤如下:
乙醇)合成乙酰乙酸乙酯的步骤如下:①制钠珠:将
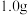 金属
金属 迅速切成薄片,放入
迅速切成薄片,放入 的三颈烧瓶中,并加入
的三颈烧瓶中,并加入 经过干燥的溶剂A,加热回流至熔融,装置如图1,拆去回流装置,用橡皮塞塞住瓶口,用力振摇即得细粒状钠珠。稍冷分离回收溶剂A。
经过干燥的溶剂A,加热回流至熔融,装置如图1,拆去回流装置,用橡皮塞塞住瓶口,用力振摇即得细粒状钠珠。稍冷分离回收溶剂A。
②加酯回流:从图2装置的恒压滴液漏斗中加入10mL乙酸乙酯于盛有钠珠的三颈烧瓶中,装上回流装置,开启电磁搅拌棒,回流至钠消失,得橘红色溶液。
③酸化:向橘红色溶液中加入50%醋酸使其呈弱酸性(
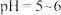 )。
)。④分液:将反应液转入分液漏斗,加入等体积的饱和氯化钠溶液,振摇,静置,分液。将有机层倒入锥形瓶中,并加适量的无水
 充分振荡。
充分振荡。⑤蒸馏:将步骤④所得有机混合液水浴加热蒸馏出未反应的乙酸乙酯,停止蒸馏,冷却。再将蒸馏得到的剩余物进行减压蒸馏,收集馏分。
回答下列问题:
(1)步骤①中溶剂A最好选择
a.乙醇 b.水 c.二甲苯 d.苯
(2)分离回收溶剂A采用的方法是
a.蒸馏 b.分液 c.蒸发 d.倾倒法
(3)乙醇钠是制备乙酰乙酸乙酯的催化剂,写出生成乙醇钠的化学方程式
(4)步骤④中加入饱和氯化钠溶液的目的是
 的作用是
的作用是(5)下列仪器在步骤⑤中无需使用的是

您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
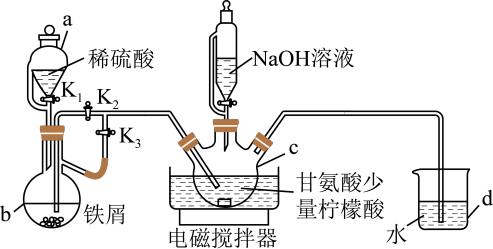
【推荐3】实验室利用甘氨酸与硫酸亚铁制备补铁剂甘氨酸亚铁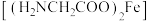 ,装置如图所示(夹持仪器省略)。
,装置如图所示(夹持仪器省略)。
已知:I.有关物质性质如下表所示:
II.甘氨酸亚铁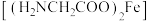 摩尔质量为
摩尔质量为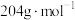
III.氨基能被酸性 溶液氧化为硝基:
溶液氧化为硝基: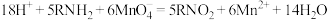
(1)连接好装置,装入药品,进行的操作为:
①打开 、
、 ,反应一段时间,将装置中空气排净;
,反应一段时间,将装置中空气排净;
②___________ ,使b中溶液进入c中;
③在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5~6.0,使反应物充分反应;
④反应完成后,向c中反应混合液中加入乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品。
(2)仪器c的名称是___________ ,其中加入柠檬酸的作用是___________ ,步骤④中加入乙醇,溶液的极性___________ (填“增强”、“减弱”或“不变”)。
(3)生成甘氨酸亚铁的化学方程式是___________ 。
(4)体系pH与产率之间的关系如下表
pH过高或过低,产品产率均下降的原因是:___________ 。
(5)产品纯度测定。已知粗产品通常混有甘氨酸,称取粗产品2.2克,先加入___________ ,搅拌、过滤、洗涤得沉淀,将沉淀配成250mL溶液,取溶液25.00mL置于锥形瓶,用 的
的 溶液滴定至终点,三次平均消耗
溶液滴定至终点,三次平均消耗 体积为26.00mL,则该样品的纯度为
体积为26.00mL,则该样品的纯度为___________ 。
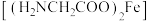 ,装置如图所示(夹持仪器省略)。
,装置如图所示(夹持仪器省略)。
已知:I.有关物质性质如下表所示:
| 甘氨酸 | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸中的溶解度大于在乙醇中的溶解度 |
| 柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性 |
| 甘氨酸亚铁 | 易溶于水,难溶于乙醇、冰醋酸 |
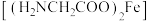 摩尔质量为
摩尔质量为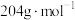
III.氨基能被酸性
 溶液氧化为硝基:
溶液氧化为硝基: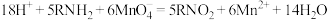
(1)连接好装置,装入药品,进行的操作为:
①打开
 、
、 ,反应一段时间,将装置中空气排净;
,反应一段时间,将装置中空气排净;②
③在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5~6.0,使反应物充分反应;
④反应完成后,向c中反应混合液中加入乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品。
(2)仪器c的名称是
(3)生成甘氨酸亚铁的化学方程式是
(4)体系pH与产率之间的关系如下表
| 体系pH | 4.0 | 4.5 | 5.0 | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| 产率(%) | 65.70 | 74.92 | 78.67 | 86.65 | 88.07 | 74.97 | 62.31 | 55.98 |
(5)产品纯度测定。已知粗产品通常混有甘氨酸,称取粗产品2.2克,先加入
 的
的 溶液滴定至终点,三次平均消耗
溶液滴定至终点,三次平均消耗 体积为26.00mL,则该样品的纯度为
体积为26.00mL,则该样品的纯度为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】金属锰(Mn)与盐酸反应可生成H2和MnCl2,某实验小组利用如图装置制备少量Mn(OH)2。已知Mn2+在酸性溶液中很稳定,但在碱性环境易被氧化。
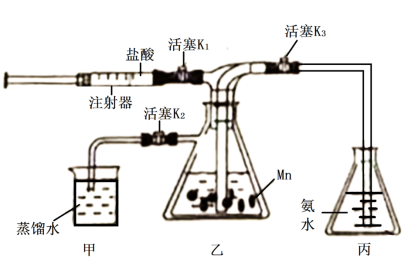
回答下列问题:
(1)实验前,检验装置乙的气密性的方法是________________________ 。
(2)实验过程中配制药品所使用的蒸馏水均需__________ (填写处理方式),以便除去水中的溶解氧。
(3)用注射器代替分液漏斗加入盐酸,除了更好的控制盐酸的加入量外,其优点还有______________________ (任写一点)。
(4)实验前需要利用生成的氢气排出装置中的空气,其操作为_____________________ 。
(5)装置丙因为是开放体系,生成的Mn(OH)2容易被氧化,可改进的措施是__________________________________________________ 。
(6)过滤出Mn(OH)2水洗后需要用乙醚洗涤,利用乙醚(熔点:-116.3 ℃、沸点:34.6 ℃)洗涤的目的_________________________________________________________ 。
(7)Mn(OH)2碱性悬浊液常用于测定水体中溶解氧的含量(DO值),其步骤如下:
步骤I:用注射器吸取100.00 mL.水样与Mn(OH)2碱性悬浊液混合,将水样中的Mn(OH)2氧化为MnO(OH)2;
步骤II:向步骤I反应后的溶液中注入一定量的硫酸和过量NaI溶液,利用NaI将MnO(OH)2还原为Mn2+;
步骤III:向步骤II反应后的溶液中加入2滴淀粉溶液,用0.005 mol/L的Na2S2O3溶液滴定步骤II生成的I2,消耗22.50 mL Na2S2O3溶液(2S2O +I2=2I-+S2O
+I2=2I-+S2O )。
)。
①写出步骤II的离子方程式:___________________________________ 。
②水样中的含氧量为__________ mg·L-1(保留一位小数)。

回答下列问题:
(1)实验前,检验装置乙的气密性的方法是
(2)实验过程中配制药品所使用的蒸馏水均需
(3)用注射器代替分液漏斗加入盐酸,除了更好的控制盐酸的加入量外,其优点还有
(4)实验前需要利用生成的氢气排出装置中的空气,其操作为
(5)装置丙因为是开放体系,生成的Mn(OH)2容易被氧化,可改进的措施是
(6)过滤出Mn(OH)2水洗后需要用乙醚洗涤,利用乙醚(熔点:-116.3 ℃、沸点:34.6 ℃)洗涤的目的
(7)Mn(OH)2碱性悬浊液常用于测定水体中溶解氧的含量(DO值),其步骤如下:
步骤I:用注射器吸取100.00 mL.水样与Mn(OH)2碱性悬浊液混合,将水样中的Mn(OH)2氧化为MnO(OH)2;
步骤II:向步骤I反应后的溶液中注入一定量的硫酸和过量NaI溶液,利用NaI将MnO(OH)2还原为Mn2+;
步骤III:向步骤II反应后的溶液中加入2滴淀粉溶液,用0.005 mol/L的Na2S2O3溶液滴定步骤II生成的I2,消耗22.50 mL Na2S2O3溶液(2S2O
 +I2=2I-+S2O
+I2=2I-+S2O )。
)。①写出步骤II的离子方程式:
②水样中的含氧量为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
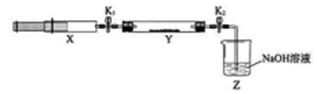
【推荐2】(1)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究:收集足量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
(2) 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示。
①读取装置B中收集到的气体体积时,需移动乙管与甲管中液面相齐,其目的是 。
②据报道高锰酸钾受热分解不产生MnO2,已知产气率= ×100%。若只发生KMnO4
×100%。若只发生KMnO4 KMnO2+O2↑,则产气率为 。
KMnO2+O2↑,则产气率为 。
③XRD谱显示还会分解产生K2MnO4和K2Mn4O8,写出分解产生这两种物质及氧气的化学方程式: 。

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ③_______________ | ④______________ |

(2) 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示。
①读取装置B中收集到的气体体积时,需移动乙管与甲管中液面相齐,其目的是 。
②据报道高锰酸钾受热分解不产生MnO2,已知产气率=
 ×100%。若只发生KMnO4
×100%。若只发生KMnO4 KMnO2+O2↑,则产气率为 。
KMnO2+O2↑,则产气率为 。③XRD谱显示还会分解产生K2MnO4和K2Mn4O8,写出分解产生这两种物质及氧气的化学方程式: 。
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】颗粒大小达到纳米级的单质铁俗称“纳米铁”,可用作手机辐射屏蔽材料。实验室的制备方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2反应生成“纳米铁”,实验装置如下图。请回答:
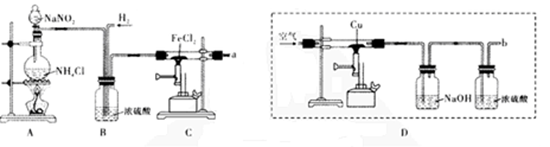
(1)A装置用于制取氮气,反应的化学方程式为_________ 。
(2)实验时,应先将____ (填“N2”或“H2”)通入C装置,反应生成“纳米铁”的化学方程式为;实验中需要保护气的原因是_________ 。
(3)a导管口的气态产物除HCl外还可能有_________ (填化学式)。
(4)利用D装置也可以得到较纯净的氮气。但科学家发现,采用此方法在b导管口得到的氮气在相同条件下比原方法得到的氮气密度略大,原因是_________ (假设上述实验设计与操作均无错误,且氮气已完全干燥);若开始加入的铜粉质量为3.84 g,持续通入空气至铜粉全部反应,冷却后固体质量为4.48 g,则固体的成分为_________ ,反应的化学方程式为_____ .

(1)A装置用于制取氮气,反应的化学方程式为
(2)实验时,应先将
(3)a导管口的气态产物除HCl外还可能有
(4)利用D装置也可以得到较纯净的氮气。但科学家发现,采用此方法在b导管口得到的氮气在相同条件下比原方法得到的氮气密度略大,原因是
您最近半年使用:0次



