在工业上常用CO和H2合成甲醇,反应方程式为:
CO(g)+2H2(g) CH3OH(g)△H = akJ/mol
CH3OH(g)△H = akJ/mol
已知:①CO(g)+ O2(g)== CO2(g)△H1=﹣283.0kJ/mol
O2(g)== CO2(g)△H1=﹣283.0kJ/mol
②H2(g)+ O2(g)== H2O(g)△H2=﹣241.8kJ/mol
O2(g)== H2O(g)△H2=﹣241.8kJ/mol
③CH3OH(g)+ O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
回答下列问题:
(1)a =_______
(2)能说明反应CO(g)+2H2(g) CH3OH(g)已达平衡状态的是
CH3OH(g)已达平衡状态的是___ (填字母)。
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与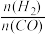 的关系如图1所示.
的关系如图1所示.
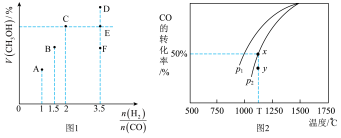
①当起始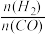 =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=_____________ 。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____________ (选填“增大”、“减小”或“不变”);
②当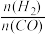 = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的_______ 点(选填“D”、“E”或“F”)。
(4)CO和H2来自于天然气。已知CO2(g)+CH4(g) 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1_______________ p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)______________ v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp=_________ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)含有甲醇的废水会造成环境污染,可通入ClO2气体将其氧化为CO2。写出相关反应的离子方程式_________________________________________ 。
CO(g)+2H2(g)
 CH3OH(g)△H = akJ/mol
CH3OH(g)△H = akJ/mol已知:①CO(g)+
 O2(g)== CO2(g)△H1=﹣283.0kJ/mol
O2(g)== CO2(g)△H1=﹣283.0kJ/mol②H2(g)+
 O2(g)== H2O(g)△H2=﹣241.8kJ/mol
O2(g)== H2O(g)△H2=﹣241.8kJ/mol③CH3OH(g)+
 O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol
O2(g)== CO2(g)+ 2H2O(g)△H3=﹣192.2kJ/mol回答下列问题:
(1)a =
(2)能说明反应CO(g)+2H2(g)
 CH3OH(g)已达平衡状态的是
CH3OH(g)已达平衡状态的是A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与
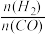 的关系如图1所示.
的关系如图1所示.
①当起始
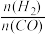 =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=②当
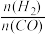 = 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的
= 3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的(4)CO和H2来自于天然气。已知CO2(g)+CH4(g)
 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1mol•L﹣1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1(5)含有甲醇的废水会造成环境污染,可通入ClO2气体将其氧化为CO2。写出相关反应的离子方程式
更新时间:2017-11-11 10:40:15
|
相似题推荐
【推荐1】CO在工农业生产中有广泛用途。
Ⅰ.将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要化学反应为: 。C、CO和H2燃烧热化学方程式分别为:
。C、CO和H2燃烧热化学方程式分别为:
①
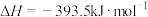
②
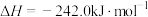
③
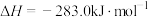
(1)请根据以上数据,写出碳与水蒸气反应的热化学方程式:___________ 。
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量___________ (填“多”或“少”)。下图为根据盖斯定律作出的循环图,请写出ΔH1、ΔH2、ΔH3、ΔH4之间存在的关系式___________ 。

Ⅱ.某科研机构设计了利用CO在催化剂条件下还原NOx(以NO2为例)的方案 ,已知:向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入4molNO2(g)和4molCO(g),反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:
,已知:向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入4molNO2(g)和4molCO(g),反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:
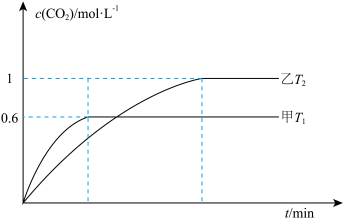
(3)①T1___________ T2,△H_______ 0(填“>”或“<”)。
②T1温度下,平衡时NO2的转化率为___________ 。
(4)工业上可用CO制备甲醇(CH3OH)。原理为: ,达到平衡后,若改变某个条件使平衡向正反应方向移动,则下列说法中正确的有
,达到平衡后,若改变某个条件使平衡向正反应方向移动,则下列说法中正确的有_______ (填字母)
A.反应物的转化率可能增大 B.正反应速率一定大于逆反应速率
C.生成物的体积分数一定增加 D.反应物的浓度一定降低
E.容器中混合气体平均摩尔质量一定不变
Ⅰ.将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要化学反应为:
 。C、CO和H2燃烧热化学方程式分别为:
。C、CO和H2燃烧热化学方程式分别为:①

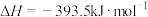
②

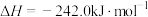
③

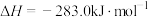
(1)请根据以上数据,写出碳与水蒸气反应的热化学方程式:
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量

Ⅱ.某科研机构设计了利用CO在催化剂条件下还原NOx(以NO2为例)的方案
 ,已知:向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入4molNO2(g)和4molCO(g),反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:
,已知:向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入4molNO2(g)和4molCO(g),反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:
(3)①T1
②T1温度下,平衡时NO2的转化率为
(4)工业上可用CO制备甲醇(CH3OH)。原理为:
 ,达到平衡后,若改变某个条件使平衡向正反应方向移动,则下列说法中正确的有
,达到平衡后,若改变某个条件使平衡向正反应方向移动,则下列说法中正确的有A.反应物的转化率可能增大 B.正反应速率一定大于逆反应速率
C.生成物的体积分数一定增加 D.反应物的浓度一定降低
E.容器中混合气体平均摩尔质量一定不变
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】二甲醚CH3OCH3是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:
①CO(g) + 2H2(g) CH3OH(g) △H=-90.8kJ·mol-1
CH3OH(g) △H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g) △H=-23.5kJ·mol-1
CH3OCH3(g)+ H2O(g) △H=-23.5kJ·mol-1
③CO(g)+ H2O(g) CO2(g) + H2(g) △H=-41.3 kJ·mol-1
CO2(g) + H2(g) △H=-41.3 kJ·mol-1
写出H2和CO合成二甲醚和CO2的热化学方程式为_________ 。
(2)对于反应a. CO(g) + 2H2(g) CH3OH (g) ,
CH3OH (g) ,
①不同温度对CO转化率及催化剂的催化效率的影响如图甲所示,下列有关说法不正确的是______ (填序号)
A.不同条件下反应,N 点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,甲醇的产量M点比N高
D.生产中采取P点条件好于M点
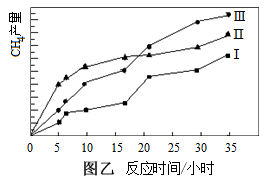
②图乙为在一定温度下使用不同催化剂时反应时间与甲醇产量的关系,0-15分钟内甲醇的平均生成速率VⅠ、VⅡ、VⅢ从大到小的顺序为___________
(3)反应b.2CH3OH(g) CH3OCH3(g)+H2O(g),某温度下的平衡常数为400,此温度下,在密闭容器中加入各物质的浓度如下:
CH3OCH3(g)+H2O(g),某温度下的平衡常数为400,此温度下,在密闭容器中加入各物质的浓度如下:
若经10min反应达到平衡,则0~10min的甲醇反应速率__________ 。
(4)一定条件下反应a生成的甲醇与CO可以生成乙酸,常温下将amol/L的醋酸与bmol/LBa(oh)2溶液以2:1体积比混合,混合溶液中2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离平衡常数为________ .
(1)利用水煤气合成二甲醚的三步反应如下:
①CO(g) + 2H2(g)
 CH3OH(g) △H=-90.8kJ·mol-1
CH3OH(g) △H=-90.8kJ·mol-1 ②2CH3OH(g)
 CH3OCH3(g)+ H2O(g) △H=-23.5kJ·mol-1
CH3OCH3(g)+ H2O(g) △H=-23.5kJ·mol-1 ③CO(g)+ H2O(g)
 CO2(g) + H2(g) △H=-41.3 kJ·mol-1
CO2(g) + H2(g) △H=-41.3 kJ·mol-1 写出H2和CO合成二甲醚和CO2的热化学方程式为
(2)对于反应a. CO(g) + 2H2(g)
 CH3OH (g) ,
CH3OH (g) , ①不同温度对CO转化率及催化剂的催化效率的影响如图甲所示,下列有关说法不正确的是
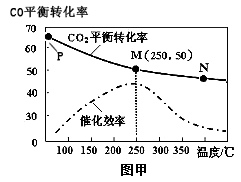
A.不同条件下反应,N 点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,甲醇的产量M点比N高
D.生产中采取P点条件好于M点
②图乙为在一定温度下使用不同催化剂时反应时间与甲醇产量的关系,0-15分钟内甲醇的平均生成速率VⅠ、VⅡ、VⅢ从大到小的顺序为
(3)反应b.2CH3OH(g)
 CH3OCH3(g)+H2O(g),某温度下的平衡常数为400,此温度下,在密闭容器中加入各物质的浓度如下:
CH3OCH3(g)+H2O(g),某温度下的平衡常数为400,此温度下,在密闭容器中加入各物质的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
若经10min反应达到平衡,则0~10min的甲醇反应速率
(4)一定条件下反应a生成的甲醇与CO可以生成乙酸,常温下将amol/L的醋酸与bmol/LBa(oh)2溶液以2:1体积比混合,混合溶液中2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离平衡常数为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g) 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g) 2NH3(g) △H=
2NH3(g) △H=___________ kJ·mol-1。
(2)在恒温恒容容积为a L的密闭容器中进行合成氨的反应,起始加入N2 1.0 molH23.0 mol。
①该温度下合成氨反应的平衡常数表达式为__________________ ;
②经过2min达到化学平衡状态时测得H2的转化率为40%,则平均化学反应速率v(NH3)__________ ;
③若其它条件不变增大压强,则合成氨反应的化学平衡常数____________ (填“变大”、“变小或“不变”);
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2 (g)的平衡转化率随X的变化关系。
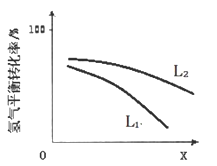
i .X代表的物理量是________________ ,
ii.判断L1、L2的大小关系____________ (填“>”“ <”或“ = ”),并简述理由:______________ 。
(1)已知25℃时:N2(g)+O2(g)
 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-12H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g)
 2NH3(g) △H=
2NH3(g) △H=(2)在恒温恒容容积为a L的密闭容器中进行合成氨的反应,起始加入N2 1.0 molH23.0 mol。
①该温度下合成氨反应的平衡常数表达式为
②经过2min达到化学平衡状态时测得H2的转化率为40%,则平均化学反应速率v(NH3)
③若其它条件不变增大压强,则合成氨反应的化学平衡常数
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2 (g)的平衡转化率随X的变化关系。

i .X代表的物理量是
ii.判断L1、L2的大小关系
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】甲烷广泛存在于天然气、沼气、煤矿坑气之中,是优质的气体燃料,更是制造许多化工产品的重要原料。
Ⅰ.制取氢气
已知:CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.2kJ·mol-1
CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+247.4kJ·mol-1
2CO(g)+2H2(g) △H=+247.4kJ·mol-1
(1)请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式___________________
(2)若将0.1mol CH4和0.1mol H2O(g)通入体积为10L的密闭容器里,在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
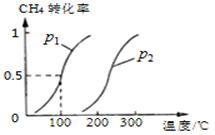
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率_________ ;
②该反应的化学平衡常数___________________ ;
③图中的p1_________ p2(填“<”、“>”或“=”);
Ⅱ.制备甲醇
(3)在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g) △H<0。若容器容积不变,下列措施可增加甲醇产率的是
CH3OH(g) △H<0。若容器容积不变,下列措施可增加甲醇产率的是________ ;
E.使用更高效的催化剂
Ⅲ.合成乙酸
(4)甲烷直接合成乙酸具有重要的理论意义和应用价值。光催化反应技术使用CH4和__________ (填化学式)直接合成乙酸,且符合“绿色化学”的要求(原子利用率100℅)。
Ⅰ.制取氢气
已知:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H=+206.2kJ·mol-1
CO(g)+3H2(g) △H=+206.2kJ·mol-1CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H=+247.4kJ·mol-1
2CO(g)+2H2(g) △H=+247.4kJ·mol-1(1)请写出CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式
(2)若将0.1mol CH4和0.1mol H2O(g)通入体积为10L的密闭容器里,在一定条件下发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
CO(g)+3H2(g),CH4的平衡转化率与温度、压强的关系如图
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率
②该反应的化学平衡常数
③图中的p1
Ⅱ.制备甲醇
(3)在压强为0.1MPa条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g) △H<0。若容器容积不变,下列措施可增加甲醇产率的是
CH3OH(g) △H<0。若容器容积不变,下列措施可增加甲醇产率的是| A.升高温度 |
| B.再充入1mol CO和3mol H2 |
| C.将CH3OH(g)从体系中分离 |
| D.充入He,使体系总压强增大 |
E.使用更高效的催化剂
Ⅲ.合成乙酸
(4)甲烷直接合成乙酸具有重要的理论意义和应用价值。光催化反应技术使用CH4和
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】密闭容器中加入4molA、1.2molC和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。

(1)若t1=15s,则t0~t1阶段的反应速率为υ(C)=___________ 。
(2)t4时刻改变的条件为_____________ 。
(3)已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q 为正值),试写出该反应的热化学方程式:__________________________

(1)若t1=15s,则t0~t1阶段的反应速率为υ(C)=
(2)t4时刻改变的条件为
(3)已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q 为正值),试写出该反应的热化学方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g) 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g) 2NH3(g) △H=
2NH3(g) △H=___________ kJ·mol-1。
(2)在恒温恒容容积为a L的密闭容器中进行合成氨的反应,起始加入N2 1.0 molH23.0 mol。
①该温度下合成氨反应的平衡常数表达式为__________________ ;
②经过2min达到化学平衡状态时测得H2的转化率为40%,则平均化学反应速率v(NH3)__________ ;
③若其它条件不变增大压强,则合成氨反应的化学平衡常数____________ (填“变大”、“变小或“不变”);
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2 (g)的平衡转化率随X的变化关系。

i .X代表的物理量是________________ ,
ii.判断L1、L2的大小关系____________ (填“>”“ <”或“ = ”),并简述理由:______________ 。
(1)已知25℃时:N2(g)+O2(g)
 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-12H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g)
 2NH3(g) △H=
2NH3(g) △H=(2)在恒温恒容容积为a L的密闭容器中进行合成氨的反应,起始加入N2 1.0 molH23.0 mol。
①该温度下合成氨反应的平衡常数表达式为
②经过2min达到化学平衡状态时测得H2的转化率为40%,则平均化学反应速率v(NH3)
③若其它条件不变增大压强,则合成氨反应的化学平衡常数
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2 (g)的平衡转化率随X的变化关系。

i .X代表的物理量是
ii.判断L1、L2的大小关系
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:

则CO2与H2反应生成CH3OH的热化学方程式为_____________________
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g) CO(g)+3H2(g)△H1>0
CO(g)+3H2(g)△H1>0
Ⅱ.CO(g)+2H2(g) CH3OH(g)△H2<0
CH3OH(g)△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。

①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为________ ;
②图中的p1_______ p2(填“<”、“>”或“=”),判断的理由是________________________ 。
③若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是_________ (填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol·L﹣1)变化如下表所示:
若5min时只改变了某一条件,则所改变的条件是_____________ ;10min时测得各物质浓度如表,10min时v正_______ v逆(填“<”、“>”或“=”)。
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:

则CO2与H2反应生成CH3OH的热化学方程式为
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)
 CO(g)+3H2(g)△H1>0
CO(g)+3H2(g)△H1>0Ⅱ.CO(g)+2H2(g)
 CH3OH(g)△H2<0
CH3OH(g)△H2<0将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。

①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的p1
③若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的总物质的量不变
d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol·L﹣1)变化如下表所示:
| 2min | 5min | 10min | |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】在2 L密闭容器中800 ℃时反应2NO+O2 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:
(1)如图表示各物质浓度的变化曲线,A点处,v(正)________ v(逆),A点正反应速率________ B点正反应速率。(用“大于”“小于”或“等于”填空)
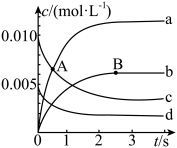
(2)图中表示O2变化的曲线是__________ 。用NO2表示从0~2 s内该反应的平均速率v=______ 。
(3)能说明该反应已经达到平衡状态的是________ 。
a.容器内压强保持不变 b.v(NO)=2v(O2) c.容器内的密度保持不变 d.v逆(NO2)=2v正(O2)
e. 混合气体的平均摩尔质量不再发生变化
(4)能使该反应的反应速率增大的是________ 。
a.适当升高温度 b.及时分离出NO2气体 c.增大NO的浓度 d.选择高效的催化剂
 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(2)图中表示O2变化的曲线是
(3)能说明该反应已经达到平衡状态的是
a.容器内压强保持不变 b.v(NO)=2v(O2) c.容器内的密度保持不变 d.v逆(NO2)=2v正(O2)
e. 混合气体的平均摩尔质量不再发生变化
(4)能使该反应的反应速率增大的是
a.适当升高温度 b.及时分离出NO2气体 c.增大NO的浓度 d.选择高效的催化剂
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知反应:2SO2(g) + O2(g) 2SO3(g),反应速率v(SO2)=0.05mol·L-1·min-1,则v(O2) =
2SO3(g),反应速率v(SO2)=0.05mol·L-1·min-1,则v(O2) =___________ mol·L-1·min-1。
(2)已知:2SO2(g) + O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的 △H=
SO3(g)+NO(g)的 △H=___________ kJ·mol-1。
(3)一定温度下,将NO2与SO2以体积比1∶2 置于容积固定的密闭容器中发生(2)中反应,下列事实能说明反应达到化学平衡状态的是___________ (填正确选项字母编号)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2和SO2的体积比保持不变 d.△H保持不变
(1)已知反应:2SO2(g) + O2(g)
 2SO3(g),反应速率v(SO2)=0.05mol·L-1·min-1,则v(O2) =
2SO3(g),反应速率v(SO2)=0.05mol·L-1·min-1,则v(O2) =(2)已知:2SO2(g) + O2(g)
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-12NO(g)+O2(g)
 2NO2(g) △H=-113.0 kJ·mol-1
2NO2(g) △H=-113.0 kJ·mol-1则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的 △H=
SO3(g)+NO(g)的 △H=(3)一定温度下,将NO2与SO2以体积比1∶2 置于容积固定的密闭容器中发生(2)中反应,下列事实能说明反应达到化学平衡状态的是
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2和SO2的体积比保持不变 d.△H保持不变
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】“C化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)⇌CH3OH g)+H2O(g)△H=﹣49.0kJ/mol.
相关数据如下:
请回答:
①c1__ c2(填“>”、“<”或“=”);c=__ kJ.
②同温同体积甲、乙达平衡时:a+b=_____ ,若甲、乙为体积相同的绝热容器,达平衡时a+b__________
(2)压强为p1时,向体积为1L的密闭容器中充入b mol CO 和2b mol H2,发生反应CO (g)+2H2(g)⇌CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示.请回答:该反应属于__ (填“吸热”或“放热”)反应;p1__ p2(填“>”、“<”或“=”)

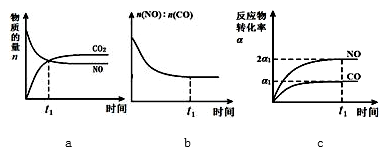
(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)⇋2CO2(g)+N2(g)△H<0.在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是__ (选填字母).
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g)⇌CH3OH g)+H2O(g)△H=﹣49.0kJ/mol.
相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时转化率 | a | b |
| 平衡时能量变化 | 放出29.4kJ | 吸收 c kJ |
请回答:
①c1
②同温同体积甲、乙达平衡时:a+b=
(2)压强为p1时,向体积为1L的密闭容器中充入b mol CO 和2b mol H2,发生反应CO (g)+2H2(g)⇌CH3OH(g).平衡时CO的转化率与温度、压强的关系如图所示.请回答:该反应属于

(3)一定条件下,治理汽车尾气的反应是2NO(g)+2CO(g)⇋2CO2(g)+N2(g)△H<0.在恒温容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应.下列图象正确且能说明反应在进行到t1时刻一定达到平衡状态的是

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】在100℃时,将0.200 mol的四氧化二氮气体充入2 L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为__________ %,表中c2_____ c3、a_____ b(填“>”、“<”或“=”)。
(2)20s时四氧化二氮的浓度c1=_________ mol/L,在0 s~20 s时间段内,四氧化二氮的平均反应速率为______________ mol/(L·s)。
(3)100℃时,该反应的平衡常数K =______________________
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是_____________ mol/L。
| 时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为
(2)20s时四氧化二氮的浓度c1=
(3)100℃时,该反应的平衡常数K =
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
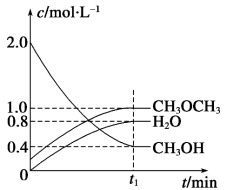
(1)该条件下反应平衡常数表达式K=__ ;在t1℃时,反应的平衡常数为__ ,达到平衡时n(CH3OCH3):n(CH3OH):n(H2O)=__ 。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4 mol·L-1,此时正、逆反应速率的大小:v正__ v逆(填“>”、“<”或“=”),反应向__ 反应方向进行(填“正”或“逆”)。
 CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1。在t1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
(1)该条件下反应平衡常数表达式K=
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4mol·L-1、c(H2O)=0.6 mol·L-1、c(CH3OCH3)=2.4 mol·L-1,此时正、逆反应速率的大小:v正
您最近一年使用:0次



