在0.1 mol·L-1的CH3COOH溶液中,要抑制醋酸电离,且c(H+)增大,应采取的措施是
| A.加水 | B.升温 | C.加适量CH3COONa固体 | D.通适量HCl气体 |
更新时间:2017-12-28 14:33:16
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】为了维持正常的生理活动,人体各种体液的pH都要保持在一定的范围。血液的正常pH范围是7.35~7.45.当血浆pH低于7.2会引起酸中毒,高于7.5会引起碱中毒。血浆“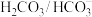 ”缓冲体系对稳定体系酸碱度有重要作用。该缓冲体系存在如下平衡:
”缓冲体系对稳定体系酸碱度有重要作用。该缓冲体系存在如下平衡: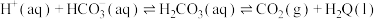 ,下列说法不正确的是
,下列说法不正确的是
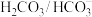 ”缓冲体系对稳定体系酸碱度有重要作用。该缓冲体系存在如下平衡:
”缓冲体系对稳定体系酸碱度有重要作用。该缓冲体系存在如下平衡: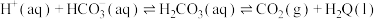 ,下列说法不正确的是
,下列说法不正确的是| A.缓冲体系加入少量强碱时,上述平衡逆向移动 |
B.当大量酸进入到缓冲体系时,体系中 将变小 将变小 |
C.该体系中一定存在 |
D.某温度下 的 的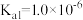 ,当血液中 ,当血液中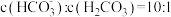 时,人体可能已经发生酸中毒 时,人体可能已经发生酸中毒 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】HA是一元酸,下列说法不正确 的是
A.25℃时,若测得0.01 mol·L NaA溶液pH>7,则HR是弱酸 NaA溶液pH>7,则HR是弱酸 |
B.25℃时,若测得0.01 mol·L HA溶液pH>2且pH<7,则HR是弱酸 HA溶液pH>2且pH<7,则HR是弱酸 |
| C.体积相同、浓度相同的HA溶液与NaOH溶液恰好完全反应,则HR是弱酸 |
D.0.1 mol·L HA溶液与0.1 mol·L HA溶液与0.1 mol·L NaOH溶液混合呈中性,则 NaOH溶液混合呈中性,则 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】在相同温度时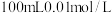 的醋酸溶液与
的醋酸溶液与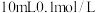 醋酸溶液相比较,下列数值前者大于后者的是
醋酸溶液相比较,下列数值前者大于后者的是
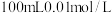 的醋酸溶液与
的醋酸溶液与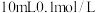 醋酸溶液相比较,下列数值前者大于后者的是
醋酸溶液相比较,下列数值前者大于后者的是A.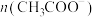 | B. | C. | D.中和时所需 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】有关电解质的说法正确的是
| A.电离常数大的酸溶液中c(H+)一定比电离常数小的酸溶液中的c(H+)大 |
B.升高CH3COONa溶液的温度,溶液中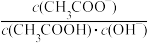 增大 增大 |
| C.0.1 mol∙L−1CH3COONa溶液和0.1 mol∙L−1NaCl溶液,前者阴离子总浓度略大 |
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中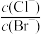 不变 不变 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】下列方法能使稀醋酸中H+浓度增大的是
| A.加水稀释 | B.加氢氧化钠固体 |
| C.通氯化氢气体 | D.通氨气 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】在CH3COOH H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
 H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓度增大,应采取的措施是| A.加入NaOH | B.加入盐酸 |
| C.加水 | D.升高温度 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】分别对 稀溶液进行下列操作,一定可使
稀溶液进行下列操作,一定可使 增大的是
增大的是
①升温 ②恒温加少量水 ③恒温加入少量固体
④恒温加入少量固体 ⑤恒温加入少量醋酸
⑤恒温加入少量醋酸
 稀溶液进行下列操作,一定可使
稀溶液进行下列操作,一定可使 增大的是
增大的是①升温 ②恒温加少量水 ③恒温加入少量固体

④恒温加入少量固体
 ⑤恒温加入少量醋酸
⑤恒温加入少量醋酸| A.①② | B.②⑤ | C.①⑤ | D.④⑤ |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列有关pH变化的判断中,正确的是
| A.随着温度的升高,碳酸溶液的pH减小 |
| B.随着温度的升高,纯水的pH减小 |
| C.浓盐酸露置一段时间后,pH减小 |
| D.氢氧化钠溶液久置于空气中,pH增大 |
您最近一年使用:0次

 的
的 标准溶液滴定
标准溶液滴定 溶液,滴定过程中溶液的
溶液,滴定过程中溶液的 随
随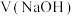 ,
, (含A粒子的物质的量分数)的变化曲线如图所示(忽略溶液体积变化)。已知:
(含A粒子的物质的量分数)的变化曲线如图所示(忽略溶液体积变化)。已知: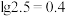 。下列说法错误的是
。下列说法错误的是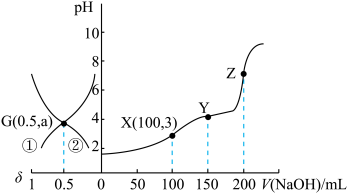
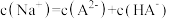
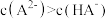
 的
的 溶液的说法正确的是
溶液的说法正确的是
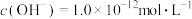

 减小,
减小,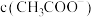 增大的是
增大的是



