自来水中氯离子的测定对人体健康有重要意义,实验室常用莫尔法测定水体中氯离子含量。实验过程如下:向水样中加入K2CrO4 (黄色) 溶液作指示剂,用AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。
回答下列问题:
(1)滴定时,应使用____________ (填“酸式”或“碱式”) 滴定管,原因是_______________________ 。
(2)水样应调至中性或弱碱性,强酸性时加入K2CrO4溶液发生反应的离子方程式是___________________________________________ 。
(3)滴定达到终点的标志是___________________________________________ 。
(4)实验过程中测得数据如下表:
计算水样中氯离子的含量为_______________ mg/L(保留2位小数)
(5)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________ 。
②已知2AgCl+ CrO42- 2Cl-+Ag2CrO4,计算出该反应的平衡常数为
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________ 。
(6)下列情况会造成实验测定结果偏低的是____________ 。(填标号)
A.锥形瓶洗涤后未干燥
B.滴定前,未使用标准液润洗滴定管
C.酸式滴定管滴定前仰视读数,滴定后俯视读数
D.酸式滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
回答下列问题:
(1)滴定时,应使用
(2)水样应调至中性或弱碱性,强酸性时加入K2CrO4溶液发生反应的离子方程式是
(3)滴定达到终点的标志是
(4)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
c(AgNO3)/ mol·L-1 | 0.0010 | ||
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
(5)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=
②已知2AgCl+ CrO42-
 2Cl-+Ag2CrO4,计算出该反应的平衡常数为
2Cl-+Ag2CrO4,计算出该反应的平衡常数为(6)下列情况会造成实验测定结果偏低的是
A.锥形瓶洗涤后未干燥
B.滴定前,未使用标准液润洗滴定管
C.酸式滴定管滴定前仰视读数,滴定后俯视读数
D.酸式滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
更新时间:2018-01-27 12:10:05
|
相似题推荐
【推荐1】碳和碳的化合物在生产、生活中有着重要的作用,甲烷、甲醇等都是重要的能源物质。
(1)甲醇-水蒸气重整在工业生产中用途广泛,主要反应为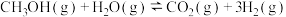 ∆H。
∆H。
已知同时还进行的反应有:
Ⅰ.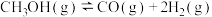 ∆H1=+90.8kJ∙mol
∆H1=+90.8kJ∙mol
Ⅱ. ∆H2=-41.1kJ∙mol
∆H2=-41.1kJ∙mol
则:
①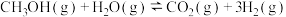 ∆H=
∆H=___________ 。
②该反应自发进行的条件是___________ (填字母)。
A.高温 B.低温 C.所有温度 D.所有温度均不自发
③甲醇-水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源。CO会损坏燃料电池的交换膜。工业生产过程中会向重整系统中加入适量轻质多孔的生石灰,以减轻燃料电池的交换膜的损坏,主要原因为___________ 。
(2)甲烷通常也可通过多种重整方式进行利用,如二氧化碳重整甲烷反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),实验测定该反应的反应速率v正=k正∙c(CH4)∙c(CO2),v逆=k逆∙c2(CO) c2(H2),k正、k逆 分别是正、逆反应速率常数,且只与温度有关。T℃时,向某恒温恒容密闭容器中充入物质的量浓度均为1mol∙L-1的CH4 (g)和CO2 (g),发生重整反应,测得体系中CH4 (g)和CO(g)的物质的量浓度随时间的变化如图所示:
2CO(g)+2H2(g),实验测定该反应的反应速率v正=k正∙c(CH4)∙c(CO2),v逆=k逆∙c2(CO) c2(H2),k正、k逆 分别是正、逆反应速率常数,且只与温度有关。T℃时,向某恒温恒容密闭容器中充入物质的量浓度均为1mol∙L-1的CH4 (g)和CO2 (g),发生重整反应,测得体系中CH4 (g)和CO(g)的物质的量浓度随时间的变化如图所示:

①B点的坐标为___________ 。
②反应进行到5min时,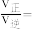
___________ 。
(3)二氧化碳的资源化利用是科学工作者研究的重要方向。我国科学家开发的特殊催化剂用于CO2制备CH2=CH2,有利于实现“双碳”目标: ∆H=-127.8kJ∙mol,过程中可得副产物甲酸:
∆H=-127.8kJ∙mol,过程中可得副产物甲酸: ∆H=-31.4kJ∙mol 。
∆H=-31.4kJ∙mol 。
①在合适催化剂的作用下,在恒容容器中充入一定量的CO2与H2,反应进行相同的时间测得体系中HCOOH和C2H4的体积分数随温度的变化如图所示,则主反应与副反应中活化能较大的反应是___________ (填“主反应”或“副反应”);600K后,C2H4的体积分数减小的主要原因为___________ 。

②一定温度下,在容积为1L的恒容密闭容器中充入2mol CO2(g)和6mol H2(g),同时发生了主反应和副反应,达到平衡时CH2=CH2的物质的量为0.5mol,H2的物质的量为2.5mol,则该温度下,副反应的平衡常数K=___________ 。
(1)甲醇-水蒸气重整在工业生产中用途广泛,主要反应为
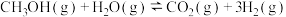 ∆H。
∆H。 已知同时还进行的反应有:
Ⅰ.
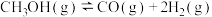 ∆H1=+90.8kJ∙mol
∆H1=+90.8kJ∙mol Ⅱ.
 ∆H2=-41.1kJ∙mol
∆H2=-41.1kJ∙mol 则:
①
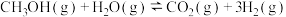 ∆H=
∆H=②该反应自发进行的条件是
A.高温 B.低温 C.所有温度 D.所有温度均不自发
③甲醇-水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源。CO会损坏燃料电池的交换膜。工业生产过程中会向重整系统中加入适量轻质多孔的生石灰,以减轻燃料电池的交换膜的损坏,主要原因为
(2)甲烷通常也可通过多种重整方式进行利用,如二氧化碳重整甲烷反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g),实验测定该反应的反应速率v正=k正∙c(CH4)∙c(CO2),v逆=k逆∙c2(CO) c2(H2),k正、k逆 分别是正、逆反应速率常数,且只与温度有关。T℃时,向某恒温恒容密闭容器中充入物质的量浓度均为1mol∙L-1的CH4 (g)和CO2 (g),发生重整反应,测得体系中CH4 (g)和CO(g)的物质的量浓度随时间的变化如图所示:
2CO(g)+2H2(g),实验测定该反应的反应速率v正=k正∙c(CH4)∙c(CO2),v逆=k逆∙c2(CO) c2(H2),k正、k逆 分别是正、逆反应速率常数,且只与温度有关。T℃时,向某恒温恒容密闭容器中充入物质的量浓度均为1mol∙L-1的CH4 (g)和CO2 (g),发生重整反应,测得体系中CH4 (g)和CO(g)的物质的量浓度随时间的变化如图所示: 
①B点的坐标为
②反应进行到5min时,
(3)二氧化碳的资源化利用是科学工作者研究的重要方向。我国科学家开发的特殊催化剂用于CO2制备CH2=CH2,有利于实现“双碳”目标:
 ∆H=-127.8kJ∙mol,过程中可得副产物甲酸:
∆H=-127.8kJ∙mol,过程中可得副产物甲酸: ∆H=-31.4kJ∙mol 。
∆H=-31.4kJ∙mol 。①在合适催化剂的作用下,在恒容容器中充入一定量的CO2与H2,反应进行相同的时间测得体系中HCOOH和C2H4的体积分数随温度的变化如图所示,则主反应与副反应中活化能较大的反应是

②一定温度下,在容积为1L的恒容密闭容器中充入2mol CO2(g)和6mol H2(g),同时发生了主反应和副反应,达到平衡时CH2=CH2的物质的量为0.5mol,H2的物质的量为2.5mol,则该温度下,副反应的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】我国承诺2030年实现碳达峰,2060年实现碳中和,二氧化碳综合利用技术愈显重要。
I.利用二氧化碳合成尿素
合成尿素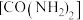 的反应为
的反应为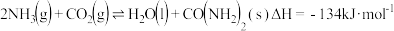 。向恒容密闭容器中按物质的量之比
。向恒容密闭容器中按物质的量之比 充入
充入 和
和 ,使反应进行,保持温度不变,测得
,使反应进行,保持温度不变,测得 的转化率随时间的变化情况如图所示。
的转化率随时间的变化情况如图所示。

(1)若用 的浓度变化表示反应速率,则
的浓度变化表示反应速率,则 点的逆反应速率
点的逆反应速率________  点的正反应速率(填“
点的正反应速率(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(2)下列叙述中不能说明该反应达到平衡状态的是________(填选项字母)。
(3)工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有________(填选项字母)。
II.二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(4)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比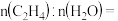
________ 。当反应达到平衡时,若增大压强,则n(C2H4)____________ 填“变大”“变小”或“不变”)。
(5)理论计算表明,原料初始组成 ,在体系压强为
,在体系压强为 ,反应达到平衡时,四种组分的物质的量分数
,反应达到平衡时,四种组分的物质的量分数 随温度
随温度 的变化如下图所示。
的变化如下图所示。
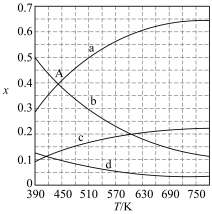
图中表示C2H4、CO2变化的曲线分别是________ 、________ 。CO2催化加氢合成C2H4反应的∆H___________ 0(“大于”或“小于”)。
(6)根据图中点 ,计算该温度时反应的平衡常数
,计算该温度时反应的平衡常数 (列出计算式。以分压表示,分压
(列出计算式。以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
I.利用二氧化碳合成尿素
合成尿素
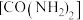 的反应为
的反应为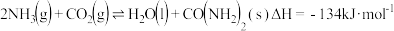 。向恒容密闭容器中按物质的量之比
。向恒容密闭容器中按物质的量之比 充入
充入 和
和 ,使反应进行,保持温度不变,测得
,使反应进行,保持温度不变,测得 的转化率随时间的变化情况如图所示。
的转化率随时间的变化情况如图所示。
(1)若用
 的浓度变化表示反应速率,则
的浓度变化表示反应速率,则 点的逆反应速率
点的逆反应速率 点的正反应速率(填“
点的正反应速率(填“ ”“
”“ ”或“
”或“ ”)。
”)。(2)下列叙述中不能说明该反应达到平衡状态的是________(填选项字母)。
| A.体系压强不再变化 |
| B.气体平均摩尔质量不再变化 |
| C.NH3的消耗速率和CO2的消耗速率之比为2:1 |
| D.固体质量不再发生变化 |
(3)工业上合成尿素时,既能加快反应速率,又能提高原料利用率的措施有________(填选项字母)。
| A.升高温度 | B.加入催化剂 |
| C.将尿素及时分离出去 | D.增大反应体系的压强 |
II.二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(4)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比
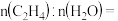
(5)理论计算表明,原料初始组成
 ,在体系压强为
,在体系压强为 ,反应达到平衡时,四种组分的物质的量分数
,反应达到平衡时,四种组分的物质的量分数 随温度
随温度 的变化如下图所示。
的变化如下图所示。
图中表示C2H4、CO2变化的曲线分别是
(6)根据图中点
 ,计算该温度时反应的平衡常数
,计算该温度时反应的平衡常数 (列出计算式。以分压表示,分压
(列出计算式。以分压表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】随着低碳钢等洁净钢技术的发展, 耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
(1)在埋炭实验条件下,不同碳素材料的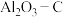 耐火材料与铁液之间的可能反应如下:
耐火材料与铁液之间的可能反应如下:
①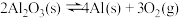
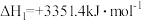
②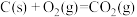
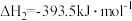
③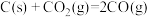
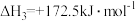
④

则
___________  。
。
(2)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤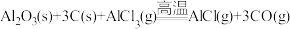

⑥
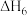
反应⑤、反应⑥中吉布斯自由能(ΔG)与温度(T)的变化关系如图1所示,由此判断反应⑤对应图中的曲线___________ (填“Ⅰ”或“Ⅱ”),试分析氧化铝碳热还原氯化法炼铝的可行性:___________ 。
(3)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑: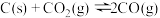 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为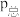 )中加入足量的碳和
)中加入足量的碳和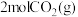 ,平衡时体系中气体体积分数与温度的关系如图2所示。
,平衡时体系中气体体积分数与温度的关系如图2所示。

①650℃反应达到平衡时,容器体积为10L,则平衡时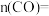
___________ 。
②T℃时,若向平衡体系中再充入一定量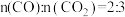 的混合气体,则平衡
的混合气体,则平衡___________ (填“向正反应方向”、“向逆反应方向”或“不”)移动。
③800℃时,用平衡分压代替平衡浓度表示的化学平衡常数
___________ [用含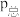 的代数式表示,气体分压
的代数式表示,气体分压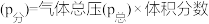 ]。
]。
(4)CO可作某熔融盐电池的燃料,电解质为Li2CO3和Na2CO3的熔融盐混合物,空气与CO2的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为___________ 。
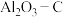 耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:
耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:(1)在埋炭实验条件下,不同碳素材料的
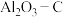 耐火材料与铁液之间的可能反应如下:
耐火材料与铁液之间的可能反应如下:①
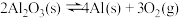
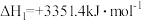
②
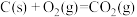
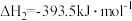
③
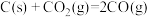
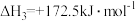
④


则

 。
。(2)直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤
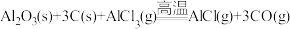

⑥

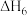
反应⑤、反应⑥中吉布斯自由能(ΔG)与温度(T)的变化关系如图1所示,由此判断反应⑤对应图中的曲线
(3)在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:
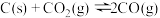 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为
。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为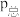 )中加入足量的碳和
)中加入足量的碳和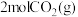 ,平衡时体系中气体体积分数与温度的关系如图2所示。
,平衡时体系中气体体积分数与温度的关系如图2所示。
①650℃反应达到平衡时,容器体积为10L,则平衡时
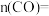
②T℃时,若向平衡体系中再充入一定量
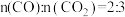 的混合气体,则平衡
的混合气体,则平衡③800℃时,用平衡分压代替平衡浓度表示的化学平衡常数

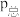 的代数式表示,气体分压
的代数式表示,气体分压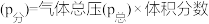 ]。
]。(4)CO可作某熔融盐电池的燃料,电解质为Li2CO3和Na2CO3的熔融盐混合物,空气与CO2的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
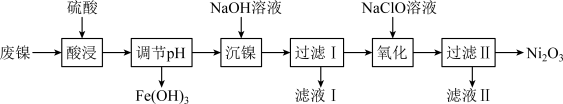
(1)“调节pH”后检验溶液中不再存在Fe3+的方法是______ 。
(2)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是______ 。
(3)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:______ 。
(4)若“氧化”反应不充分,所制Ni2O3样品中会混有Ni(OH)2。为测定样品中Ni2O3的质量分数,进行实验:称取5.000 g样品,加入足量硫酸后再加入100 mL 1.0 mol·L-1的Fe2+标准溶液,充分反应,加水定容至200 mL。取出20.00 mL,用0.040 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定Ni2O3的质量分数。测定过程中涉及反应如下:Ni2O3+Fe2++H+=Ni2++Fe3++H2O(未配平);Fe2++MnO4-+H+=Fe3++Mn2++H2O(未配平)______

(1)“调节pH”后检验溶液中不再存在Fe3+的方法是
(2)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是
(3)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:
(4)若“氧化”反应不充分,所制Ni2O3样品中会混有Ni(OH)2。为测定样品中Ni2O3的质量分数,进行实验:称取5.000 g样品,加入足量硫酸后再加入100 mL 1.0 mol·L-1的Fe2+标准溶液,充分反应,加水定容至200 mL。取出20.00 mL,用0.040 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定Ni2O3的质量分数。测定过程中涉及反应如下:Ni2O3+Fe2++H+=Ni2++Fe3++H2O(未配平);Fe2++MnO4-+H+=Fe3++Mn2++H2O(未配平)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。
(1)制备莫尔盐的流程如下:
①用热的Na2CO3溶液清洗废铁屑的目的是__________ 。
②其中最后一步用少量无水乙醇洗涤晶体目的是________ 。
(2)现取0.4gCu2S和CuS的混合物在酸性溶液中用40mL0.150mol·L-1KMnO4溶液处理,发生反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,
反应后煮沸溶液,赶尽SO2,剩余的KMnO4用0.2mol·L-1(NH4)2Fe(SO4)2溶液来滴定,完全反应消耗(NH4)2Fe(SO4)2溶液VmL。已知:MnO4-+Fe2++H+→Mn2++Fe3++H2O(未配平)
①滴定终点的现象为________ 。
②若V=35,试计算混合物中CuS的质量分数________ (写出计算过程)。
(1)制备莫尔盐的流程如下:
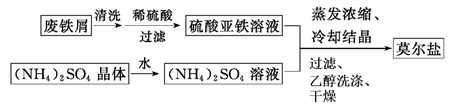
①用热的Na2CO3溶液清洗废铁屑的目的是
②其中最后一步用少量无水乙醇洗涤晶体目的是
(2)现取0.4gCu2S和CuS的混合物在酸性溶液中用40mL0.150mol·L-1KMnO4溶液处理,发生反应如下:8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O,
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O,
反应后煮沸溶液,赶尽SO2,剩余的KMnO4用0.2mol·L-1(NH4)2Fe(SO4)2溶液来滴定,完全反应消耗(NH4)2Fe(SO4)2溶液VmL。已知:MnO4-+Fe2++H+→Mn2++Fe3++H2O(未配平)
①滴定终点的现象为
②若V=35,试计算混合物中CuS的质量分数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中。
Ⅰ.某同学通过高锰酸钾滴定来测定草酸样品中草酸的质量分数(样品中杂质不与高锰酸钾反应)。
(1)写出反应的离子方程式_______________ 。
(2)某同学称取2.000g草酸样品,配制成100mL溶液,移取40.00mL试样溶液于锥形瓶中,用0.1000mol·L-1的酸性KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL。
(1)滴定前是否要滴加指示剂?_____________ (填“是”或“否”)。
(2)滴定时,将高锰酸钾标准溶液注入___________ (填“酸式”或“碱式”)滴定管中。达到滴定终点的现象为_____________ 。
(3)草酸样品中草酸的质量分数为_____________ 。
(4)若滴定终点读数时俯视刻度,所测结果将_____________ ,若滴定前酸式滴定管尖嘴部分未充满溶液,所测结果将_____________ 。(填“偏大”“偏小”“无影响”)。
Ⅱ.某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2mol/L的 标准溶液滴定剩余的
标准溶液滴定剩余的 ,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。
,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。
(1)判断滴定达到终点的现象是_____________ 。
(2)考虑Ag+和Fe3+在酸或碱性溶液中的存在形式,在实施滴定的溶液以呈_____________ (选填“酸性”“中性”或“碱性”)为宜。
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使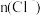 的测定结果
的测定结果_____________ (选填“偏高”、“偏低”或“无影响”)。
Ⅰ.某同学通过高锰酸钾滴定来测定草酸样品中草酸的质量分数(样品中杂质不与高锰酸钾反应)。
(1)写出反应的离子方程式
(2)某同学称取2.000g草酸样品,配制成100mL溶液,移取40.00mL试样溶液于锥形瓶中,用0.1000mol·L-1的酸性KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL。
(1)滴定前是否要滴加指示剂?
(2)滴定时,将高锰酸钾标准溶液注入
(3)草酸样品中草酸的质量分数为
(4)若滴定终点读数时俯视刻度,所测结果将
Ⅱ.某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl-外,不含其他与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2mol/L的
 标准溶液滴定剩余的
标准溶液滴定剩余的 ,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。
,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。(1)判断滴定达到终点的现象是
(2)考虑Ag+和Fe3+在酸或碱性溶液中的存在形式,在实施滴定的溶液以呈
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使
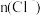 的测定结果
的测定结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。
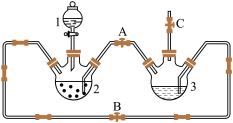
I.稀硫酸应放在_______中(填写仪器名称)。
II.本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关_______、打开开关_______就可观察到氢氧化亚铁的颜色。
III.在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4· 6H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(1)上面I处__ ;II处__ 、__
(2)为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是_______。
(3)为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
①滴定过程中发生反应的离子方程式为_______ 。
②滴定终点现象的判断是__ 。
③通过实验数据计算的该产品纯度为_______ (用字母a、c表)。上表中第一次实验中记录数据明显大于后两次,其原因可能是_______ 。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低

I.稀硫酸应放在_______中(填写仪器名称)。
II.本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关_______、打开开关_______就可观察到氢氧化亚铁的颜色。
III.在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4· 6H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(1)上面I处
(2)为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是_______。
| A.用冷水洗 | B.先用冷水洗,后用无水乙醇洗 |
| C.用30%的乙醇溶液洗 | D.用90%的乙醇溶液洗 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
②滴定终点现象的判断是
③通过实验数据计算的该产品纯度为
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氯化亚铜是非常重要的化工原料,广泛用于化学反应的催化剂。
已知:①氯化亚铜难溶于水,不溶于乙醇;
②氯化亚铜露置于空气中易被氧化。
请回答下列问题。
I.可用纯净的氯化铜制备氯化亚铜,流程如图所示:
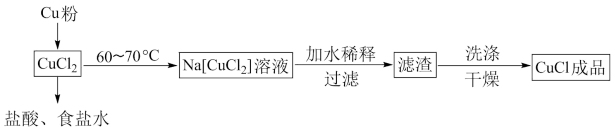
(1)“加水稀释”步骤中,配合物 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式_____ 。
(2)滤渣用乙醇洗涤后,在真空中干燥。选择在真空中干燥的原因是______ 。若在空气中用水洗涤,可转变为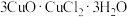 ,写出该过程的化学方程式
,写出该过程的化学方程式___________ 。
(3)已知溶液中可以发生反应: ,但实验室不宜用该方法直接制备氯化亚铜,可能原因是
,但实验室不宜用该方法直接制备氯化亚铜,可能原因是___________ 。
II.利用氧化还原滴定可测定产品中 的含量,实验分两步进行:
的含量,实验分两步进行:
步骤I:将上述流程得到的 产品取
产品取 于碘量瓶中,加入足量
于碘量瓶中,加入足量 溶液,摇匀至样品完全溶解。
溶液,摇匀至样品完全溶解。
步骤II:将溶解液稀释至 。用
。用 移液管移取
移液管移取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 标准
标准 溶液滴定至终点。平行实验三次,平均消耗
溶液滴定至终点。平行实验三次,平均消耗 标准
标准 溶液。
溶液。
已知: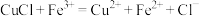 、
、
(4)计算产品中 的质量分数为
的质量分数为___________ 。滴定过程中,下列操作会使滴定结果偏小的是___________ (填字母序号)。
a.未用标准溶液润洗滴定管
b.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
c.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
Ⅲ.研究发现, 在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

(5)腐蚀过程中,正极的电极反应式为___________ 。
(6)环境中的 扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈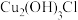 。理论上,消耗标准状况下的
。理论上,消耗标准状况下的
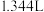 时,生成
时,生成___________ g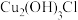 。
。
已知:①氯化亚铜难溶于水,不溶于乙醇;
②氯化亚铜露置于空气中易被氧化。
请回答下列问题。
I.可用纯净的氯化铜制备氯化亚铜,流程如图所示:

(1)“加水稀释”步骤中,配合物
 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式(2)滤渣用乙醇洗涤后,在真空中干燥。选择在真空中干燥的原因是
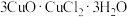 ,写出该过程的化学方程式
,写出该过程的化学方程式(3)已知溶液中可以发生反应:
 ,但实验室不宜用该方法直接制备氯化亚铜,可能原因是
,但实验室不宜用该方法直接制备氯化亚铜,可能原因是II.利用氧化还原滴定可测定产品中
 的含量,实验分两步进行:
的含量,实验分两步进行:步骤I:将上述流程得到的
 产品取
产品取 于碘量瓶中,加入足量
于碘量瓶中,加入足量 溶液,摇匀至样品完全溶解。
溶液,摇匀至样品完全溶解。步骤II:将溶解液稀释至
 。用
。用 移液管移取
移液管移取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 标准
标准 溶液滴定至终点。平行实验三次,平均消耗
溶液滴定至终点。平行实验三次,平均消耗 标准
标准 溶液。
溶液。已知:
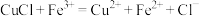 、
、
(4)计算产品中
 的质量分数为
的质量分数为a.未用标准溶液润洗滴定管
b.锥形瓶在滴定过程中剧烈摇动,有少量液体溅出
c.滴定前滴定管尖嘴部分有气泡,滴定后无气泡
Ⅲ.研究发现,
 在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
在青铜器的腐蚀过程中起催化作用。下图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
(5)腐蚀过程中,正极的电极反应式为
(6)环境中的
 扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈
扩散到孔口,并与正、负极反应产物作用生成多孔粉状锈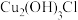 。理论上,消耗标准状况下的
。理论上,消耗标准状况下的
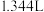 时,生成
时,生成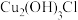 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】I.某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_____________________________ ,直到因加入一滴盐酸后,溶液由黄色变成橙色。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________ (填字母)
A酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
II.氧化还原滴定实验同中和滴定类似(用已加浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。人体缺乏维生素C(C6H8O6)易得坏血病。维生素C易被空气氧化。在新鲜的水果,蔬菜,乳制品中都富含维生素C。新鲜橙汁中生素C的含量在500mg•L-1左右,某课外活动小组测定了某品牌的软包装橙子中维生素C的含量。
下面是测定实验分析报告。
(1)测定目的:测定××牌软包装橙汁维生素的含量,是否为纯天然。
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-
(3)实验用品及试剂
①仪器和用品(自选,说明:锥形瓶不易将液体溅出)
②试剂:某品牌橙汁为20mL, 浓度为7.50×10-3mol/L标准碘溶液,蒸馏水,指示剂
(4)实验过程:(略)
回答下列问题
a.实验应选用___________ 作指示剂,滴定终点的现象____________________________ 。
b.若经数据处理,滴定某品牌计橙汁20mL(待测液)消耗标准碘溶液的体积是15.00mL,
从分析数据看,此品牌橙汁是否是纯天然橙汁?__________ (维生素C的摩尔质量为176g/mol)
A是 B.可能是 C.不是
c.滴定时_____ (填能,不能)剧烈摇动锥形瓶?原因是________________________________ 。
(1)标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
II.氧化还原滴定实验同中和滴定类似(用已加浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。人体缺乏维生素C(C6H8O6)易得坏血病。维生素C易被空气氧化。在新鲜的水果,蔬菜,乳制品中都富含维生素C。新鲜橙汁中生素C的含量在500mg•L-1左右,某课外活动小组测定了某品牌的软包装橙子中维生素C的含量。
下面是测定实验分析报告。
(1)测定目的:测定××牌软包装橙汁维生素的含量,是否为纯天然。
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-
(3)实验用品及试剂
①仪器和用品(自选,说明:锥形瓶不易将液体溅出)
②试剂:某品牌橙汁为20mL, 浓度为7.50×10-3mol/L标准碘溶液,蒸馏水,指示剂
(4)实验过程:(略)
回答下列问题
a.实验应选用
b.若经数据处理,滴定某品牌计橙汁20mL(待测液)消耗标准碘溶液的体积是15.00mL,
从分析数据看,此品牌橙汁是否是纯天然橙汁?
A是 B.可能是 C.不是
c.滴定时
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】环境中常见的重金属污染物有汞、铅、锰、铬、镉。处理工业废水中含有的 和
和 常用的方法是还原沉淀法,该法的工艺流程为
常用的方法是还原沉淀法,该法的工艺流程为


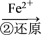 Cr3+
Cr3+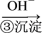 Cr(OH)3。
Cr(OH)3。
其中第①步存在平衡:2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式:_________________________________ 。
(2)关于第①步反应,下列说法正确的是________ (填序号)。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.在强酸性环境下,溶液的颜色为橙色
(3)第②步反应中,还原0.1 mol ,需要
,需要________ mol FeSO4·7H2O。
(4)第③步反应除生成Cr(OH)3沉淀外,还可能生成的沉淀为________ 。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。
Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。____________
 和
和 常用的方法是还原沉淀法,该法的工艺流程为
常用的方法是还原沉淀法,该法的工艺流程为


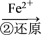 Cr3+
Cr3+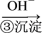 Cr(OH)3。
Cr(OH)3。其中第①步存在平衡:2
 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O。
(橙色)+H2O。(1)写出第①步反应的平衡常数表达式:
(2)关于第①步反应,下列说法正确的是
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.在强酸性环境下,溶液的颜色为橙色
(3)第②步反应中,还原0.1 mol
 ,需要
,需要(4)第③步反应除生成Cr(OH)3沉淀外,还可能生成的沉淀为
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。
Cr3+(aq)+3OH-(aq)。常温下,Cr(OH)3的溶度积常数Ksp=10-32,当溶液中Cr3+的浓度降至10-5mol·L-1,认为Cr3+已经完全沉淀。现将第③步反应后溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某研究小组用印刷电路板的腐蚀废液(主要含CuCl2、FeCl2、FeCl3)制备Cu(NH4)2SO4•H2O和FeCl2•4H2O。
I.制备流程图
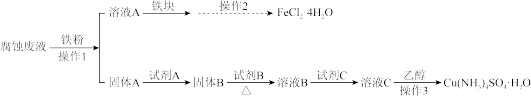
已知1.所加试剂均足量,且部分步骤有省略。
II.Cu(NH4)2SO4•H2O晶体纯度测定
①取a g Cu(NH4)2SO4•H2O晶体,加入适量1 mol·L-1稀硫酸,加热,待溶液冷却后配制成250 mL溶液。
②取25.00 mL溶液,加水50 mL,调节溶液至弱酸性(pH=3~4),加入过量20%KI溶液,避光静置几分钟。
③用c mol·L-1Na2S2O3标准溶液滴定至溶液呈淡黄色,再加入淀粉溶液,继续滴定至溶液变浅蓝色,再加入一定量10%KSCN溶液,蓝色变深,继续滴定至蓝色刚好消失,记录消耗Na2S2O3标准溶液的体积。
④平行滴定三次,消耗Na2S2O3标准溶液的平均体积为V mL。
已知2:①2Cu2++4I-=2CuI↓+I2;I2+2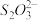 =
= +2I-。
+2I-。
②CuI和CuSCN均为白色固体;Ksp(CuI)=1.1×10-12,Ksp(CuSCN)=4.8×10-15。
请回答:
(1)下列说法正确的是____ 。
(2)测定晶体纯度时,步骤②用KI溶液测定铜含量时,需在弱酸性(pH=3~4)溶液中进行的原因____ 。
(3)下列关于滴定分析的描述,正确的是____ 。
(4)结合离子反应方程式并用必要的文字说明滴定过程中加入KSCN溶液的作用____ 。
(5)Cu(NH4)2SO4•H2O(M=246 g•mol-1)晶体样品的纯度为____ %(用含a、c、V的代数式表示)。
I.制备流程图
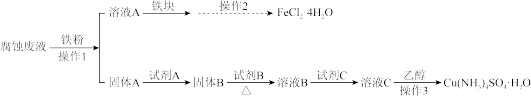
已知1.所加试剂均足量,且部分步骤有省略。
II.Cu(NH4)2SO4•H2O晶体纯度测定
①取a g Cu(NH4)2SO4•H2O晶体,加入适量1 mol·L-1稀硫酸,加热,待溶液冷却后配制成250 mL溶液。
②取25.00 mL溶液,加水50 mL,调节溶液至弱酸性(pH=3~4),加入过量20%KI溶液,避光静置几分钟。
③用c mol·L-1Na2S2O3标准溶液滴定至溶液呈淡黄色,再加入淀粉溶液,继续滴定至溶液变浅蓝色,再加入一定量10%KSCN溶液,蓝色变深,继续滴定至蓝色刚好消失,记录消耗Na2S2O3标准溶液的体积。
④平行滴定三次,消耗Na2S2O3标准溶液的平均体积为V mL。
已知2:①2Cu2++4I-=2CuI↓+I2;I2+2
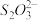 =
= +2I-。
+2I-。②CuI和CuSCN均为白色固体;Ksp(CuI)=1.1×10-12,Ksp(CuSCN)=4.8×10-15。
请回答:
(1)下列说法正确的是
| A.操作2通过蒸发至出现晶膜后趁热过滤,快速冷却滤液结晶,可得较大FeCl2•4H2O晶体 |
| B.可用KSCN或K3[Fe(CN)6]溶液检验FeCl2•4H2O晶体中是否存在杂质Fe3+ |
| C.溶液C中加入乙醇可以降低Cu(NH4)2SO4•H2O在溶剂中的溶解性,促进晶体析出 |
| D.溶液B中逐滴滴加试剂C至过量的过程中先出现蓝色沉淀后变为深蓝色溶液,这一现象可以说明与Cu2+结合能力大小为:NH3>OH->H2O |
(3)下列关于滴定分析的描述,正确的是
| A.加入过量20%KI溶液可以增大I2的溶解性,减少实验滴定误差 |
| B.Na2S2O3标准溶液应盛放在碱式滴定管中 |
| C.滴定时,眼睛应一直观察滴定管中溶液体积的变化 |
| D.若滴定恰好完全时,滴定管尖端悬半滴未滴下,会导致测定结果偏低 |
(5)Cu(NH4)2SO4•H2O(M=246 g•mol-1)晶体样品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】镀镍厂排放的硫酸镍废液(含 、
、 、
、 、
、 、
、 等杂质)对环境会产生较大的污染,对其进行回收处理,提取硫酸镍晶体
等杂质)对环境会产生较大的污染,对其进行回收处理,提取硫酸镍晶体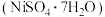 的工艺流程如图甲所示:
的工艺流程如图甲所示:

已知:25℃时,有关金属离子开始沉淀与沉淀完全的pH范围(a)、硫化物的酸溶性(b)如表所示。
回答下列问题:
(1)调pH后溶液中主要存在的阴离子有_______________ 。
(2)“硫化”过程中发生反应的离子方程式为________________________ 。
(3)“调pH”时,应调节溶液pH的范围为___________ 。
(4)“沉钙”时同样需要控制体系的pH在一定范围内,原因是__________________ 。
(5)已知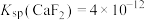 ,溶液中某离子浓度小于
,溶液中某离子浓度小于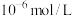 认为其沉淀完全。现有
认为其沉淀完全。现有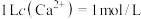 的溶液,若要使得钙离子完全沉淀则至少需要投入的NaF固体的物质的量为
的溶液,若要使得钙离子完全沉淀则至少需要投入的NaF固体的物质的量为_______ (忽略溶液体积变化和氟离子的水解,保留小数点后3位)。
(6)“萃取分液”选用有机萃取剂HDEHP萃取金属离子(用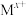 表示,
表示,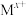 为
为 、
、 、
、 、
、 、
、 )的原理为
)的原理为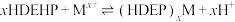 。室温下,几种金属离子的萃取率[萃取率
。室温下,几种金属离子的萃取率[萃取率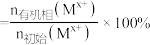 ]随溶液pH的变化关系如图乙所示:
]随溶液pH的变化关系如图乙所示:
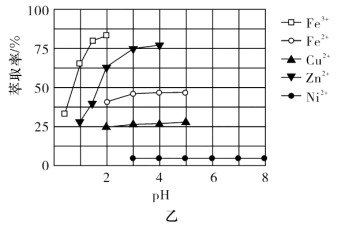
“萃取分液”时 进入有机相被除去,则应调节溶液pH的最佳范围是
进入有机相被除去,则应调节溶液pH的最佳范围是__________ 。
 、
、 、
、 、
、 、
、 等杂质)对环境会产生较大的污染,对其进行回收处理,提取硫酸镍晶体
等杂质)对环境会产生较大的污染,对其进行回收处理,提取硫酸镍晶体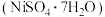 的工艺流程如图甲所示:
的工艺流程如图甲所示:
已知:25℃时,有关金属离子开始沉淀与沉淀完全的pH范围(a)、硫化物的酸溶性(b)如表所示。
金属离子 |
|
|
|
|
|
a | 4.8~6.7 | 6.3~8.3 | 1.5~2.8 | 6.2~8.2 | 6.9~8.9 |
b | 不溶于硫酸等 | 溶于酸 | — | 溶于酸 | 溶于酸 |
回答下列问题:
(1)调pH后溶液中主要存在的阴离子有
(2)“硫化”过程中发生反应的离子方程式为
(3)“调pH”时,应调节溶液pH的范围为
(4)“沉钙”时同样需要控制体系的pH在一定范围内,原因是
(5)已知
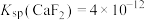 ,溶液中某离子浓度小于
,溶液中某离子浓度小于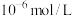 认为其沉淀完全。现有
认为其沉淀完全。现有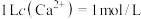 的溶液,若要使得钙离子完全沉淀则至少需要投入的NaF固体的物质的量为
的溶液,若要使得钙离子完全沉淀则至少需要投入的NaF固体的物质的量为(6)“萃取分液”选用有机萃取剂HDEHP萃取金属离子(用
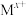 表示,
表示,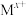 为
为 、
、 、
、 、
、 、
、 )的原理为
)的原理为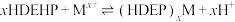 。室温下,几种金属离子的萃取率[萃取率
。室温下,几种金属离子的萃取率[萃取率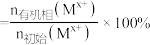 ]随溶液pH的变化关系如图乙所示:
]随溶液pH的变化关系如图乙所示:
“萃取分液”时
 进入有机相被除去,则应调节溶液pH的最佳范围是
进入有机相被除去,则应调节溶液pH的最佳范围是
您最近一年使用:0次




