SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
(1)方法Ⅰ的过程如下。
①制备Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。CaO的作用之一是促进_______ 水解(填离子符号,下同),二是沉淀一部分_______ 。
②吸收:Al2(SO4)x(OH)y吸收SO2后的产物是_______ (写化学式)。
③解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是_______ 。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
①写出ⅱ的离子方程式:_______ 。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,_______ 。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。

①H2O2氧化SO2的化学方程式_______ 。
②废气中残留SO2的体积分数为_______ 。
| 方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
| 方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
①制备Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。CaO的作用之一是促进
②吸收:Al2(SO4)x(OH)y吸收SO2后的产物是
③解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
①写出ⅱ的离子方程式:
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。

①H2O2氧化SO2的化学方程式
②废气中残留SO2的体积分数为
2018·北京朝阳·二模 查看更多[2]
更新时间:2018-05-10 14:34:22
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】 是一种高性能磁性材料。实验室以
是一种高性能磁性材料。实验室以 为原料制备
为原料制备 的流程如下:
的流程如下:
第一步:将向 浊液中通入
浊液中通入 ,发生反应
,发生反应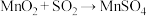 ;
;
第二步:向 溶液中加入
溶液中加入 ,有
,有 气体逸出,同时获得
气体逸出,同时获得 粗产品。
粗产品。
已知部分含锰化合物的溶解性如下:
完成下列填空:
(1)①第一步的反应装置如下图所示:

②石灰乳的作用是___________ 。
③反应过程中,为使 尽可能转化完全,在通入
尽可能转化完全,在通入 与
与 比例一定,不改变
比例一定,不改变 与
与 用量的条件下,可以采取的合理措施有
用量的条件下,可以采取的合理措施有___________ (任写一种)。
(2)若实验中将 换成空气,测得反应液中
换成空气,测得反应液中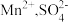 的浓度随反应时间t变化如图。导致溶液中
的浓度随反应时间t变化如图。导致溶液中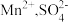 浓度变化产生明显差异的原因可能是:
浓度变化产生明显差异的原因可能是:___________ 。

(3)完成第二步反应的离子方程式:
___________ ,实验发现,若用相同物质的量浓度的 溶液代替
溶液代替 溶液,则得到的
溶液,则得到的 中会混有较多的杂质,该杂质可能是
中会混有较多的杂质,该杂质可能是___________ (填化学式)。
实验室可以用无色的酸性 溶液来检验,原理如下所示:
溶液来检验,原理如下所示: 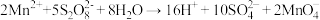
已知 的结构如下图所示。
的结构如下图所示。

(4)标明上述反应的电子转移方向与数目______ 。确认溶液中是否含 的操作与现象是:
的操作与现象是:_____ 。
(5)利用重量法探究 的热分解,数据如下表所示(残留固体均为锰的氧化物):
的热分解,数据如下表所示(残留固体均为锰的氧化物):
①第二组实验中残留固体的化学式为___________ 。
②结合两组实验数据,推测 在空气中加热至
在空气中加热至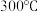 时发生反应的化学方程式:
时发生反应的化学方程式:____ 。
 是一种高性能磁性材料。实验室以
是一种高性能磁性材料。实验室以 为原料制备
为原料制备 的流程如下:
的流程如下:第一步:将向
 浊液中通入
浊液中通入 ,发生反应
,发生反应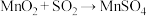 ;
;第二步:向
 溶液中加入
溶液中加入 ,有
,有 气体逸出,同时获得
气体逸出,同时获得 粗产品。
粗产品。已知部分含锰化合物的溶解性如下:
| 含锰化合物 |  |  |  |  |
| 溶解性 | 不溶 | 不溶 | 可溶 | 不溶 |
(1)①第一步的反应装置如下图所示:

②石灰乳的作用是
③反应过程中,为使
 尽可能转化完全,在通入
尽可能转化完全,在通入 与
与 比例一定,不改变
比例一定,不改变 与
与 用量的条件下,可以采取的合理措施有
用量的条件下,可以采取的合理措施有(2)若实验中将
 换成空气,测得反应液中
换成空气,测得反应液中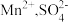 的浓度随反应时间t变化如图。导致溶液中
的浓度随反应时间t变化如图。导致溶液中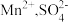 浓度变化产生明显差异的原因可能是:
浓度变化产生明显差异的原因可能是:
(3)完成第二步反应的离子方程式:

 溶液代替
溶液代替 溶液,则得到的
溶液,则得到的 中会混有较多的杂质,该杂质可能是
中会混有较多的杂质,该杂质可能是实验室可以用无色的酸性
 溶液来检验,原理如下所示:
溶液来检验,原理如下所示: 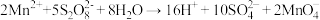
已知
 的结构如下图所示。
的结构如下图所示。
(4)标明上述反应的电子转移方向与数目
 的操作与现象是:
的操作与现象是:(5)利用重量法探究
 的热分解,数据如下表所示(残留固体均为锰的氧化物):
的热分解,数据如下表所示(残留固体均为锰的氧化物):| 实验 | 固体质量g | |
| 加热前 | 加热至 后 后 | |
| 第一组(空气氛围) | 3.450 | 2.610 |
| 第二组(氢气氛围) | 3.450 | 2.130 |
②结合两组实验数据,推测
 在空气中加热至
在空气中加热至 时发生反应的化学方程式:
时发生反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】已知 固体与硫酸可发生反应:
固体与硫酸可发生反应: ,下图是实验室制取
,下图是实验室制取 并验证
并验证 的某些性质的装置图.试回答:
的某些性质的装置图.试回答:___________________ ,证明 是
是____________ 气体。
(2)②中的实验现象为品红溶液_______________ ,证明 有
有____________ 性。
(3)③中的实验现象是____________ ,证明 有
有____________ 性,写出相应的化学方程式__________________ 。
(4)④中的实验现象是____________ ,证明 有
有____________ 性,写出相应的化学方程式___________________ 。
 固体与硫酸可发生反应:
固体与硫酸可发生反应: ,下图是实验室制取
,下图是实验室制取 并验证
并验证 的某些性质的装置图.试回答:
的某些性质的装置图.试回答: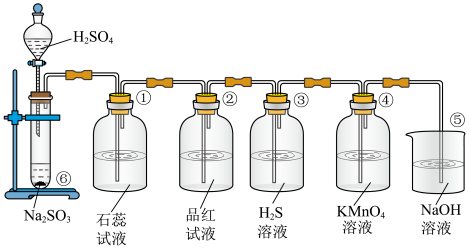
 是
是(2)②中的实验现象为品红溶液
 有
有(3)③中的实验现象是
 有
有(4)④中的实验现象是
 有
有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】甲同学在药店买了一瓶补铁剂,取一片该补铁剂用盐酸溶解,经脱色过滤后,加入1~2滴液溴,振荡,溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:___________ (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是___________
(2)现提供以下试剂:A.酸性高锰酸钾溶液B.氢氧化钠溶液C.四氧化碳D.硫氰化钾溶液。请你判断:推断正确的是___________ 同学(填甲或乙),并用两种方法对你的推断加以验证,写出选用的试剂编号及实验中观察到的现象:
(3)用(2)所提供的试剂___________ (填能或不能)确定该补铁剂经脱色后的溶液中含 。若能,请写出实验方法和现象。
。若能,请写出实验方法和现象。
若不能,请说出理由。
(4)补铁剂中铁元素含量的测定通常使用到双氧水,请写出双氧水与亚铁离子反应的离子方程式___________ 。
(5)丙同学在街头看到有人用刀把胳膊划的“鲜血直流”,贴上膏药两分钟后竟然“痊愈”,请你揭秘骗子的小把戏___________ (用离子方程式表示,可加适当语言描述)。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是:
(2)现提供以下试剂:A.酸性高锰酸钾溶液B.氢氧化钠溶液C.四氧化碳D.硫氰化钾溶液。请你判断:推断正确的是
| 选用试剂(填字母) | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
 。若能,请写出实验方法和现象。
。若能,请写出实验方法和现象。| 实验方法 | 实验现象 |
(4)补铁剂中铁元素含量的测定通常使用到双氧水,请写出双氧水与亚铁离子反应的离子方程式
(5)丙同学在街头看到有人用刀把胳膊划的“鲜血直流”,贴上膏药两分钟后竟然“痊愈”,请你揭秘骗子的小把戏
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
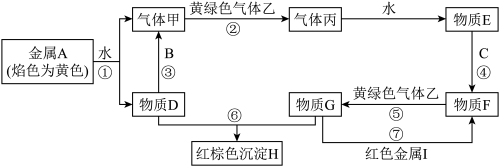
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C__ 、H__ ;
(2)写出反应⑦的离子方程式:__ ;
(3)实验室检验物质G中阳离子的常用试剂是:__ ;实验室检验物质D中阳离子的方法是__ 。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C
(2)写出反应⑦的离子方程式:
(3)实验室检验物质G中阳离子的常用试剂是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】I.过氧化钡常温下缓慢分解,不溶于水,常用作氧化剂、漂白剂等。请回答下列问题:
(1)BaO2的电子式为__________________ 。
(2)BaCl2在氨水中与H2O2反应可得到BaO2沉淀,用一个离子反应方程式表示该原理为__________________________________________ 。
(3)配平下列反应方程式:( ) MnO4- + ( ) BaO2+= ( ) Ba2++ ( ) Mn2++ ( ) O2+ ( ) H2O
II、化合物甲由三种元素组成,某研究性学习小组按如下流程探究其组成:

已知:气体A能使品红溶液褪色,加热后品红溶液恢复至原色。取少量溶液B,滴加KSCN溶液,发现溶液变为血红色。请推测并回答:
(4)用离子反应方程式解释溶液变为血红色的原因:____________________________ 。
(5)写出形成溶液C的化学方程式:________________________________________ 。
(6)写出气体A通入溶液B中,发生氧化还原的离子反应方程式:_______________________ 。
(7)写出化合物甲的化学式______________________________ 。
(1)BaO2的电子式为
(2)BaCl2在氨水中与H2O2反应可得到BaO2沉淀,用一个离子反应方程式表示该原理为
(3)配平下列反应方程式:
II、化合物甲由三种元素组成,某研究性学习小组按如下流程探究其组成:

已知:气体A能使品红溶液褪色,加热后品红溶液恢复至原色。取少量溶液B,滴加KSCN溶液,发现溶液变为血红色。请推测并回答:
(4)用离子反应方程式解释溶液变为血红色的原因:
(5)写出形成溶液C的化学方程式:
(6)写出气体A通入溶液B中,发生氧化还原的离子反应方程式:
(7)写出化合物甲的化学式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氯气是重要的化工原料,有广泛的用途。
(1)氯气的电子式是______ 。
(2)电解饱和食盐水制氯气的离子方程式是______ 。
(3)工业上用H2和Cl2反应制HCl,反应的能量变化如图所示:

①该反应的热化学方程式是______ 。
②实验室配制FeCl3溶液时,将FeCl3固体溶解在稀盐酸中,请结合离子方程式用平衡移动原理解释原因______ 。
(4)新制饱和氯水中存在:Cl2+H2O HCl+HClO,为使平衡向正反应方向移动,下列措施可行的是
HCl+HClO,为使平衡向正反应方向移动,下列措施可行的是______ 。
a.加少量NaOH固体 b.加CaCO3固体 c.加NaCl固体
(5)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3=NH2Cl+HCl。NH2Cl能与水反应生成可以杀菌消毒的物质,该反应中元素的化合价不变。
①NH2Cl与水反应的化学方程式是______ 。
②在Cl2+NH3=NH2Cl+HCl中,每消耗11.2 L Cl2(标准状况下),转移电子______ mol。
(1)氯气的电子式是
(2)电解饱和食盐水制氯气的离子方程式是
(3)工业上用H2和Cl2反应制HCl,反应的能量变化如图所示:

①该反应的热化学方程式是
②实验室配制FeCl3溶液时,将FeCl3固体溶解在稀盐酸中,请结合离子方程式用平衡移动原理解释原因
(4)新制饱和氯水中存在:Cl2+H2O
 HCl+HClO,为使平衡向正反应方向移动,下列措施可行的是
HCl+HClO,为使平衡向正反应方向移动,下列措施可行的是a.加少量NaOH固体 b.加CaCO3固体 c.加NaCl固体
(5)“氯胺(NH2Cl)消毒法”是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3=NH2Cl+HCl。NH2Cl能与水反应生成可以杀菌消毒的物质,该反应中元素的化合价不变。
①NH2Cl与水反应的化学方程式是
②在Cl2+NH3=NH2Cl+HCl中,每消耗11.2 L Cl2(标准状况下),转移电子
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】硒(Se)是第四周期第VIA族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g) 2Se(s)+2H2O(l)△H1=akJ/mol
2Se(s)+2H2O(l)△H1=akJ/mol
②2H2(g)+O2(g) 2H2O(l)△H2=bkJ·mol-1
2H2O(l)△H2=bkJ·mol-1
则反应H2(g)+Se(s) H2Se(g)△H3=
H2Se(g)△H3=___________ kJ/mol(用含a、b的代数式表不)。
(2)T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s) H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是__________ (填字母代号)。
a.气体的密度不变b.v(H2)= v(H2Se)
c.气体的压强不变d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高,请用化学平衡理论解释:_____________________________________________ 。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:

则制备H2Se的最佳温度和压强为______________________________ 。
(3)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为_________ ,最后通入SO2析出硒单质。
(4)已知常温下H2Se的电离平衡常数K1=1.3×10-4,K2=5.0×10-11,则NaHSe溶液呈__________ (填“酸性”或“碱性”),请通过计算数据说明___________________________ 。
(1)已知:①2H2Se(g)+O2(g)
 2Se(s)+2H2O(l)△H1=akJ/mol
2Se(s)+2H2O(l)△H1=akJ/mol②2H2(g)+O2(g)
 2H2O(l)△H2=bkJ·mol-1
2H2O(l)△H2=bkJ·mol-1则反应H2(g)+Se(s)
 H2Se(g)△H3=
H2Se(g)△H3=(2)T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s)
 H2Se(g)。
H2Se(g)。①下列情况可判断反应达到平衡状态的是
a.气体的密度不变b.v(H2)= v(H2Se)
c.气体的压强不变d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高,请用化学平衡理论解释:
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:

则制备H2Se的最佳温度和压强为
(3)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为
(4)已知常温下H2Se的电离平衡常数K1=1.3×10-4,K2=5.0×10-11,则NaHSe溶液呈
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】某工业废水中含有CN-和Cr2O 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
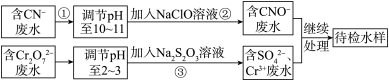
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为_______ 。
(2)步骤③的反应为 (未配平),则每反应0.1molCr2O72-时,消耗S2O32-
(未配平),则每反应0.1molCr2O72-时,消耗S2O32-_____ mol。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是______ 。
(4)在25℃下,将 的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a
的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a____ 0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=____ 。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式是_______ ;________ 。
 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为
(2)步骤③的反应为
 (未配平),则每反应0.1molCr2O72-时,消耗S2O32-
(未配平),则每反应0.1molCr2O72-时,消耗S2O32-(3)含Cr3+废水可以加入熟石灰进一步处理,目的是
(4)在25℃下,将
 的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a
的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中Ca2+的含量(100mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020mol·L-1(NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中c(Ca2+)≤1.0×10-5mol·L-1,应保持溶液中c(C2O42-)≥_____ mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为_____ 。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将____ (填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量_____ (写出计算过程)。
①准确量取5.00mL血液样品,处理后配制成50.00mL溶液;
②准确量取溶液10.00mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00mL0.0010mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020mol·L-1(NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中c(Ca2+)≤1.0×10-5mol·L-1,应保持溶液中c(C2O42-)≥
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将
(4)计算血样中Ca2+的含量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3
②5Fe2+ +MnO4- +8H+ =5Fe3+ +Mn2+ +4H2O 5C2O42- +2MnO4- +16H+ =10CO2↑+2Mn2+ +8H2O
(1)除杂过程中加入Fe的作用是___________________________ 。
(2)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____ 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2mol·L-1 的H2SO4溶解。
步骤2:用c mol·L-1标准KMnO4溶液滴定,消耗其体积a mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液b mL。
① KMnO4溶液应该装在_______________ 滴定管中。
② 用KMnO4溶液滴定待测液,达到滴定终点的标志是__________________________________ 。
③ 下列操作会导致测定结果中样品的C2O42- 的物质的量偏大的是____________________
A. 步骤2中,滴定管未用标准KMnO4 溶液润洗
B. 步骤3中加入Zn不足
C. 步骤2中,读标准溶液体积时,先仰视后俯视
D. 步骤4中,读标准溶液体积时,先俯视后仰视
④ 样品中C2O42- 的物质的量为_______________________ 。
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+ 的浓度随反应时间t的变化如下图,其变化趋势的原因可能为__________________________________ 。


已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3
②5Fe2+ +MnO4- +8H+ =5Fe3+ +Mn2+ +4H2O 5C2O42- +2MnO4- +16H+ =10CO2↑+2Mn2+ +8H2O
(1)除杂过程中加入Fe的作用是
(2)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2mol·L-1 的H2SO4溶解。
步骤2:用c mol·L-1标准KMnO4溶液滴定,消耗其体积a mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液b mL。
① KMnO4溶液应该装在
② 用KMnO4溶液滴定待测液,达到滴定终点的标志是
③ 下列操作会导致测定结果中样品的C2O42- 的物质的量偏大的是
A. 步骤2中,滴定管未用标准KMnO4 溶液润洗
B. 步骤3中加入Zn不足
C. 步骤2中,读标准溶液体积时,先仰视后俯视
D. 步骤4中,读标准溶液体积时,先俯视后仰视
④ 样品中C2O42- 的物质的量为
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+ 的浓度随反应时间t的变化如下图,其变化趋势的原因可能为

您最近一年使用:0次

 (C2H4)
(C2H4)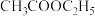 (CH3COOH)
(CH3COOH)


