(1)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJ•mol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJ•mol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H=______ kJ•mol-1(用含a、b的代数式表示)。
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,试回答下列问题:
①若起始时c(CO)=2mol•L﹣1,c(H2O)=3mol•L﹣1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=__ .
②在相同温度下,若起始时c(CO)=1mol•L﹣1,c(H2O)=2mol•L﹣1,反应进行一段时间后,测得H2的浓度为0.5mol•L﹣1,则此时该反应是否达到平衡状态__ (填“是”与“否”),此时v(正)__ v(逆)(填“大于”“小于”或“等于”),你判断的依据是____________________
③若降低温度,该反应的K值将__ ,该反应的化学反应速率将__ (均填“增大”“减小”或“不变”).
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJ•mol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJ•mol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H=
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,试回答下列问题:
①若起始时c(CO)=2mol•L﹣1,c(H2O)=3mol•L﹣1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
②在相同温度下,若起始时c(CO)=1mol•L﹣1,c(H2O)=2mol•L﹣1,反应进行一段时间后,测得H2的浓度为0.5mol•L﹣1,则此时该反应是否达到平衡状态
③若降低温度,该反应的K值将
更新时间:2018-06-15 21:12:26
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】氮及氮的化合物有着重要的用途。
(1)氮元素在周期表中的位置是______ ; NH3的电子式是______ 。
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径______ (用化学方程式表示)。
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:

下列说法正确的是______ (选填字母)。
a 图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g) △H= -92.4 kJ/mol,2H2(g)+O2(g)=2H2O(g) △H = -483.6kJ/mol,则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是________ 。
(5)水合肼(N2H4•H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是________ 。
(1)氮元素在周期表中的位置是
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德•埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:

下列说法正确的是
a 图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g) △H= -92.4 kJ/mol,2H2(g)+O2(g)=2H2O(g) △H = -483.6kJ/mol,则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是
(5)水合肼(N2H4•H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】(1)有些反应的反应热虽然无法直接测得,但可通过盖斯定律间接的方法测定。用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜,其热化学方程式是:
Cu(s) + H2O2(l) + H2SO4(aq) = CuSO4(aq) + 2H2O(l) △H1 = -320kJ/mol
又知:2H2O2(l) = 2H2O(l) + O2(g) △H2= -196kJ/mol
H2(g) + O2(g) = H2O(l) △H3= -286kJ/mol
O2(g) = H2O(l) △H3= -286kJ/mol
则反应Cu(s) + H2SO4(aq) = CuSO4(aq) + H2(g)的△H=_____________ 。
(2)右图是铜锌原电池装置。其电池的总反应是:Zn(s) + CuSO4(aq)= ZnSO4(aq)+ Cu(s)。

①R中的阳离子移向溶液__________ (填A、B)。
②X为原电池的____________ 极,其电极反应式是______________ 。
③25℃时,用石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为_____________ ; 此时得到的O2在标准状况下的体积为__________ ,溶液的pH=________ (溶液体积变化忽略不计)。
Cu(s) + H2O2(l) + H2SO4(aq) = CuSO4(aq) + 2H2O(l) △H1 = -320kJ/mol
又知:2H2O2(l) = 2H2O(l) + O2(g) △H2= -196kJ/mol
H2(g) +
 O2(g) = H2O(l) △H3= -286kJ/mol
O2(g) = H2O(l) △H3= -286kJ/mol则反应Cu(s) + H2SO4(aq) = CuSO4(aq) + H2(g)的△H=
(2)右图是铜锌原电池装置。其电池的总反应是:Zn(s) + CuSO4(aq)= ZnSO4(aq)+ Cu(s)。

①R中的阳离子移向溶液
②X为原电池的
③25℃时,用石墨电极电解2.0L 0.25 mol·L-1 CuSO4溶液,5min后在一个电极上有6.4gCu析出。则阳极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】NF3是一种有毒、无味、无色的气体,NF3气体作为刻蚀剂和清洗剂在电子工业中有广泛的应用,回答下列问题:
(1)F2和液氨直接反应可制备NF3,反应的化学方程式为_____________________ 。反应过程中会涉及副反应:4F2+2NH3=N2F2+6HF,其中N2F2的结构式可表示为_______________ 。
(2)F2和固态(NH4)3AlF6反应可制备NF3,反应的化学方程式为:(NH4)3AlF6+6F2=2NF3+8HF+NH4AlF4,NH4AlF4+3F2=NF3+4HF+AlF3。若1 mol F2参加反应,最多可制得NF3______ mol,此时反应中转移电子______ mol。
(3)工业上用惰性电极电解含HF、NH4F等无水熔融物的方法生产NF3。电解过程中阳极的电极反应式为_______________________ ,阴极的电极反应式为______________________ 。
(4)一定条件下,向一带活塞的密闭容器中充入1 mol NF3气体,此时容器的体积为V L,在该条件下发生反应2NF3 N2+3F2,达到平衡时测得容器中N2的浓度为0.1 mol·L−1,则平衡时NF3的浓度为
N2+3F2,达到平衡时测得容器中N2的浓度为0.1 mol·L−1,则平衡时NF3的浓度为_________ mol·L−1。
(1)F2和液氨直接反应可制备NF3,反应的化学方程式为
(2)F2和固态(NH4)3AlF6反应可制备NF3,反应的化学方程式为:(NH4)3AlF6+6F2=2NF3+8HF+NH4AlF4,NH4AlF4+3F2=NF3+4HF+AlF3。若1 mol F2参加反应,最多可制得NF3
(3)工业上用惰性电极电解含HF、NH4F等无水熔融物的方法生产NF3。电解过程中阳极的电极反应式为
(4)一定条件下,向一带活塞的密闭容器中充入1 mol NF3气体,此时容器的体积为V L,在该条件下发生反应2NF3
 N2+3F2,达到平衡时测得容器中N2的浓度为0.1 mol·L−1,则平衡时NF3的浓度为
N2+3F2,达到平衡时测得容器中N2的浓度为0.1 mol·L−1,则平衡时NF3的浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知化学反应
①:Fe(s)+CO2(g) FeO(s)+CO(g),其化学平衡常数为K1
FeO(s)+CO(g),其化学平衡常数为K1
②:Fe(s)+H2O(g) FeO(s)+H2(g),其化学平衡常数为K2
FeO(s)+H2(g),其化学平衡常数为K2
在温度973 K和1173 K的情况下,K1、K2的值分别如下:
请填空:
(1)通过表格中的数值可以推断:反应①是_______ (填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=_______ 。推断出反应③是_______ (填“吸热”或“放热”)反应。
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_______ (填写字母序号)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
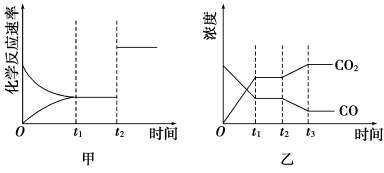
①图甲中t2时刻发生改变的条件是_______ 。
②图乙中t2时刻发生改变的条件是_______ 。
①:Fe(s)+CO2(g)
 FeO(s)+CO(g),其化学平衡常数为K1
FeO(s)+CO(g),其化学平衡常数为K1②:Fe(s)+H2O(g)
 FeO(s)+H2(g),其化学平衡常数为K2
FeO(s)+H2(g),其化学平衡常数为K2在温度973 K和1173 K的情况下,K1、K2的值分别如下:
K 温度 | K1 | K2 |
| 973 K | 1.47 | 2.38 |
| 1173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是
(2)现有反应③:CO2(g)+H2(g)
 CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(4)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是
②图乙中t2时刻发生改变的条件是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】下列反应在210 ℃达到平衡:
①PCl5(g) PCl3(g)+Cl2(g) ΔH=Q1 K=1
PCl3(g)+Cl2(g) ΔH=Q1 K=1
②CO(g)+Cl2(g) COCl2(g) ΔH=-Q2 K'=5×104
COCl2(g) ΔH=-Q2 K'=5×104
③COCl2(g) CO(g)+Cl2(g) ΔH=Q3 K″
CO(g)+Cl2(g) ΔH=Q3 K″
(1)根据反应①的平衡常数K表达式,下列等式必定成立的是___ 。
A.c(PCl5)=c(PCl3)=c(Cl2)=1
B.c(PCl5)=c(PCl3)·c(Cl2)=1
C.c(PCl5)=c(PCl3)·c(Cl2)
(2)反应②和反应③的平衡常数K'和K″存在的关系为_________ 。
(3)温度不变,降低Cl2的浓度,反应③的K″的值___ (填“增大”“减小”或“不变”)。
(4)要使反应①和反应②的K值相等,应采取的措施是___ 。
A.反应①、②同时升高温度
B.反应①、②同时降低温度
C.反应①降低温度,反应②维持210 ℃
①PCl5(g)
 PCl3(g)+Cl2(g) ΔH=Q1 K=1
PCl3(g)+Cl2(g) ΔH=Q1 K=1②CO(g)+Cl2(g)
 COCl2(g) ΔH=-Q2 K'=5×104
COCl2(g) ΔH=-Q2 K'=5×104③COCl2(g)
 CO(g)+Cl2(g) ΔH=Q3 K″
CO(g)+Cl2(g) ΔH=Q3 K″(1)根据反应①的平衡常数K表达式,下列等式必定成立的是
A.c(PCl5)=c(PCl3)=c(Cl2)=1
B.c(PCl5)=c(PCl3)·c(Cl2)=1
C.c(PCl5)=c(PCl3)·c(Cl2)
(2)反应②和反应③的平衡常数K'和K″存在的关系为
(3)温度不变,降低Cl2的浓度,反应③的K″的值
(4)要使反应①和反应②的K值相等,应采取的措施是
A.反应①、②同时升高温度
B.反应①、②同时降低温度
C.反应①降低温度,反应②维持210 ℃
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知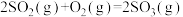
 ,在一定温度下在10 L容器中充入2 mol SO2和1 mol O2,反应2 min后达到平衡,压强变为原来的0.8,
,在一定温度下在10 L容器中充入2 mol SO2和1 mol O2,反应2 min后达到平衡,压强变为原来的0.8,
资料:容积和温度恒定时,气体压强与气体物质的量成正比;
(1)根据已知条件列出三段式__________ ;
(2)根据三段式可计算出:SO2的反应速率为___________  ,达到平衡时SO2的转化率为
,达到平衡时SO2的转化率为___________ ;该温度下反应的平衡常数为___________ 。
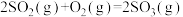
 ,在一定温度下在10 L容器中充入2 mol SO2和1 mol O2,反应2 min后达到平衡,压强变为原来的0.8,
,在一定温度下在10 L容器中充入2 mol SO2和1 mol O2,反应2 min后达到平衡,压强变为原来的0.8,资料:容积和温度恒定时,气体压强与气体物质的量成正比;

(1)根据已知条件列出三段式
(2)根据三段式可计算出:SO2的反应速率为
 ,达到平衡时SO2的转化率为
,达到平衡时SO2的转化率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】一定温度下,在10 L密闭容器中加入5mol SO2和3mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g),10min时,反应达到平衡状态,此时有3mol SO2发生了反应。
2SO3(g),10min时,反应达到平衡状态,此时有3mol SO2发生了反应。
(1)反应生成了_______ molSO3,v(SO2)=_______ 。
(2)平衡时SO3的浓度是_______ ,SO2的转化率是_______ 。
(3)该温度下,2SO2(g)+O2(g) 2SO3(g)的平衡常数K=
2SO3(g)的平衡常数K=_______ 。
 2SO3(g),10min时,反应达到平衡状态,此时有3mol SO2发生了反应。
2SO3(g),10min时,反应达到平衡状态,此时有3mol SO2发生了反应。(1)反应生成了
(2)平衡时SO3的浓度是
(3)该温度下,2SO2(g)+O2(g)
 2SO3(g)的平衡常数K=
2SO3(g)的平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示。请回答下列问题:
(1)反应②是____ (填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=____ (用K1、K2表示);根据反应③判断ΔS___ 0(填“>”、“=”或“<”),在____ (填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v(正)___ v(逆)(填“>”、“=”或“<”)。
(4)根据上述表格测得焓变,下列能量关系图合理的是_____
A.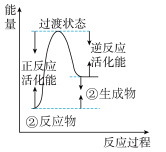 B.
B.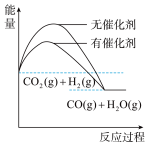 C.
C.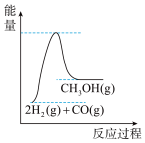 D.
D.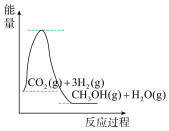
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) CO(g)+H2O(g) CO(g)+H2O(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) CH3OH(g)+H2O(g) | ΔH3 | K3 | |||
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v(正)
(4)根据上述表格测得焓变,下列能量关系图合理的是
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次




