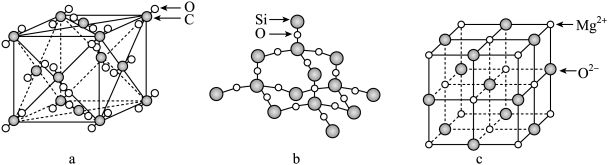
1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______ 族
(2)下列关于Ge元素叙述正确的是______ (从下列选项中选择)
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________
(4)NH3也常作制冷剂,其键角_______ (填“大于”或“小于”)109°28′,NH3的沸点(239.6 K)高于N2沸点的主要原因是___________________________
(5)图示材料的理想化学式(无空位时)为___________________ ,若Y(钇)元素的化合价为+3,则Cu的平均化合价为_______

(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为________ (只含一个系数,用a、ρ、NA表示)。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于
(2)下列关于Ge元素叙述正确的是
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是
(4)NH3也常作制冷剂,其键角
(5)图示材料的理想化学式(无空位时)为

(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为
更新时间:2018-09-01 19:16:22
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】(1)如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号至17号元素的有关数据缺失)。

①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为_____ (填元素符号);
②图中第一电离能最小的元素在周期表中的位置是___________ 。
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围________ ;
②判断下列物质是离子化合物还是共价化合物:
A.Li3N B.BeCl2 C.AlCl3 D.SiC
Ⅰ.属于离子化合物的是_____ ;Ⅱ.属于共价化合物的是____ ;请设计一个实验方案证明上述所得到的结论____

①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围在哪两种元素之间为
②图中第一电离能最小的元素在周期表中的位置是
(2)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
已知:两成键元素间电负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。
①通过分析电负性值变化规律,确定Mg元素电负性值的最小范围
②判断下列物质是离子化合物还是共价化合物:
A.Li3N B.BeCl2 C.AlCl3 D.SiC
Ⅰ.属于离子化合物的是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】第四周期中的18种元素具有重要的用途。
(1)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1℃,沸点为186℃,则GeBr4晶体类型为_______ ,中心原子的杂化类型为_______ 。
(2)第四周期VA-ⅦA族的元素中,电负性由大到小的顺序为(用元素符号表示)_______ 。
(3)金属镍在材料科学上也有重要作用,它易形成配合物,如:Ni(CO)4、[Ni (NH3)6]2+等。写出一种与配体CO互为等电子体的阴离子_______ ;配体NH3分子的空间构型为_______ 。
(4)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价电子排布式为_______ ,第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但Ga的第一电离能却明显低于Zn,原因是_______ 。
(1)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1℃,沸点为186℃,则GeBr4晶体类型为
(2)第四周期VA-ⅦA族的元素中,电负性由大到小的顺序为(用元素符号表示)
(3)金属镍在材料科学上也有重要作用,它易形成配合物,如:Ni(CO)4、[Ni (NH3)6]2+等。写出一种与配体CO互为等电子体的阴离子
(4)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价电子排布式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氮及其化合物在工农业生产中用途广泛。
(1)基态氮原子的外围电子轨道表示式为________________________ ;与N同周期的主族元素中,电负性大于N的有_______ 种。
(2)在高压下,氮气会聚合生成高聚氮。在高聚氮晶体中,每个氮原子都通过三个单键与其它氮原子结合并向空间发展,构成立体网状结构。已知该晶体中N—N的键能为160kJ/mol,而氮气中N≡N的键能为942kJ/mol,则1mol N2聚合生成高聚氮能量变化是_______ kJ。
(3)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:____________ , 的空间构型为
的空间构型为_________ 。
(4)据报道美国科学家合成了一种名为“N5”的物质,具有极强的爆炸性,又称为 “盐粒炸弹”。“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是____ 个单位正电荷。
(5)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。

①分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知
),已知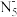 为平面结构且含有大π键,则
为平面结构且含有大π键,则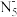 中的大π键应表示为
中的大π键应表示为____________ 。
②图中虚线代表氢键,其表示式为( )N—H···Cl、(
)N—H···Cl、( )N—H…N(
)N—H…N(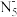 )、
)、______________ 。
(6)用干燥的液氨作用于S2Cl2的CCl4溶液中可制S4N4(结构如图),化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl上述反应过程中,没有破坏或形成的微粒间作用力是_______ 。

a.离子键 B.配位键 C.金属键 D.氢键 E.范德华力 F.极性键 G.非极性键
(1)基态氮原子的外围电子轨道表示式为
(2)在高压下,氮气会聚合生成高聚氮。在高聚氮晶体中,每个氮原子都通过三个单键与其它氮原子结合并向空间发展,构成立体网状结构。已知该晶体中N—N的键能为160kJ/mol,而氮气中N≡N的键能为942kJ/mol,则1mol N2聚合生成高聚氮能量变化是
(3)NaN3在强烈撞击的情况下快速分解并产生大量氮气,可用于汽车安全气囊的制造。写出一种与
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式: 的空间构型为
的空间构型为(4)据报道美国科学家合成了一种名为“N5”的物质,具有极强的爆炸性,又称为 “盐粒炸弹”。“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是
(5)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。

①分子中的大π键可用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知
),已知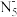 为平面结构且含有大π键,则
为平面结构且含有大π键,则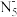 中的大π键应表示为
中的大π键应表示为②图中虚线代表氢键,其表示式为(
 )N—H···Cl、(
)N—H···Cl、( )N—H…N(
)N—H…N(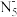 )、
)、(6)用干燥的液氨作用于S2Cl2的CCl4溶液中可制S4N4(结构如图),化学反应方程为:6S2Cl2+16NH3=S4N4+S8+12NH4Cl上述反应过程中,没有破坏或形成的微粒间作用力是

a.离子键 B.配位键 C.金属键 D.氢键 E.范德华力 F.极性键 G.非极性键
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为_______ ,下列对XeF2中心原子杂化方式推断合理的是_______ (填标号)。
A.sp B.sp2 C.sp3 D.sp3d
A.sp B.sp2 C.sp3 D.sp3d
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】C、Si、S和N元素在化学中占有极其重要的地位。
(1)写出Si的基态原子价电子排布式______ 。从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为______ 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为______ ,微粒间存在的作用力是______ 。
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是______ 。
(4)SO2、NO2、H2S同属于______ 结构(填“三角锥形”、“直线型”或“V字型”)。从微观结构角度分析,其中一种分子又与另二种分子有不同之处,该分子的化学式是______ 。
(1)写出Si的基态原子价电子排布式
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(3)氧化物MO的电子总数与SiC的相等,MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是
(4)SO2、NO2、H2S同属于
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A与B同周期、A与D同族,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)E原子核外电子排布式是_____________ 。
(2)B的最高价含氧酸根的空间构型为__________________ 。
(3)A、B、D三种元素电负性由大到小排列顺序为____________ 。
(4)D单质比化合物DA的熔点____ (填“高”或“低”),理由是_______________ 。
(5)已知A、C和地壳中含量最多的元素按1∶1∶2的原子个数比可形成某离子化合物,该化合物能使酸性高锰酸钾溶液褪色,写出发生反应的离子方程式___________________________ 。
(1)E原子核外电子排布式是
(2)B的最高价含氧酸根的空间构型为
(3)A、B、D三种元素电负性由大到小排列顺序为
(4)D单质比化合物DA的熔点
(5)已知A、C和地壳中含量最多的元素按1∶1∶2的原子个数比可形成某离子化合物,该化合物能使酸性高锰酸钾溶液褪色,写出发生反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】工业上以黄铜矿(主要含 ,还含
,还含 等)为原料可以制备
等)为原料可以制备 ,流程如下:
,流程如下:

(1)写出“浸取”时 和
和 溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。
(2)“稀释”时反应的化学方程式为_______ 。
 ,还含
,还含 等)为原料可以制备
等)为原料可以制备 ,流程如下:
,流程如下:
(1)写出“浸取”时
 和
和 溶液反应的离子方程式:
溶液反应的离子方程式:(2)“稀释”时反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知某些化学键的键能数据如下:
C—C C=C C≡C H—C O=O O—O H—O C=O
KJ/mol 348 615 812 413 498 142 463 745
(1)通过比较C—C和C=C的键能大小,简要说明为什么烯烃易发生加成反应而烷烃不能?______ 。
(2)利用键能数据可判断反应C2H4+ 3O2→ 2 CO2+ 2 H2O为________ (吸热或放热)反应,并计算每生成1 mol CO2所吸收或放出的热量为_____________ KJ。
(3)若某有机物的结构简式如下: ,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:
,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:________________
(4)将硫酸铜白色固体溶于水得到_______ 色的溶液,原因是生成了一种配合离子,其结构简式为:___________ (标明配位键),向该溶液中加入过量稀氨水得_________ 色溶液,其离子方程式为_________ 。
C—C C=C C≡C H—C O=O O—O H—O C=O
KJ/mol 348 615 812 413 498 142 463 745
(1)通过比较C—C和C=C的键能大小,简要说明为什么烯烃易发生加成反应而烷烃不能?
(2)利用键能数据可判断反应C2H4+ 3O2→ 2 CO2+ 2 H2O为
(3)若某有机物的结构简式如下:
 ,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:
,一定条件下与HCl发生加成反应后可能生成两种互为同分异构体的物质,写出其中属于手性分子的物质的结构简式:(4)将硫酸铜白色固体溶于水得到
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】铜是生命必要的元素,也是人类最早使用的金属之一,西汉时期《淮南万毕术》里就有“曾青得铁,则化为铜”的记载,曾青可能是碳酸铜一类物质,把其溶于酸中得溶液,当把铁粉投入此溶液即可得铜。
(1)根据学过的化学知识,写出该过程的离子方程式:________ 。
(2)在化学反应中,铜元素可表现为0、+1、+2。Cu2+ 的未成对电子数有______ 个,向硫酸铜溶液中加入过量的氨水可以得到 [Cu(NH3)4]SO4 溶液,[Cu(NH3)4]2+的结构简式为___ 。
(3)向[Cu(NH3)4]SO4 水溶液中通入SO2 气体至溶液呈微酸性,析出白色沉淀CuNH4SO3。反应化学方程式为_____________ 。
(4)CuNH4SO3 与足量的硫酸混合并微热,得到金属Cu等物质,本法制得的Cu呈超细粉末状,有重要用途,写出该反应的离子方程式________ ,若该反应在密闭容器中进行,且酸量充足,计算反应物中Cu元素变成超细粉末Cu的转化率_______ ,理由是__________ 。
(1)根据学过的化学知识,写出该过程的离子方程式:
(2)在化学反应中,铜元素可表现为0、+1、+2。Cu2+ 的未成对电子数有
(3)向[Cu(NH3)4]SO4 水溶液中通入SO2 气体至溶液呈微酸性,析出白色沉淀CuNH4SO3。反应化学方程式为
(4)CuNH4SO3 与足量的硫酸混合并微热,得到金属Cu等物质,本法制得的Cu呈超细粉末状,有重要用途,写出该反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】Si与P形成的某化合物晶体的晶胞如图。该晶体类型是___________ ,该化合物的化学式为___________ 。
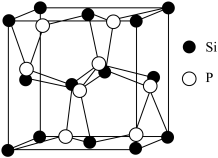

您最近一年使用:0次
【推荐2】铂及其配合物在生活中有重要应用。
(1)顺铂有抗癌作用。机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的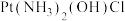 与DNA结合,破坏DNA的结构,阻止癌细胞增殖。如:
与DNA结合,破坏DNA的结构,阻止癌细胞增殖。如:

①基态Cu原子价层电子排布式为_______ 。
②鸟嘌呤与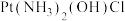 反应的产物中包含的化学键
反应的产物中包含的化学键_______ 。
A氢键 B.离子键 C.共价键 D.配位键
③在 ,配体与铂(Ⅱ)的结合能力:
,配体与铂(Ⅱ)的结合能力:
_______ ( 填“>”或“<”)。
填“>”或“<”)。
(2)顺铂和反铂互为同分异构体,两者的结构和性质如下。
①推测 的结构是
的结构是_______ (填“平面四边形”或“四面体形”)。
②顺铂在水中的溶解度大于反铂的原因是_______ 。
(3)铂晶胞为立方体,边长为a pm,结构如图:
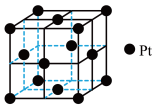
下列说法正确的是_______。
(1)顺铂有抗癌作用。机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的
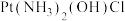 与DNA结合,破坏DNA的结构,阻止癌细胞增殖。如:
与DNA结合,破坏DNA的结构,阻止癌细胞增殖。如:
①基态Cu原子价层电子排布式为
②鸟嘌呤与
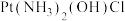 反应的产物中包含的化学键
反应的产物中包含的化学键A氢键 B.离子键 C.共价键 D.配位键
③在
 ,配体与铂(Ⅱ)的结合能力:
,配体与铂(Ⅱ)的结合能力:
 填“>”或“<”)。
填“>”或“<”)。(2)顺铂和反铂互为同分异构体,两者的结构和性质如下。
| 顺铂 | 反铂 | |
| 空间结构 |  | 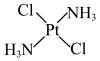 |
| 25℃时溶解度/g | 0.2577 | 0.0366 |
 的结构是
的结构是②顺铂在水中的溶解度大于反铂的原因是
(3)铂晶胞为立方体,边长为a pm,结构如图:

下列说法正确的是_______。
| A.该晶胞中含有的铂原子数目为4 |
| B.该晶体中,每个铂原子周围与它最近且等距离的铂原子有8个 |
C.该晶体的密度为 |
D.该晶体中铂原子之间的最近距离为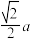 pm pm |
您最近一年使用:0次