(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成________ 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度为________ 。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
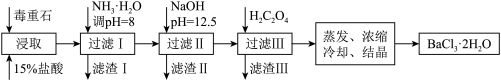
①毒重石用盐酸浸取前需充分研磨,目的是________ 。
②加入NH3·H2O调节pH=8可除去________ (填离子符号),滤渣Ⅱ中含________ (填化学式)。加入H2C2O4时应避免过量,原因是________ 。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是___ (填字母)。
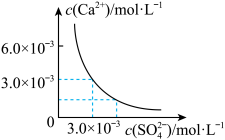
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

①毒重石用盐酸浸取前需充分研磨,目的是
②加入NH3·H2O调节pH=8可除去
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL 0.01mol·L-1 Na2SO4溶液,下列叙述正确的是

A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
更新时间:2018-09-25 17:45:28
|
相似题推荐
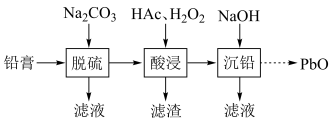
【推荐1】废旧铅蓄电池的铅膏中主要含有 、
、 、PbO和Pb.还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
、PbO和Pb.还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
(1)在“脱硫”中 转化反应的离子方程式为
转化反应的离子方程式为___________ ,用沉淀溶解平衡原理解释选择 的原因:
的原因:___________ 。
(2)在“酸浸”中,除加入醋酸(HAc),还要加入 。
。
①能被 氧化的离子是
氧化的离子是___________ 。
② 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为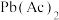 ,其化学方程式为
,其化学方程式为___________ 。
③ 也能使
也能使 转化为
转化为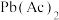 ,
, 的作用是
的作用是___________ 。
(3)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是___________ 。
(4)“沉铅”的滤液中,金属离子有___________ 。
 、
、 、PbO和Pb.还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
、PbO和Pb.还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
| 难溶电解质 |  |  |  |  |
 | 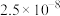 | 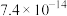 | 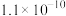 |  |
| 金属氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
 转化反应的离子方程式为
转化反应的离子方程式为 的原因:
的原因:(2)在“酸浸”中,除加入醋酸(HAc),还要加入
 。
。①能被
 氧化的离子是
氧化的离子是②
 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为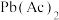 ,其化学方程式为
,其化学方程式为③
 也能使
也能使 转化为
转化为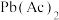 ,
, 的作用是
的作用是(3)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是
(4)“沉铅”的滤液中,金属离子有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】HA是一元弱酸,其电离常数为Ka,难溶盐MA的溶度积为Ksp,M+不发生水解。将一定量固体MA加入水中,向溶液中加入不含A元素、M元素的酸或者碱调节pH,此过程中固体始终有剩余。实验发现,298K时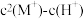 为线性关系,如下图中实线所示。回答下列问题。
为线性关系,如下图中实线所示。回答下列问题。
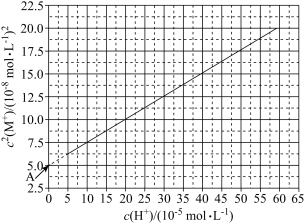
(1)定义: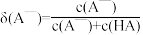 ,则
,则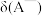 =
=___________ 。(用含Ka和c(H+)的式子表示)。
(2)不论加入酸或者碱的量如何,c(M+)与含A粒子之间的关系式为___________ 。
(3)写出c2(M+)与c(H+)之间的关系式___________ 。(用含Ka和Ksp的式子表示)。
(4)结合图象数据可得Ksp=___________ 和Ka=___________ 。
(5)图象中靠近A点的虚线表示实际很难测得,A点实际是反向延长得到的,解释为什么实际中测不到A点的数据。___________ 。注:此题改编自2021年高考选择题最后一题,同学们考后可思考若难溶盐为MA2,则是否还存在如图象的线性关系?
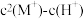 为线性关系,如下图中实线所示。回答下列问题。
为线性关系,如下图中实线所示。回答下列问题。
(1)定义:
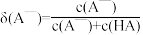 ,则
,则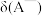 =
=(2)不论加入酸或者碱的量如何,c(M+)与含A粒子之间的关系式为
(3)写出c2(M+)与c(H+)之间的关系式
(4)结合图象数据可得Ksp=
(5)图象中靠近A点的虚线表示实际很难测得,A点实际是反向延长得到的,解释为什么实际中测不到A点的数据。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某小组以黄铜矿(主要成分为 CuFeS2,含少量SiO2等杂质)为原料制备铜化工产品CuAlO2的一种工艺如下:
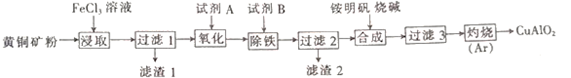
已知①过滤1所得滤液中含金属离子有:Cu2+、Fe2+和Fe3+,滤渣1的主要成分是:SiO2和S;
②Cu(OH)2+4NH3·H2O====[Cu(NH3)4]2++2OH-+4H2O。
(1)从产品纯度、环保操作方便等角度考虑,试剂A、B的最佳组合是__________ (填代号)

(2)铵明矾的化学式为NH4Al(SO4)2·12H2O,它为制备铜化工产品提供铝源。铵明矾溶液中NH4+、A13+、H+、OH-、SO42-浓度大小排序为______________________________ 。
(3)过滤3得到A1(OH)3和Cu(OH)2,写出“灼烧”发生化学反应的方程式:______________________________ 。
(4)单位时间内“浸取”Cu2+的百分率(称为浸出率)与溶液浓度、温度关系如图1所示。
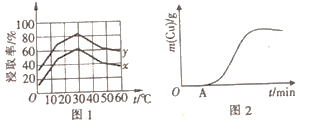
在20℃时,1L溶液中有效碰撞总次数:x_________ y(填“>”“<”或“=”)。相同浓度下,温度高于30℃,“浸出率”降低的主要原因是____________________________________ 。
(5)以铜、石墨为电极,电解“过滤1”所得溶液制备铜,铜的质量与通电时间关系如图2所示。写出OA段阴极的反应方程式:___________________________ 。
(6)常温下,Ksp[Fe(OH)3]=4.0×10-38。加入试剂B调节pH=3时c(Fe3+)=_________ mol·L-1

已知①过滤1所得滤液中含金属离子有:Cu2+、Fe2+和Fe3+,滤渣1的主要成分是:SiO2和S;
②Cu(OH)2+4NH3·H2O====[Cu(NH3)4]2++2OH-+4H2O。
(1)从产品纯度、环保操作方便等角度考虑,试剂A、B的最佳组合是

(2)铵明矾的化学式为NH4Al(SO4)2·12H2O,它为制备铜化工产品提供铝源。铵明矾溶液中NH4+、A13+、H+、OH-、SO42-浓度大小排序为
(3)过滤3得到A1(OH)3和Cu(OH)2,写出“灼烧”发生化学反应的方程式:
(4)单位时间内“浸取”Cu2+的百分率(称为浸出率)与溶液浓度、温度关系如图1所示。

在20℃时,1L溶液中有效碰撞总次数:x
(5)以铜、石墨为电极,电解“过滤1”所得溶液制备铜,铜的质量与通电时间关系如图2所示。写出OA段阴极的反应方程式:
(6)常温下,Ksp[Fe(OH)3]=4.0×10-38。加入试剂B调节pH=3时c(Fe3+)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
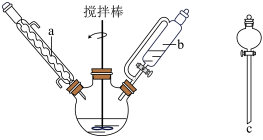
【推荐1】山梨酸乙酯对细菌、霉菌等有很好的灭活作用,广泛地用作各类食品的保鲜剂以及家畜、家禽的消毒剂。直接酯化法合成山梨酸乙酯的反应方程式、反应装置(夹持装置省略)及有关仪器如下:

可能用到的有关数据如下表:
实验步骤:
在三颈烧瓶中加入5.6 g山梨酸、足量乙醇、带水剂环己烷、少量催化剂和几粒沸石,油浴加热三颈烧瓶,反应温度为110℃,回流4小时后停止加热和搅拌,反应液冷却至室温,滤去催化剂和沸石,将滤液倒入分液漏斗中,先用5%NaHCO3溶液洗涤至中性,再用水洗涤,分液,在有机层中加入少量无水MgSO4,静置片刻,过滤,将滤液进行蒸馏,收集195℃的馏分得到纯净的山梨酸乙酯4.7 g。
回答下列问题:
(1)仪器a的名称是_______ 。仪器b与c相比,在本实验中体现的优点是_______ 。
(2)反应中不能用水浴代替油浴加热的原因是_______ 。
(3)洗涤、分液过程中,加入5%NaHCO3溶液的目的是_______ 。
(4)在有机层中加入少量无水MgSO4的目的是_______ ; 的空间结构为
的空间结构为_______ 形。
(5)在本实验中,山梨酸乙酯的产率是_______ (精确至0.1%)。


可能用到的有关数据如下表:
| 物质 | 相对分子质量 | 密度/(g/cm3) | 沸点/℃ | 水溶性 |
| 山梨酸 | 112 | 1.204 | 228 | 易溶 |
| 乙醇 | 46 | 0.789 | 78 | 易溶 |
| 山梨酸乙酯 | 140 | 0.926 | 195 | 难溶 |
| 环己烷 | 84 | 0.780 | 80.7 | 难溶 |
在三颈烧瓶中加入5.6 g山梨酸、足量乙醇、带水剂环己烷、少量催化剂和几粒沸石,油浴加热三颈烧瓶,反应温度为110℃,回流4小时后停止加热和搅拌,反应液冷却至室温,滤去催化剂和沸石,将滤液倒入分液漏斗中,先用5%NaHCO3溶液洗涤至中性,再用水洗涤,分液,在有机层中加入少量无水MgSO4,静置片刻,过滤,将滤液进行蒸馏,收集195℃的馏分得到纯净的山梨酸乙酯4.7 g。
回答下列问题:
(1)仪器a的名称是
(2)反应中不能用水浴代替油浴加热的原因是
(3)洗涤、分液过程中,加入5%NaHCO3溶液的目的是
(4)在有机层中加入少量无水MgSO4的目的是
 的空间结构为
的空间结构为(5)在本实验中,山梨酸乙酯的产率是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某化学小组模拟湿法技术,利用废旧印刷电路板,探究回收铜和制取胆矾的实验,设计流程简图如图。
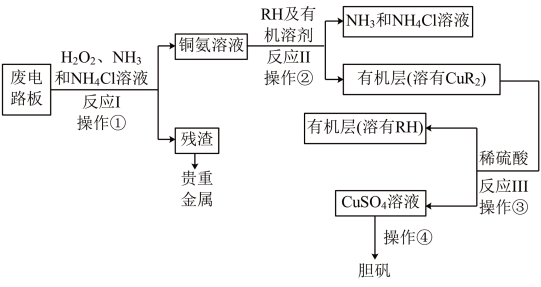
请按要求回答下列问题:
(1) 的价电子排布式为
的价电子排布式为________ 。
(2)①已知反应Ⅰ中Cu转化为 ,则反应的离子方程式为:
,则反应的离子方程式为:________ ;在其中加入 的作用是
的作用是________ 。
② 中N的杂化类型为
中N的杂化类型为________ 杂化, 形成
形成 后,相比
后,相比 中H-N-H的键角变
中H-N-H的键角变________ 。(填“大”或“小”)
(3)操作②用到的实验仪器除烧杯外,还有________ ,操作②的目的是________ 。
(4)操作④主要步骤:________ 、________ 、过滤、洗涤、干燥。

请按要求回答下列问题:
(1)
 的价电子排布式为
的价电子排布式为(2)①已知反应Ⅰ中Cu转化为
 ,则反应的离子方程式为:
,则反应的离子方程式为: 的作用是
的作用是②
 中N的杂化类型为
中N的杂化类型为 形成
形成 后,相比
后,相比 中H-N-H的键角变
中H-N-H的键角变(3)操作②用到的实验仪器除烧杯外,还有
(4)操作④主要步骤:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】碘和碘的化合物在有机化学中十分重要,另外在医药和照相方面的用途也很广泛。海带提碘的相关流程如下所示,已知 ,请回答下列问题:
,请回答下列问题:
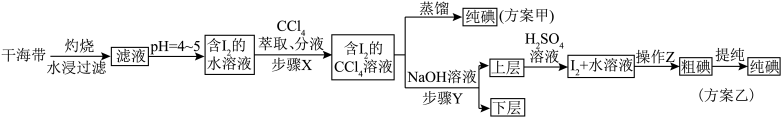
(1)海带灼烧的目的是_______ ;实验室进行此操作用到的主要仪器名称为_______ 。
(2)滤液得到含 的水溶液,除了调节
的水溶液,除了调节 ,还需要加入臭氧或过氧化氢,所加试剂在反应中作
,还需要加入臭氧或过氧化氢,所加试剂在反应中作_______ 剂(填“氧化”或“还原”),写出加入过氧化氢时发生反应的离子方程式:_______ 。
(3)步骤 是否可以用酒精代替
是否可以用酒精代替 ,并说明理由
,并说明理由_______ 。
(4)步骤 的操作为
的操作为_______ 。
(5)上层液体加入 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为_______ 。
(6)以上流程中可以循环使用的试剂是_______ 。
(7)加碘食盐中的碘以碘酸钾 形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在
形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在 。可供选用的物质有:①
。可供选用的物质有:① 试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是_______ (填序号)。
 ,请回答下列问题:
,请回答下列问题:
(1)海带灼烧的目的是
(2)滤液得到含
 的水溶液,除了调节
的水溶液,除了调节 ,还需要加入臭氧或过氧化氢,所加试剂在反应中作
,还需要加入臭氧或过氧化氢,所加试剂在反应中作(3)步骤
 是否可以用酒精代替
是否可以用酒精代替 ,并说明理由
,并说明理由(4)步骤
 的操作为
的操作为(5)上层液体加入
 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为(6)以上流程中可以循环使用的试剂是
(7)加碘食盐中的碘以碘酸钾
 形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在
形式存在,根据以上信息,可用试纸和一些常见试剂进行检验,证明食盐中存在 。可供选用的物质有:①
。可供选用的物质有:① 试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
试纸、②蓝色石蕊试纸、③碘化钾淀粉试纸、④蒸馏水、⑤食醋、⑥醇,进行上述实验时必须使用的物质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】过氧化钙( CaO2)是一种白色晶体粉末,极微溶于水,不溶于醇类、乙醚等,105 ℃左右干燥即得白色或淡黄色粉末CaO2,加热至350 ℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。
CaO2)是一种白色晶体粉末,极微溶于水,不溶于醇类、乙醚等,105 ℃左右干燥即得白色或淡黄色粉末CaO2,加热至350 ℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。
Ⅰ.CaO2的制备原理:CaCl2+H2O2+2NH3·H2O+6H2O===CaO2·8H2O↓+2NH4Cl。实验步骤、反应装置如图所示,请回答下列问题:
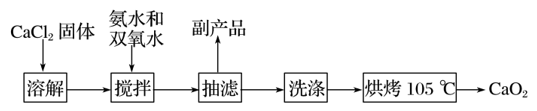
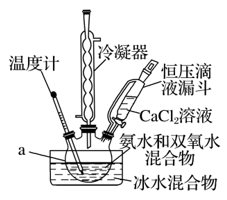
(1)仪器a的名称______________________________________________________________ 。
(2)①沉淀反应时常用冰水浴控制温度在0 ℃左右,其可能原因是____________________ (写出两点)。
②过滤后洗涤沉淀的试剂最好用________ (填字母)。
A.热水 B.冷水
C.乙醇 D.乙醚
(3)某同学设计的实验装置示意图(如图,夹持装置及冷凝水省略)有一处不合理,请提出改进方案并说明理由
________________________________________________________________________ 。
Ⅱ.产品稳定性分析:取所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.100 0 mol·L-1酸性高锰酸钾溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如下表:
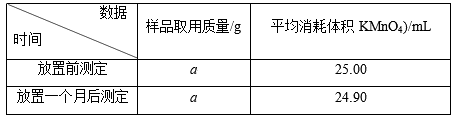
已知:①H2O2不稳定,加热、加入某些金属离子或加碱均有利于其分解。
②产品稳定性=(放置一个月后CaO2的质量分数/放置前CaO2的质量分数)×100%。
(4)用KMnO4滴定,达到滴定终点时的现象是_____________________________________ 。
(5)该产品的“产品稳定性”=__________________________________________________ 。
 CaO2)是一种白色晶体粉末,极微溶于水,不溶于醇类、乙醚等,105 ℃左右干燥即得白色或淡黄色粉末CaO2,加热至350 ℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。
CaO2)是一种白色晶体粉末,极微溶于水,不溶于醇类、乙醚等,105 ℃左右干燥即得白色或淡黄色粉末CaO2,加热至350 ℃左右开始分解放出氧气,与水缓慢反应生成H2O2,易与酸反应生成H2O2。Ⅰ.CaO2的制备原理:CaCl2+H2O2+2NH3·H2O+6H2O===CaO2·8H2O↓+2NH4Cl。实验步骤、反应装置如图所示,请回答下列问题:


(1)仪器a的名称
(2)①沉淀反应时常用冰水浴控制温度在0 ℃左右,其可能原因是
②过滤后洗涤沉淀的试剂最好用
A.热水 B.冷水
C.乙醇 D.乙醚
(3)某同学设计的实验装置示意图(如图,夹持装置及冷凝水省略)有一处不合理,请提出改进方案并说明理由
Ⅱ.产品稳定性分析:取所得产品置于试剂瓶内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.100 0 mol·L-1酸性高锰酸钾溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),以此分析产品的稳定性,所得实验数据如下表:

已知:①H2O2不稳定,加热、加入某些金属离子或加碱均有利于其分解。
②产品稳定性=(放置一个月后CaO2的质量分数/放置前CaO2的质量分数)×100%。
(4)用KMnO4滴定,达到滴定终点时的现象是
(5)该产品的“产品稳定性”=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】一种活性氧食器消毒剂的主要成分是过碳酸钠(xNa2CO3·yH2O2)。过碳酸钠具有Na2CO3和H2O2的双重性质,50℃开始分解。某实验小组同学对过碳酸钠的制备、组成与性质进行了探究。
(一)过碳酸钠的制备
实验室用Na2CO3与稳定剂的混合溶液5%的H2O2化合制备过碳酸钠,实验装置如图:
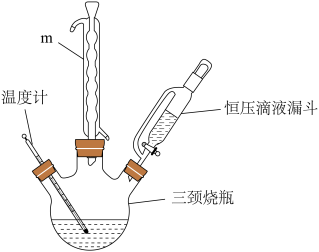
(1)仪器m的名称为___ 。
(2)恒压滴液漏斗盛装的药品是___ 。
(3)下列可用作稳定剂的是__ 。(填选项字母)。
A.FeCl3 B.CH3COOH C.Na3PO4 D.MnO2
(4)为更好的控制反应温度,采用的合适加热方式是___ 。
(二)过碳酸钠(xNa2CO3·yH2O2)组成的测定
(5)采用加热法可测定过碳酸钠(xNa2CO3·yH2O2)的组成。称取ag过碳酸钠固体样品,加热至恒重后,冷却,称量固体质量为bg。通过上述数据计算:y=__ 用含a、b、x的代数式表示)。
(三)过碳酸钠的性质
活性氧食器消毒剂可用于清洗杯温,使用说明如图所示:

(6)使用时,需要使用80°C以上热水的原因为___ 。
(7)使用时会迅速产生大量气泡,实验室检验该气体的方法为___ 。
(一)过碳酸钠的制备
实验室用Na2CO3与稳定剂的混合溶液5%的H2O2化合制备过碳酸钠,实验装置如图:

(1)仪器m的名称为
(2)恒压滴液漏斗盛装的药品是
(3)下列可用作稳定剂的是
A.FeCl3 B.CH3COOH C.Na3PO4 D.MnO2
(4)为更好的控制反应温度,采用的合适加热方式是
(二)过碳酸钠(xNa2CO3·yH2O2)组成的测定
(5)采用加热法可测定过碳酸钠(xNa2CO3·yH2O2)的组成。称取ag过碳酸钠固体样品,加热至恒重后,冷却,称量固体质量为bg。通过上述数据计算:y=
(三)过碳酸钠的性质
活性氧食器消毒剂可用于清洗杯温,使用说明如图所示:

(6)使用时,需要使用80°C以上热水的原因为
(7)使用时会迅速产生大量气泡,实验室检验该气体的方法为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示。
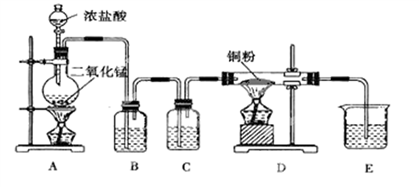
请回答下列问题:
(1)B中选用的试剂是饱和食盐水,其作用是_____ ;C中选用的试剂是________ ,其作用是_____________ 。
(2)D中反应的化学方程式是__________ ,将此生成物溶于少量水,得到_____ 色溶液。
(3)某学生应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
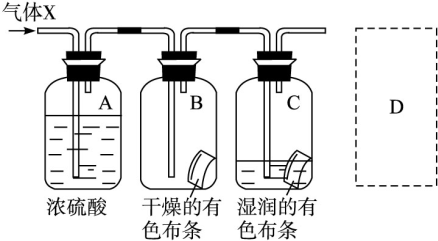
①该项研究(实验)的主要目的是_________________________________________ 。
②与研究目的直接相关的实验现象是_____________ 。
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是__________ 。
④请在图中的D处以图的形式表明克服事故隐患的措施。_____________

请回答下列问题:
(1)B中选用的试剂是饱和食盐水,其作用是
(2)D中反应的化学方程式是
(3)某学生应用如图所示的方法研究物质的性质,其中气体X的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:

①该项研究(实验)的主要目的是
②与研究目的直接相关的实验现象是
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是
④请在图中的D处以图的形式表明克服事故隐患的措施。
您最近一年使用:0次



