硼、镁及其化合物在工农业生产中应用广泛。
I.已知硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:
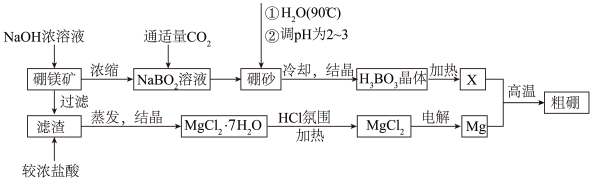
(1)硼砂中B元素的化合价为_______ ,将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取H3BO3,该反应的离子方程式为____________________ 。X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为_____________ 。
(2)由MgCl2·7H2O制备MgCl2时,需要在HCl氛围中加热,其目的是________ 。
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+=Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为_____________ mol·L-1。已知该温度下,Ksp[Mg(OH)2]=5.6×10-12,当电解质溶液的pH=6时,_______ (填“有”或“无”)Mg(OH)2沉淀析出。(忽略反应过程中溶液的体积变化)
II.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。
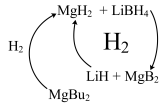
(4)写出放氢过程中发生反应的化学方程式:____________ 。
III. MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:
①Mg(OH)2+SO2=MgSO3+H2O
②MgSO3+SO2+H2O=Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2=2MgSO3+2H2O
④2MgSO3+O2=2MgSO4
已知25℃时,Ksp(MgSO3)=3.86×10-3,Ksp(CaSO3)=3.1×10-7。
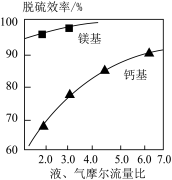
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。镁基的脱硫效率总比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为_____________ 。
I.已知硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如下所示:

(1)硼砂中B元素的化合价为
(2)由MgCl2·7H2O制备MgCl2时,需要在HCl氛围中加热,其目的是
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+=Mg2++2H2O,常温下,若起始电解质溶液pH=1,则pH=2时,电解质溶液中所含Mg2+的物质的量浓度为
II.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。
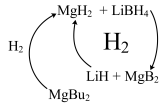
(4)写出放氢过程中发生反应的化学方程式:
III. MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:
①Mg(OH)2+SO2=MgSO3+H2O
②MgSO3+SO2+H2O=Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2=2MgSO3+2H2O
④2MgSO3+O2=2MgSO4
已知25℃时,Ksp(MgSO3)=3.86×10-3,Ksp(CaSO3)=3.1×10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。镁基的脱硫效率总比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为

更新时间:2018-12-06 16:04:41
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】利用转炉烟尘(主要成分:CuO、ZnO、PbO、Sb4O6、As2O5)制备硫酸铜联产硫酸锌以及聚合硫酸铁的工艺流程如图:

已知:①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中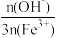 ×100%]越大,絮凝效果越好。
×100%]越大,絮凝效果越好。
回答下列问题:
(1)“酸浸渣”中所含金属化合物是______ (填化学式)。常温下,调节“酸浸液”pH为______ (保留小数点后一位)时,溶液中c(Cu2+)=0.01mol•L-1。
(2)生成Ca3(AsO4)2•Ca(OH)2的化学方程式为________ 。
(3)在一定温度下,将NaClO4加入“浓缩液”中可制取聚合硫酸铁[Fe2(OH)x(SO4)y]m。
①x和y的关系应满足:y=______ (用含x的式子表示)。
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是________ 。

(4)①“萃余液”经______ 、______ 、过滤、洗涤,得到ZnSO4•7H2O晶体。
②加热ZnSO4•7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4•7H2O(M=287g•mol-1)加热到145℃时得到ZnSO4•xH2O,其中x的值为______ ;温度为1050℃时,ZnSO4固体完全分解为ZnO以及两种气体(只有一种是氧化物),该反应的化学方程式为_______ 。


已知:①酸浸后As元素以H3AsO4形式存在;
②常温下,Ksp[Cu(OH)2]≈1.0×10-20;
③聚合硫酸铁盐基度[聚合硫酸铁中
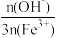 ×100%]越大,絮凝效果越好。
×100%]越大,絮凝效果越好。回答下列问题:
(1)“酸浸渣”中所含金属化合物是
(2)生成Ca3(AsO4)2•Ca(OH)2的化学方程式为
(3)在一定温度下,将NaClO4加入“浓缩液”中可制取聚合硫酸铁[Fe2(OH)x(SO4)y]m。
①x和y的关系应满足:y=
②“滤液3”中H2SO4的加入量对盐基度的影响如图所示,当n(H2SO4):n(FeSO4)>0.35时,产品的盐基度减小,其原因是

(4)①“萃余液”经
②加热ZnSO4•7H2O固体,固体质量保留百分数与温度的关系如图所示。将ZnSO4•7H2O(M=287g•mol-1)加热到145℃时得到ZnSO4•xH2O,其中x的值为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】根据《化学反应原理》知识,按要求作答。
I.在一定条件下,以CH4和H2O为原料,通过下列反应制备甲醇(CH3OH)。
已知:①
②
(1)反应①的正反应属于_______ (填“吸热”或“放热”)反 应。
(2)上述两个反应达到平衡后,在其它条件不变的情况下,通过减小容器体积增大压强,则化学平衡向正反应方向移动的是________ (填“①”或“②”)。
(3)在密闭容器中发生①反应,若CH4起始浓度为1.0 mol·L-1,水蒸气起始浓度为2.0 mol·L-1,反应进行2min后,测得CH4浓度为0.5mol·L-1,则 (CH4)=
(CH4)= ____ mol·L-1·min-1。
Ⅱ.常温下,浓度均为0.1mol·L-1的两种溶液;①氨水 ②NH4Cl溶液。
(4)写出①氨水中NH3·H2O的电离方程式:__________________ 。
(5)测得②溶液的pH<7,则溶液中c(NH )
)______ c(C1-)(填“>”“<”或“=”),写出②溶液发生水解反应的离子方程式:__________________ 。
Ⅲ.如图所示装置,用惰性电极电解熔融氯化钠(2NaCl2 2Na+Cl2↑)。
2Na+Cl2↑)。
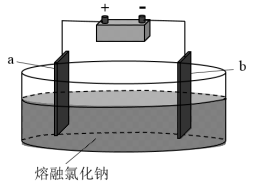
(6)通电时,Na+向______ (填“a”或“b”)电极移动,发生_______ (填“氧化反应”或“还原反应”)。
(7)电解一段时间后,在两个电极上分别生成金属钠和氯气。写出生成氯气的电极反应式:____________ 。
I.在一定条件下,以CH4和H2O为原料,通过下列反应制备甲醇(CH3OH)。
已知:①

②

(1)反应①的正反应属于
(2)上述两个反应达到平衡后,在其它条件不变的情况下,通过减小容器体积增大压强,则化学平衡向正反应方向移动的是
(3)在密闭容器中发生①反应,若CH4起始浓度为1.0 mol·L-1,水蒸气起始浓度为2.0 mol·L-1,反应进行2min后,测得CH4浓度为0.5mol·L-1,则
 (CH4)=
(CH4)= Ⅱ.常温下,浓度均为0.1mol·L-1的两种溶液;①氨水 ②NH4Cl溶液。
(4)写出①氨水中NH3·H2O的电离方程式:
(5)测得②溶液的pH<7,则溶液中c(NH
 )
)Ⅲ.如图所示装置,用惰性电极电解熔融氯化钠(2NaCl2
 2Na+Cl2↑)。
2Na+Cl2↑)。
(6)通电时,Na+向
(7)电解一段时间后,在两个电极上分别生成金属钠和氯气。写出生成氯气的电极反应式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】溶液A中存在Ba2+、Fe2+、Al3+、Fe3+、Cu2+、HCO 、CO
、CO 、Cl-、NO
、Cl-、NO 、SO
、SO 中的五种离子,浓度均为0.01mol•L-1,溶液体积为1L。对A溶液进行以下实验,整个过程如图所示(部分产物省略,pH=4时,Fe(OH)3沉淀完全),溶液B与溶液A中所含阴离子种类相同。请回答下列问题。
中的五种离子,浓度均为0.01mol•L-1,溶液体积为1L。对A溶液进行以下实验,整个过程如图所示(部分产物省略,pH=4时,Fe(OH)3沉淀完全),溶液B与溶液A中所含阴离子种类相同。请回答下列问题。
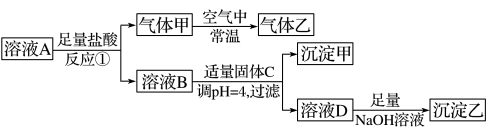
(1)溶液A中的离子为_____ ;溶液A显____ (填“酸”“碱”或“中”)性。
(2)反应①的离子方程式为_____ 。
(3)沉淀甲是____ ,沉淀乙是____ 。(填化学式)
(4)固体C可能是_____ 。
a.CuO b.Cu(OH)2c.CuSO4d.CuCl2
(5)气体甲、气体乙都能造成环境问题,将等体积的气体甲和乙通入足量NaOH溶液中,被完全吸收,写出反应的离子方程式_____ 。
 、CO
、CO 、Cl-、NO
、Cl-、NO 、SO
、SO 中的五种离子,浓度均为0.01mol•L-1,溶液体积为1L。对A溶液进行以下实验,整个过程如图所示(部分产物省略,pH=4时,Fe(OH)3沉淀完全),溶液B与溶液A中所含阴离子种类相同。请回答下列问题。
中的五种离子,浓度均为0.01mol•L-1,溶液体积为1L。对A溶液进行以下实验,整个过程如图所示(部分产物省略,pH=4时,Fe(OH)3沉淀完全),溶液B与溶液A中所含阴离子种类相同。请回答下列问题。
(1)溶液A中的离子为
(2)反应①的离子方程式为
(3)沉淀甲是
(4)固体C可能是
a.CuO b.Cu(OH)2c.CuSO4d.CuCl2
(5)气体甲、气体乙都能造成环境问题,将等体积的气体甲和乙通入足量NaOH溶液中,被完全吸收,写出反应的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】硫及其化合物在生产生活中具有广泛的应用,根据所学知识,回答下列问题:
(1)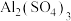 溶液显
溶液显_______________ 性,判断的理由是_______________ (用离子方程式表示),若将该溶液蒸干,最终所得固体为_______________ (填化学式)。
(2) 的
的 溶液中,各离子浓度由大到小的关系为
溶液中,各离子浓度由大到小的关系为_______________ 。
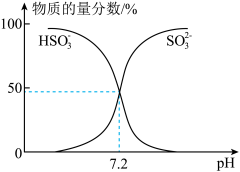
(3)常温下,在某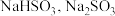 混合溶液中,部分含硫微粒的物质的量分数随
混合溶液中,部分含硫微粒的物质的量分数随 的变化曲线如图所示,根据图示,
的变化曲线如图所示,根据图示, 的水解平衡常数
的水解平衡常数
_______________ 。
(4)常温下,某浓度的 溶液中:
溶液中:
① 为
为_______________ (填“强”或“弱”)电解质。
②往 溶液中滴加少量的
溶液中滴加少量的 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为_______________ ,此时所得溶液的
_______________ (填“变大”、“变小”或“不变”)。
(5)在 的
的 溶液中加入等体积
溶液中加入等体积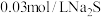 溶液,有黑色
溶液,有黑色 沉淀生成,反应后溶液中
沉淀生成,反应后溶液中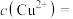
_______________ [已知: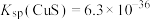 ](忽略溶液混合时体积的变化)。
](忽略溶液混合时体积的变化)。
(1)
 溶液显
溶液显(2)
 的
的 溶液中,各离子浓度由大到小的关系为
溶液中,各离子浓度由大到小的关系为(3)常温下,在某
 混合溶液中,部分含硫微粒的物质的量分数随
混合溶液中,部分含硫微粒的物质的量分数随 的变化曲线如图所示,根据图示,
的变化曲线如图所示,根据图示, 的水解平衡常数
的水解平衡常数

(4)常温下,某浓度的
 溶液中:
溶液中:①
 为
为②往
 溶液中滴加少量的
溶液中滴加少量的 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为
(5)在
 的
的 溶液中加入等体积
溶液中加入等体积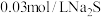 溶液,有黑色
溶液,有黑色 沉淀生成,反应后溶液中
沉淀生成,反应后溶液中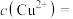
 ](忽略溶液混合时体积的变化)。
](忽略溶液混合时体积的变化)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下
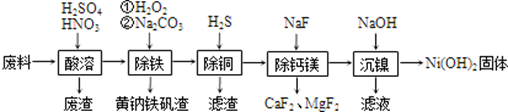
回答下列问题:
(1)“酸溶”时,溶液中有Fe3+、Fe2+、Ni2+等生成,废渣的主要成分是__________ ;金属镍溶解的离子方程式为__________________________________________ 。
(2)“除铁”时H2O2的作用是___________________ ,加入碳酸钠的目的是__________________________________________ 。
(3)“除铜”时,反应的离子方程式为_____________________________________ ,若用Na2S代替H2S除铜,优点是__________ 。
(4)已知除钙镁过程在陶瓷容器中进行,NaF的实际用量不能过多的理由为_____________________ 。
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程在“沉镍”过程中需调节溶液pH约为_______ ,Ni2+才刚好沉淀完全(离子沉淀完全的浓度≤10-5 mol/L;lg2=0.30)

回答下列问题:
(1)“酸溶”时,溶液中有Fe3+、Fe2+、Ni2+等生成,废渣的主要成分是
(2)“除铁”时H2O2的作用是
(3)“除铜”时,反应的离子方程式为
(4)已知除钙镁过程在陶瓷容器中进行,NaF的实际用量不能过多的理由为
(5)已知常温下Ksp[Ni(OH)2]=2.0×10-15,该流程在“沉镍”过程中需调节溶液pH约为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】根据要求,回答下列问题:
I.二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型水处理剂可用于城市自来水的处理。ClO2和Na2FeO4在水处理过程中分别被还原为 和Fe3+。
和Fe3+。
(1)如果以单位物质的量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Cl2、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是___________ 。
(2)工业上以CH3OH和NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体。已知该反应分两步进行,第一步反应为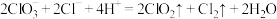 。
。
①第二步反应为___________ (写离子方程式)。
②上述反应中, 的作用是
的作用是___________ 。
II.金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比二价铬毒性高,更易被人体吸收且在体内蓄积。
(3)工业上处理含 的酸性废水的方法如下:
的酸性废水的方法如下:
①向含 的酸性废水中加入FeSO4溶液,使
的酸性废水中加入FeSO4溶液,使 全部转化为Cr3+,反应的离子方程式为
全部转化为Cr3+,反应的离子方程式为___________ 。
②调节溶液的pH,使Cr3+完全沉淀,请问溶液pH的最小理论值为___________ 。(已知常温下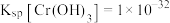 。离子浓度小于
。离子浓度小于 时可认为该离子沉淀完全)
时可认为该离子沉淀完全)
(4)铬元素总浓度的测定:准确移取25.00mL含 和
和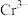 的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成
的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成 。煮沸除去过量的(NH4)2S2O8;上述溶液中加入过量的KI溶液,充分反应后,以淀粉溶液为指示剂,向其中滴加0.015
。煮沸除去过量的(NH4)2S2O8;上述溶液中加入过量的KI溶液,充分反应后,以淀粉溶液为指示剂,向其中滴加0.015 的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mol。
的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mol。
已知测定过程中发生的反应如下:
I.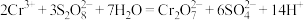
II.
III. ,则废水中铬元素的总浓度为
,则废水中铬元素的总浓度为___________  。
。
I.二氧化氯(ClO2)、高铁酸钠(Na2FeO4)等新型水处理剂可用于城市自来水的处理。ClO2和Na2FeO4在水处理过程中分别被还原为
 和Fe3+。
和Fe3+。(1)如果以单位物质的量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Cl2、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是
(2)工业上以CH3OH和NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体。已知该反应分两步进行,第一步反应为
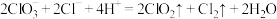 。
。①第二步反应为
②上述反应中,
 的作用是
的作用是II.金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比二价铬毒性高,更易被人体吸收且在体内蓄积。
(3)工业上处理含
 的酸性废水的方法如下:
的酸性废水的方法如下:①向含
 的酸性废水中加入FeSO4溶液,使
的酸性废水中加入FeSO4溶液,使 全部转化为Cr3+,反应的离子方程式为
全部转化为Cr3+,反应的离子方程式为②调节溶液的pH,使Cr3+完全沉淀,请问溶液pH的最小理论值为
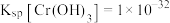 。离子浓度小于
。离子浓度小于 时可认为该离子沉淀完全)
时可认为该离子沉淀完全)(4)铬元素总浓度的测定:准确移取25.00mL含
 和
和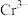 的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成
的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成 。煮沸除去过量的(NH4)2S2O8;上述溶液中加入过量的KI溶液,充分反应后,以淀粉溶液为指示剂,向其中滴加0.015
。煮沸除去过量的(NH4)2S2O8;上述溶液中加入过量的KI溶液,充分反应后,以淀粉溶液为指示剂,向其中滴加0.015 的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mol。
的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mol。已知测定过程中发生的反应如下:
I.
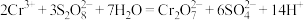
II.

III.
 ,则废水中铬元素的总浓度为
,则废水中铬元素的总浓度为 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】某厂利用富锗ZnO烟尘(还含有CuO、CaO、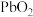 、
、 、
、 等)生产储精矿和碱式碳酸锌
等)生产储精矿和碱式碳酸锌 。其流程如下:
。其流程如下:
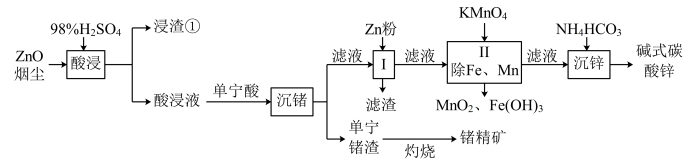
已知:I.酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
II.25℃: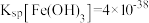 、
、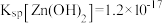 。
。
请回答下列问题:
(1)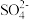 的空间结构
的空间结构_______ ;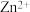 的价层电子排布式
的价层电子排布式_______
(2)浸渣①主要含有_______ ;酸浸中Pb元素发生变化的化学反应方程式_______
(3)采取下列哪些措施可以提高锗的浸出率_______ (填代号);
A.增大烟尘与硫酸的固液比 B.多次反复浸出 C.适当进行搅拌
(4)流程中,“I”加入Zn粉主要是为了置换_______ (填离子符号);
(5)流程中,“II”控制pH最高为_______ (溶液中金属离子浓度均按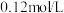 计算),该步骤pH不宜过低,除了考虑到锰的形态可能发生变化外,主要原因可能是
计算),该步骤pH不宜过低,除了考虑到锰的形态可能发生变化外,主要原因可能是_______ 。
(6)流程中,“II”除锰反应的离子方程式为_______ ;
(7)沉锌的化学方程式为_______ 。
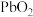 、
、 、
、 等)生产储精矿和碱式碳酸锌
等)生产储精矿和碱式碳酸锌 。其流程如下:
。其流程如下:
已知:I.酸浸时,锰与铅元素被还原为+2价,锗以Ge4+存在。
II.25℃:
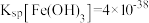 、
、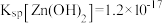 。
。请回答下列问题:
(1)
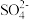 的空间结构
的空间结构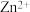 的价层电子排布式
的价层电子排布式(2)浸渣①主要含有
(3)采取下列哪些措施可以提高锗的浸出率
A.增大烟尘与硫酸的固液比 B.多次反复浸出 C.适当进行搅拌
(4)流程中,“I”加入Zn粉主要是为了置换
(5)流程中,“II”控制pH最高为
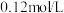 计算),该步骤pH不宜过低,除了考虑到锰的形态可能发生变化外,主要原因可能是
计算),该步骤pH不宜过低,除了考虑到锰的形态可能发生变化外,主要原因可能是(6)流程中,“II”除锰反应的离子方程式为
(7)沉锌的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
(1)金属钠可用于除去有机溶剂(如苯、醚等)中的水分,有关反应的化学方程式是____________________ 。
(2)“神舟号”载人航天器的返回舱内,为防止 浓度过大引起宇航员困乏,用过氧化钠降低
浓度过大引起宇航员困乏,用过氧化钠降低 的浓度,有关反应的化学方程式是
的浓度,有关反应的化学方程式是__________________________________ 。
(3)工业碳酸钠(纯度约为98%)中常含有 、
、 、
、 、
、 和
和 等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠(纯度约为99.95%),采取的工艺流程如下:
等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠(纯度约为99.95%),采取的工艺流程如下:

已知: 饱和碳酸钠溶液在不同温度下析出的溶质为:

①入NaOH的主要目的是_________________________________ 。
②“趁热过滤”时,温度应控制在_____________ ,原因是____________________________ 。
③为了检验试剂级 中是否含有
中是否含有 ,可进行的操作是:取少量待测固体溶于蒸馏水配成溶液取少量溶液于试管中,
,可进行的操作是:取少量待测固体溶于蒸馏水配成溶液取少量溶液于试管中,_________________________________ 。
(4) 可用于治疗胃酸过多,其反应原理是
可用于治疗胃酸过多,其反应原理是________________________________ (写离子方程式)。等物质的量的 与
与 相比,消耗胃酸的量的关系是
相比,消耗胃酸的量的关系是
_____  (填“>”、“<”或“=”),但不能用
(填“>”、“<”或“=”),但不能用 治疗胃酸过多的原因是
治疗胃酸过多的原因是_________________________________ 。
(1)金属钠可用于除去有机溶剂(如苯、醚等)中的水分,有关反应的化学方程式是
(2)“神舟号”载人航天器的返回舱内,为防止
 浓度过大引起宇航员困乏,用过氧化钠降低
浓度过大引起宇航员困乏,用过氧化钠降低 的浓度,有关反应的化学方程式是
的浓度,有关反应的化学方程式是(3)工业碳酸钠(纯度约为98%)中常含有
 、
、 、
、 、
、 和
和 等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠(纯度约为99.95%),采取的工艺流程如下:
等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠(纯度约为99.95%),采取的工艺流程如下:
已知: 饱和碳酸钠溶液在不同温度下析出的溶质为:

①入NaOH的主要目的是
②“趁热过滤”时,温度应控制在
③为了检验试剂级
 中是否含有
中是否含有 ,可进行的操作是:取少量待测固体溶于蒸馏水配成溶液取少量溶液于试管中,
,可进行的操作是:取少量待测固体溶于蒸馏水配成溶液取少量溶液于试管中,(4)
 可用于治疗胃酸过多,其反应原理是
可用于治疗胃酸过多,其反应原理是 与
与 相比,消耗胃酸的量的关系是
相比,消耗胃酸的量的关系是
 (填“>”、“<”或“=”),但不能用
(填“>”、“<”或“=”),但不能用 治疗胃酸过多的原因是
治疗胃酸过多的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
真题
【推荐3】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
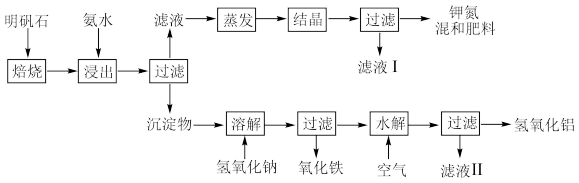
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)__________ mL,用规格为_______ mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是______________________________________________ 。
(3)写出沉淀物中所有物质的化学式________________________________________ 。
(4)滤液I的成分是水和______________ 。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量______ 溶液,产生白色沉淀。
②___________ 、__________ 、_________ (依次填写实验操作名称)。
③冷却、称重。
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:___________ mol(用含有m、n的代数式表示)。

根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是
(3)写出沉淀物中所有物质的化学式
(4)滤液I的成分是水和
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量
②
③冷却、称重。
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:
您最近一年使用:0次



