氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)==SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g) 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)==Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)==2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)==Si3N4(s)+12HCl(g)的△H=________________ kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________ 。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________ (填“温度”或“压强”)。


②其他条件一定,向2L密闭容器中加入 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________ mol·L-1·min-1;平衡常数:K(a) ________ K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。

阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____ CN-+ _____ ClO-+ ________ ==_____ CO32-+_____ N2↑+________ +________ 若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________ L。
(1)已知:Si(s)+2Cl2(g)==SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g)
 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-13Si(s)+2N2(g)==Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)==2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)==Si3N4(s)+12HCl(g)的△H=
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g)
 HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是


②其他条件一定,向2L密闭容器中加入 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。

阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:
更新时间:2019-01-05 10:30:41
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g)ΔH=+84kJ·mol-1
2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:__________ 。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:
请回答下列问题:
①该反应的ΔS__________ (填“>”或“<”)0。图中曲线a到曲线b的措施是__________ 。
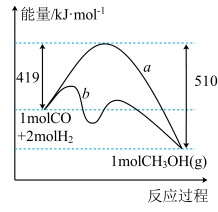
②已知CO中的C与O之间为三键,其键能为xkJ·mol-1,则x=__________ 。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________ 。
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为__________ 。
(1)已知:CH3OH(g)=HCHO(g)+H2(g)ΔH=+84kJ·mol-1
2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)
 CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:| 化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | x | 463 |
①该反应的ΔS

②已知CO中的C与O之间为三键,其键能为xkJ·mol-1,则x=
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为
②若以该电池为电源,用石墨作电极电解200mL含有如下离子的溶液。
| 离子 | Cu2+ | H+ | Cl− |  |
| c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为___________ 。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为________ kJ/mol。
II.对于反应CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=_____ ,6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为___________ 。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为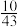 ,则反应的平衡常数K=
,则反应的平衡常数K=______ 。
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。
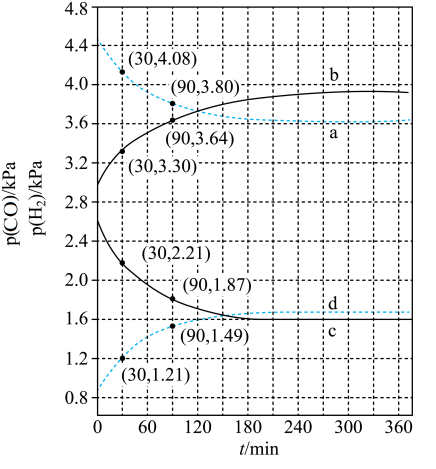
400K时p(H2)随时间变化关系的曲线是______ ,500K时p(CO)随时间变化关系的曲线是_______ 。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g) CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g) CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______ υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________ 。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为
II.对于反应CO(g)+H2O(g)⇌CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
| 时间/min | 0 | 2 | 5 | 6 | 9 | 10 |
| x(CO) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为
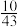 ,则反应的平衡常数K=
,则反应的平衡常数K=(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。

400K时p(H2)随时间变化关系的曲线是
III.在催化剂的作用下发生反应CO(g)+2H2(g)
 CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)
 CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
真题
【推荐3】乙苯催化脱氢制苯乙烯反应:

(1)已知:
计算上述反应的△H=________ kJ·mol-1。
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___________ 。
②控制反应温度为600℃的理由是____________ 。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸气工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________ (填编号)。
① CO2与H2反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用

(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ·molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实
②控制反应温度为600℃的理由是
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸气工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有
① CO2与H2反应,使乙苯脱氢反应的化学平衡右移
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】工业上,以高钛矿渣(主要成分为 )为原料生产纳米
)为原料生产纳米 的流程如图所示,其中反应ⅰ为
的流程如图所示,其中反应ⅰ为
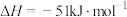 。
。

请回答下列问题:
(1)反应ⅰ在低温下能自发进行,但工业生产实际采用900℃的原因可能为___________ 。
(2)对于反应ⅰ,缩小容器容积, 的平衡转化率
的平衡转化率___________ (填“增大”“减小”或“不变”,下同),反应速率___________ 。
(3)T℃时,将足量的 、C和一定量的
、C和一定量的 加入某恒容密闭容器中发生反应ⅰ,测得容器内气体的总压强(
加入某恒容密闭容器中发生反应ⅰ,测得容器内气体的总压强( )和
)和 的转化率(
的转化率( )随时间的变化关系如图所示:
)随时间的变化关系如图所示:

在0~20 min内用 的分压变化表示的平均反应速率为
的分压变化表示的平均反应速率为___________ 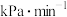 ;反应ⅰ的平衡常数
;反应ⅰ的平衡常数
___________ kPa( 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
(4)反应ⅱ的化学方程式为___________ 。
 )为原料生产纳米
)为原料生产纳米 的流程如图所示,其中反应ⅰ为
的流程如图所示,其中反应ⅰ为
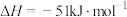 。
。
请回答下列问题:
(1)反应ⅰ在低温下能自发进行,但工业生产实际采用900℃的原因可能为
(2)对于反应ⅰ,缩小容器容积,
 的平衡转化率
的平衡转化率(3)T℃时,将足量的
 、C和一定量的
、C和一定量的 加入某恒容密闭容器中发生反应ⅰ,测得容器内气体的总压强(
加入某恒容密闭容器中发生反应ⅰ,测得容器内气体的总压强( )和
)和 的转化率(
的转化率( )随时间的变化关系如图所示:
)随时间的变化关系如图所示:
在0~20 min内用
 的分压变化表示的平均反应速率为
的分压变化表示的平均反应速率为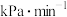 ;反应ⅰ的平衡常数
;反应ⅰ的平衡常数
 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。(4)反应ⅱ的化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】空燃比是影响发动机油耗和污染物排放量的重要因素。
资料:i.空燃比是通入空气与燃料质量的比值,按化学计量数反应时的空燃比称为理论空燃比。
ii.2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
(1)若不完全燃烧时发生反应2C8H18(l)+23O2(g)=12CO2(g)+4CO(g)+18H2O(g)。
①与完全燃烧相比,每2molC8H18不完全燃烧时少放出的能量为____ 。
②为减少油耗,实际使用过程中的空燃比____ (填“大于”或“小于”)理论空燃比。
(2)三元催化转化器可降低汽车尾气中CO、碳氢化合物和氮氧化物的含量。汽车尾气中污染物单位时间的转化率与空燃比的关系如图(氮氧化物主要是NO)。

已知:i.空燃比大于15后,空燃比越大,尾气的温度越低。
ii.CO和NO的反应为放热反应。
①三元催化转化器可将CO和NO转化为无害气体,反应的化学方程式为____ 。
②空燃比大于15时,尾气中氮氧化物单位时间的转化率接近于0,可能的原因是____ 。(写出2条)。
资料:i.空燃比是通入空气与燃料质量的比值,按化学计量数反应时的空燃比称为理论空燃比。
ii.2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
(1)若不完全燃烧时发生反应2C8H18(l)+23O2(g)=12CO2(g)+4CO(g)+18H2O(g)。
①与完全燃烧相比,每2molC8H18不完全燃烧时少放出的能量为
②为减少油耗,实际使用过程中的空燃比
(2)三元催化转化器可降低汽车尾气中CO、碳氢化合物和氮氧化物的含量。汽车尾气中污染物单位时间的转化率与空燃比的关系如图(氮氧化物主要是NO)。

已知:i.空燃比大于15后,空燃比越大,尾气的温度越低。
ii.CO和NO的反应为放热反应。
①三元催化转化器可将CO和NO转化为无害气体,反应的化学方程式为
②空燃比大于15时,尾气中氮氧化物单位时间的转化率接近于0,可能的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
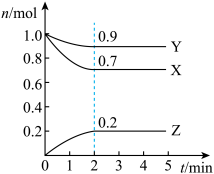
(1)由图中所给数据进行分析,该反应的化学方程式为__________ 。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
0~50s内的平均反应速率 v(N2) = __________ ,250s时,H2的转化率为____________ 。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中___ (填“吸收”或“放出”)的能量为____ , 反应达到(2)中的平衡状态时,对应的能量变化的数值为____ kJ。
(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时____ (填增大、减小或不变),混合气体密度比起始时______ (填增大、减小或不变)。
(5)为加快反应速率,可以采取的措施是_______
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3

(1)由图中所给数据进行分析,该反应的化学方程式为
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。
 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中(4)反应达平衡时容器内混合气体的平均相对分子质量比起始时
(5)为加快反应速率,可以采取的措施是
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】I.氢能源是绿色燃料,可以减少环境污染,利用甲醇与水蒸气反应可以制备氢气。
(1)已知下列热化学方程式:
①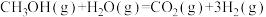

②

③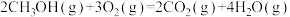

 、
、 、
、 三者的关系式为
三者的关系式为___________
(2)在一定温度下,向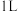 密闭恒容容器中充入
密闭恒容容器中充入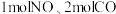 ,发生反应
,发生反应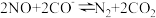 ,10s时反应达平衡,此时
,10s时反应达平衡,此时 的物质的量为1.2mol。则前10s内平均反应速率
的物质的量为1.2mol。则前10s内平均反应速率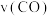 为
为___________ 。
II.甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇: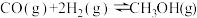
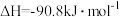
在一容积可变的密闭容器中充人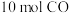 和
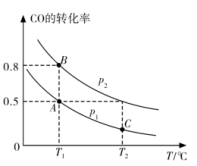
和 的平衡转化率随温度(T)、压强(p)的变化如图所示。
的平衡转化率随温度(T)、压强(p)的变化如图所示。
(3)该反应的化学平衡常数表达式K=___________ 。
(4)图中A、B两点的正反应速率: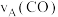
___________  ,A、C两点的平衡常数:
,A、C两点的平衡常数: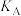
___________ 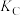 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(5)关于反应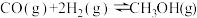 ,下列不能作为反应达到化学平衡的标志是
,下列不能作为反应达到化学平衡的标志是___________ (填字母)。
A. 的含量保持不变
的含量保持不变
B.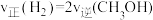
C.容器中 的浓度与
的浓度与 的浓度一定相等
的浓度一定相等
D.容器中混合气体的密度保持不变
(1)已知下列热化学方程式:
①
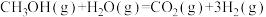

②


③
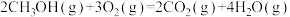

 、
、 、
、 三者的关系式为
三者的关系式为(2)在一定温度下,向
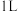 密闭恒容容器中充入
密闭恒容容器中充入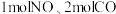 ,发生反应
,发生反应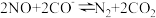 ,10s时反应达平衡,此时
,10s时反应达平衡,此时 的物质的量为1.2mol。则前10s内平均反应速率
的物质的量为1.2mol。则前10s内平均反应速率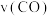 为
为II.甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:
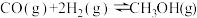
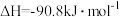
在一容积可变的密闭容器中充人
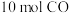 和
和 的平衡转化率随温度(T)、压强(p)的变化如图所示。
的平衡转化率随温度(T)、压强(p)的变化如图所示。
(3)该反应的化学平衡常数表达式K=
(4)图中A、B两点的正反应速率:
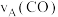
 ,A、C两点的平衡常数:
,A、C两点的平衡常数: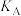
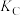 (填“>”“<”或“=”)
(填“>”“<”或“=”)(5)关于反应
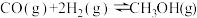 ,下列不能作为反应达到化学平衡的标志是
,下列不能作为反应达到化学平衡的标志是A.
 的含量保持不变
的含量保持不变B.
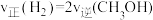
C.容器中
 的浓度与
的浓度与 的浓度一定相等
的浓度一定相等D.容器中混合气体的密度保持不变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】甲醇是重要的化工原料,发展前景广阔。
(1)研究表明CO2加氢可以合成甲醇。CO2和H2可发生如下两个反应:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
II.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
(1)在一定体积的密闭容器中进行化学反应I:CO2(g)+H2(g)=CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
回答下列问题:
①该反应为___________ (填“吸热”或“放热”)反应。
②某温度下,平衡浓度符合下式c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度___________ ℃。
③在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为 、
、 、
、 、
、 ,则下一时刻,反应向
,则下一时刻,反应向___________ (填“正向”或“逆向”)进行。
(2)①反应II的化学平衡常数表达式为___________
②有利于提高反应II中CO2的平衡转化率的措施有___________ (填序号)。
a.使用催化剂 b.加压 c.增大H2和CO2的初始投料比
③反应I的化学平衡常数表达式K=___________ 。
④有利于提高反应I中CO2的平衡转化率的措施有___________ (填序号)。
a.使用催化剂 b.加压 c.增大CO2和H2的初始投料比
⑤研究温度对于甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂甲,主要发生反应I,得到甲醇的实际产率、平衡产率与温度的关系如图所示。
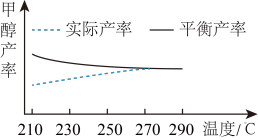
ΔH1___________ 0(填“>”、“=”或“<”),其依据是___________ 。
⑥某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态):
【注】甲醇选择性:转化的CO2中生成甲醇的百分比
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是___________ 。
(1)研究表明CO2加氢可以合成甲醇。CO2和H2可发生如下两个反应:
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1II.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2(1)在一定体积的密闭容器中进行化学反应I:CO2(g)+H2(g)=CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应为
②某温度下,平衡浓度符合下式c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度
③在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为
 、
、 、
、 、
、 ,则下一时刻,反应向
,则下一时刻,反应向(2)①反应II的化学平衡常数表达式为
②有利于提高反应II中CO2的平衡转化率的措施有
a.使用催化剂 b.加压 c.增大H2和CO2的初始投料比
③反应I的化学平衡常数表达式K=
④有利于提高反应I中CO2的平衡转化率的措施有
a.使用催化剂 b.加压 c.增大CO2和H2的初始投料比
⑤研究温度对于甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂甲,主要发生反应I,得到甲醇的实际产率、平衡产率与温度的关系如图所示。

ΔH1
⑥某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态):
| T(K) | CO2实际转化率(%) | 甲醇选择性(%)【注】 |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】已知:NO2结构为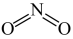 ,N2O4结构为
,N2O4结构为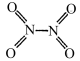 N-N键能为167kJ/mol ,NO2中氮氧双键键能为466kJ/mol;N2O4中氮氧双键键能为438. 5kJ/mol。
N-N键能为167kJ/mol ,NO2中氮氧双键键能为466kJ/mol;N2O4中氮氧双键键能为438. 5kJ/mol。
(1)写出NO2转化成N2O4(g)的热化学方程式:___________ ;
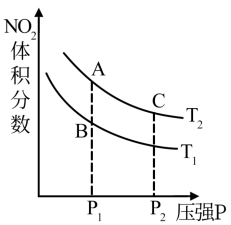
(2)对于反应:2NO2(g) N2O4(g),在温度T1,T2时,平衡体系中NO2体积分数随压强变化曲线如图,下列说法正确的是___________。
N2O4(g),在温度T1,T2时,平衡体系中NO2体积分数随压强变化曲线如图,下列说法正确的是___________。
(3)在100 °C时,。将0.4mol NO2充入体积为2L密闭抽真空容器中,每隔一定时间测定容器内各物质的量,得数据如下:
(i)20s时平均速率v(NO2) = ___________ ;
(ii)该反应在此条件下平衡常数K=___________ ;
(iii)100°C时,某时刻c(NO2) = 1.0mo/L,c(N2O4) = 0. 2mol/L。则该时刻v正___________ v逆 (填”>”、“=”或“<”)
(iv)若最初充入N2O4(g),要达到相同状态。,则N2O4起始浓度为___________ 。
(v)计算(iv)达到平衡时,平衡混合气体平均相对分子质量:___________ 。
 ,N2O4结构为
,N2O4结构为 N-N键能为167kJ/mol ,NO2中氮氧双键键能为466kJ/mol;N2O4中氮氧双键键能为438. 5kJ/mol。
N-N键能为167kJ/mol ,NO2中氮氧双键键能为466kJ/mol;N2O4中氮氧双键键能为438. 5kJ/mol。(1)写出NO2转化成N2O4(g)的热化学方程式:
(2)对于反应:2NO2(g)
 N2O4(g),在温度T1,T2时,平衡体系中NO2体积分数随压强变化曲线如图,下列说法正确的是___________。
N2O4(g),在温度T1,T2时,平衡体系中NO2体积分数随压强变化曲线如图,下列说法正确的是___________。
| A.A、C两点反应速率:vA>vc |
| B.B、C两点平均相对分子质量MB< MC |
| C.A、C两点气体颜色:A深,C浅 |
| D.由状态B到状态A,可用加热方法 |
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n( NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4 )/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(ii)该反应在此条件下平衡常数K=
(iii)100°C时,某时刻c(NO2) = 1.0mo/L,c(N2O4) = 0. 2mol/L。则该时刻v正
(iv)若最初充入N2O4(g),要达到相同状态。,则N2O4起始浓度为
(v)计算(iv)达到平衡时,平衡混合气体平均相对分子质量:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量), 当闭合该装置的电键 K 时,观察到电流计的指针发生了偏转。请回答下列问题:
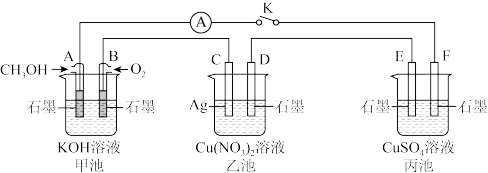
(1)乙池为_____ (填“原电池”.“电解池”或“电镀池”) C 电极的电极反应式为________ 。
(2)丙池中 E 电极为____ (填“正极”.“负极”.“阴极”或“阳极”),电极的电极反应式为__________ 。该池总反应的化学方程式为________________ 。
(3)当乙池中C极质量减轻 54 g 时,甲池中电极理论上消耗 O2的为____ L(标准状况)。
(4)一段时间后,断开电键 K,下列物质能使丙池恢复到反应前浓度的是____ (填选项字母)。
A.Cu B.CuO C.Cu(OH)2 D.CuCO3

(1)乙池为
(2)丙池中 E 电极为
(3)当乙池中C极质量减轻 54 g 时,甲池中电极理论上消耗 O2的为
(4)一段时间后,断开电键 K,下列物质能使丙池恢复到反应前浓度的是
A.Cu B.CuO C.Cu(OH)2 D.CuCO3
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题。
(1)某温度下, 的盐酸中水电离出的
的盐酸中水电离出的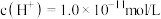 ,该温度下将
,该温度下将 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
_______ 。
(2)常温下将pH均为3,体积均为 的
的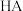 和
和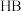 溶液,分别加水稀释至体积V,pH随
溶液,分别加水稀释至体积V,pH随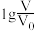 的变化如图所示。
的变化如图所示。
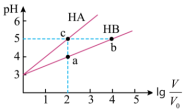
①a、b、c三点水的电离程度由大到小的顺序_______
②常温下,取上述pH均为3的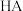 和
和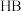 溶液各
溶液各 ,向其中分别加入足量的Zn粒,反应结束时
,向其中分别加入足量的Zn粒,反应结束时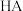 中产生氢气的物质的量为
中产生氢气的物质的量为 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为 ,则
,则
_______ 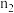 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
(3)以 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______ 。
a.利用阳极泥可回收Ag、Pt、Au等金属 b.粗铜接电源正极,发生氧化反应
c.溶液中 向阳极移动 d.电能全部转化为化学能
向阳极移动 d.电能全部转化为化学能
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素 ,原理如图。
,原理如图。
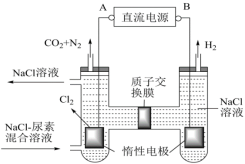
①电源的正极为_______ (填“A”或“B”)。
②电解结束后,阴极室溶液的pH与电解前相比将_______ (填“增大”、“减小”、“不变”);若两极共收集到气体 (标准状况),则除去的尿素为
(标准状况),则除去的尿素为_______ g(忽略气体的溶解)。
(1)某温度下,
 的盐酸中水电离出的
的盐酸中水电离出的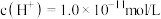 ,该温度下将
,该温度下将 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
(2)常温下将pH均为3,体积均为
 的
的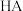 和
和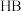 溶液,分别加水稀释至体积V,pH随
溶液,分别加水稀释至体积V,pH随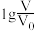 的变化如图所示。
的变化如图所示。
①a、b、c三点水的电离程度由大到小的顺序
②常温下,取上述pH均为3的
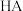 和
和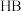 溶液各
溶液各 ,向其中分别加入足量的Zn粒,反应结束时
,向其中分别加入足量的Zn粒,反应结束时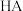 中产生氢气的物质的量为
中产生氢气的物质的量为 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为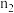 ,则
,则
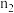 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。(3)以
 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是a.利用阳极泥可回收Ag、Pt、Au等金属 b.粗铜接电源正极,发生氧化反应
c.溶液中
 向阳极移动 d.电能全部转化为化学能
向阳极移动 d.电能全部转化为化学能(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素
 ,原理如图。
,原理如图。
①电源的正极为
②电解结束后,阴极室溶液的pH与电解前相比将
 (标准状况),则除去的尿素为
(标准状况),则除去的尿素为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】硒是典型的半导体材料,在光照射下导电性可提高近千倍。如图是从某工厂的硒化银半导体废料(含Ag2Se、Cu单质)中提取硒、银的工艺流程图:
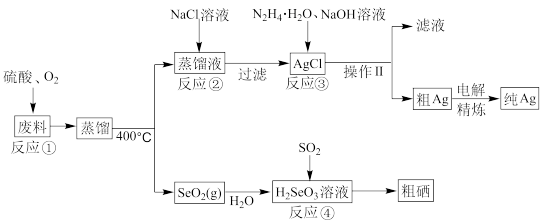
回答下列问题:
(1)为提高反应①的浸出速率,可采用的措施为____ (答出两条)。
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子方程式___ 。
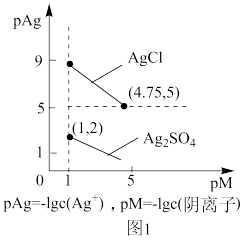
(3)反应②为Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO (aq);常温下的Ag2SO4、AgCl饱和溶液中阳离子和阴离子浓度关系如图l所示。则Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO
(aq);常温下的Ag2SO4、AgCl饱和溶液中阳离子和阴离子浓度关系如图l所示。则Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO (aq)的化学平衡常数为
(aq)的化学平衡常数为____ 。
(4)写出反应④的化学方程式____ 。
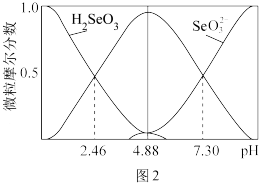
(5)室温下,H2SeO3水溶液中H2SeO3、HSeO 、SeO
、SeO 的摩尔分数随pH的变化如图2所示,则室温下H2SeO3的Ka2=
的摩尔分数随pH的变化如图2所示,则室温下H2SeO3的Ka2=____ 。
(6)工业上粗银电解精炼时,电解液的pH为1.5~2,电流强度为5~10A,若电解液pH太小,电解精炼过程中在阴极除了银离子放电,还会发生____ (写电极反应式),若用10A的电流电解60min后,得到32.4gAg,则该电解池的电解效率为____ %,(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C·mol-1)。

回答下列问题:
(1)为提高反应①的浸出速率,可采用的措施为
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子方程式
(3)反应②为Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO
 (aq);常温下的Ag2SO4、AgCl饱和溶液中阳离子和阴离子浓度关系如图l所示。则Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO
(aq);常温下的Ag2SO4、AgCl饱和溶液中阳离子和阴离子浓度关系如图l所示。则Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO (aq)的化学平衡常数为
(aq)的化学平衡常数为
(4)写出反应④的化学方程式
(5)室温下,H2SeO3水溶液中H2SeO3、HSeO
 、SeO
、SeO 的摩尔分数随pH的变化如图2所示,则室温下H2SeO3的Ka2=
的摩尔分数随pH的变化如图2所示,则室温下H2SeO3的Ka2=
(6)工业上粗银电解精炼时,电解液的pH为1.5~2,电流强度为5~10A,若电解液pH太小,电解精炼过程中在阴极除了银离子放电,还会发生
您最近一年使用:0次



