(1)赤水晒醋是我们遵义特产之一,其中含有一定量的CH3COOH。写出CH3COOH的电离方程式 ______ ;在已达平衡的乙酸溶液中加入一定的CH3COONa ,该溶液pH_______ (填“增大”“减小”或“不变”)。
(2)燃料电池汽车,尤其是氢燃料电池汽车可以实现零污染、零排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,因此燃料电池汽车成为汽车企业关注的焦点。燃料电池的燃料可以是氢气、甲醇等。有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①该电池的正极反应是___________ ;负极反应是____________ 。
②在稀土氧化物的固体电解质中,O2-的移动方向是__________ 。
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车,主要原因是___________ 。
(3)在AgCl的饱和溶液中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100 mL蒸馏水中;②100 mL 0.2 mol/L AgNO3溶液中;③100 mL 0.1 mol/L氯化铝溶液中;④100 mL 0.1 mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是_____ (填写序号);其中②中氯离子的浓度为______ mol/L。
(2)燃料电池汽车,尤其是氢燃料电池汽车可以实现零污染、零排放,驱动系统几乎无噪音,且氢能取之不尽、用之不竭,因此燃料电池汽车成为汽车企业关注的焦点。燃料电池的燃料可以是氢气、甲醇等。有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①该电池的正极反应是
②在稀土氧化物的固体电解质中,O2-的移动方向是
③甲醇可以在内燃机中燃烧直接产生动力推动机动车运行,而科技工作者要花费大量的精力研究甲醇燃料汽车,主要原因是
(3)在AgCl的饱和溶液中存在沉淀溶解平衡:AgCl(s)
 Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:①100 mL蒸馏水中;②100 mL 0.2 mol/L AgNO3溶液中;③100 mL 0.1 mol/L氯化铝溶液中;④100 mL 0.1 mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是
更新时间:2019-06-01 17:11:25
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】资源的合理利用,有利于社会的可持续发展。MnO2的回收的工艺流程有如下几种方式:
第一种:以锌锰废电池中碳包(含碳粉、Fe、Cu、Ag和MnO2等物质)为原料:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV.向III所得溶液(pH约为6)中缓慢滴加0.50 mol·L-1Na2CO3溶液(pH约为12),过滤,得滤渣b,其主要成分为MnCO3;
V.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι:Ag与足量稀HNO3反应生成NO的化学方程式为_______ 。
(2)II:灼烧的目的是为了除去_______ 。
(3)III:MnO2溶解的离子方程式为_______ 。溶解一定量的MnO2时,H2O2的实际消耗量比理论值高,用化学方程式解释原因:_______ 。
(4)IV:若实验条件改为“向0.50 mol·L-1Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中可能会混有较多的_______ 杂质(填化学式)。
(5)V:MnCO3在空气中灼烧的化学方程式为_______ 。
第二种:以低品位软锰矿(MnO2,含少量SiO2、Fe2O3、Al2O3等)为原料制备MnO2,其工艺流程如图:
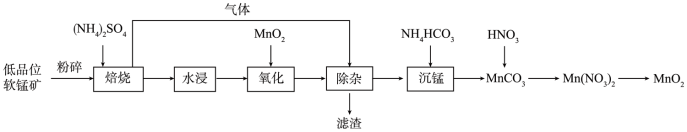
(6)“焙烧”过程中铁、锰浸出率的影响如图所示:
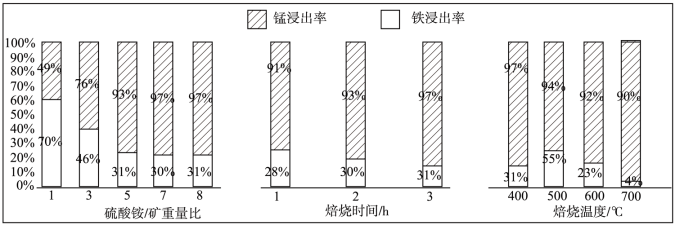
焙烧较适宜的硫酸铵/矿重量比是_______ ,焙烧时间是_______ ,焙烧温度是_______ 。
(7)焙烧产生的气体可调节溶液的pH使某些金属离子沉淀,气体的主要成分是_______ 。
(8)滤渣的成分除了Fe(OH)3,还有_______ (写化学式)。
第一种:以锌锰废电池中碳包(含碳粉、Fe、Cu、Ag和MnO2等物质)为原料:
I.将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II.将滤渣a在空气中灼烧,得到粗MnO2;
III.向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV.向III所得溶液(pH约为6)中缓慢滴加0.50 mol·L-1Na2CO3溶液(pH约为12),过滤,得滤渣b,其主要成分为MnCO3;
V.滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι:Ag与足量稀HNO3反应生成NO的化学方程式为
(2)II:灼烧的目的是为了除去
(3)III:MnO2溶解的离子方程式为
(4)IV:若实验条件改为“向0.50 mol·L-1Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中可能会混有较多的
(5)V:MnCO3在空气中灼烧的化学方程式为
第二种:以低品位软锰矿(MnO2,含少量SiO2、Fe2O3、Al2O3等)为原料制备MnO2,其工艺流程如图:

(6)“焙烧”过程中铁、锰浸出率的影响如图所示:

焙烧较适宜的硫酸铵/矿重量比是
(7)焙烧产生的气体可调节溶液的pH使某些金属离子沉淀,气体的主要成分是
(8)滤渣的成分除了Fe(OH)3,还有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______ V2(填“>”、“=”或“<”) ;
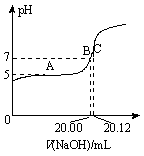
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________ ,CH3COOH溶液的实际浓度为____________ ;
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________ ;
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________ ;
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________ ;
(4)若降低温度,K值减小,则反应的ΔH______ 0(填“>”或“<”) ;
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________ (填“增大”、“减小”或“不变”)。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=

Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g)
 Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。(1)下列能判断反应达到平衡状态的是
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为
(4)若降低温度,K值减小,则反应的ΔH
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】常温下,10 mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示,请回答下列问题:

(1)10 mL pH=2的盐酸加水稀释到1000 mL,pH=________ 。
(2)物质的量浓度均为0.1 mol·L−1的NaX和NaY溶液,pH较大的是________ (填化学式,下同),其中水的电离程度较小的是________ 。
(3)等体积,pH均为2的三种酸:①HX、②HY、③HCl分别被同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小 分别为(填编号)__________ 。
(4)H2Z是一种二元弱酸,常温下,0.1 mol·L−1的H2Z溶液中加入等体积pH=13的KOH溶液后,溶液的pH>7,原因可能是________________________________________________ 。

(1)10 mL pH=2的盐酸加水稀释到1000 mL,pH=
(2)物质的量浓度均为0.1 mol·L−1的NaX和NaY溶液,pH较大的是
(3)等体积,pH均为2的三种酸:①HX、②HY、③HCl分别被同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积
(4)H2Z是一种二元弱酸,常温下,0.1 mol·L−1的H2Z溶液中加入等体积pH=13的KOH溶液后,溶液的pH>7,原因可能是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】家庭厨房实际上就是一个化学世界,“柴米油盐酱醋糖”等均是化学物质。学好化学知识,享受健康生活。回答下列问题:
(1)厨房中使用的纯碱( ),可用于洗涤油污等,洗涤原理为
),可用于洗涤油污等,洗涤原理为_______ (用离子方程式表示)。
(2)食醋的主要成分为CH3COOH,常温下,取pH=3的食醋稀释100倍,pH的取值范围为_______ 。
(3)酱油是一种厨房常用调味剂,根据国家《食品添加剂使用标准》要求,酱油中NaCl的含量不应低于15g/100mL。莫尔法是较简单的一种测量 含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):
含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):
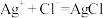 (白色沉淀)
(白色沉淀) 
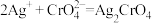 (砖红色沉淀)
(砖红色沉淀) 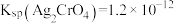
准确移取酱油样品5.00mL稀释至100.00mL,从其中取出10.00mL置于锥形瓶中,再向其中加入适量的 溶液(指示剂),以0.1000mol/L的硝酸银标准溶液滴定,重复实验三次。
溶液(指示剂),以0.1000mol/L的硝酸银标准溶液滴定,重复实验三次。
①滴定终点的判断依据为_______ 。
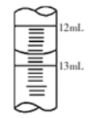
②滴定结束时,滴定管中液面如图所示,则读数为_______ 。
③滴定过程中,下列操作会导致结果偏大的是_______ 。
A.滴定过程中,锥形瓶内有部分液体溅出
B.滴定过程中,部分标准液滴到锥形瓶外
C.滴定前读数时平视,滴定后读数时俯视
D.滴定前读数时尖嘴处有气泡,滴定后读数时尖嘴处无气泡
④若三次消耗硝酸银标准溶液的平均体积为12.50mL,则稀释后的酱油中NaCl的浓度为_______ mol/L,该市售酱油是否符合NaCl含量标准_______ (填“符合”或“不符合”)。
(1)厨房中使用的纯碱(
 ),可用于洗涤油污等,洗涤原理为
),可用于洗涤油污等,洗涤原理为(2)食醋的主要成分为CH3COOH,常温下,取pH=3的食醋稀释100倍,pH的取值范围为
(3)酱油是一种厨房常用调味剂,根据国家《食品添加剂使用标准》要求,酱油中NaCl的含量不应低于15g/100mL。莫尔法是较简单的一种测量
 含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):
含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):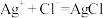 (白色沉淀)
(白色沉淀) 
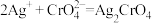 (砖红色沉淀)
(砖红色沉淀) 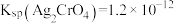
准确移取酱油样品5.00mL稀释至100.00mL,从其中取出10.00mL置于锥形瓶中,再向其中加入适量的
 溶液(指示剂),以0.1000mol/L的硝酸银标准溶液滴定,重复实验三次。
溶液(指示剂),以0.1000mol/L的硝酸银标准溶液滴定,重复实验三次。
①滴定终点的判断依据为
②滴定结束时,滴定管中液面如图所示,则读数为
③滴定过程中,下列操作会导致结果偏大的是
A.滴定过程中,锥形瓶内有部分液体溅出
B.滴定过程中,部分标准液滴到锥形瓶外
C.滴定前读数时平视,滴定后读数时俯视
D.滴定前读数时尖嘴处有气泡,滴定后读数时尖嘴处无气泡
④若三次消耗硝酸银标准溶液的平均体积为12.50mL,则稀释后的酱油中NaCl的浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】光合作用是自然界最重要的过程之一,其总反应一般表示为6CO2 + 6H2O→C6H12O6 + 6O2,实际反应分多步进行,其中,水的氧化过程是一个重要环节,此过程在光系统II(简称PSII)中发生,使水氧化的活性中心是含有4个锰原子的配位簇(称为锰氧族)。初始状态的锰氧簇(S0) 在光照下依次失去电子变为S1、S2、S3 和S4, S4氧化H2O生成O2.该过程简示如下:
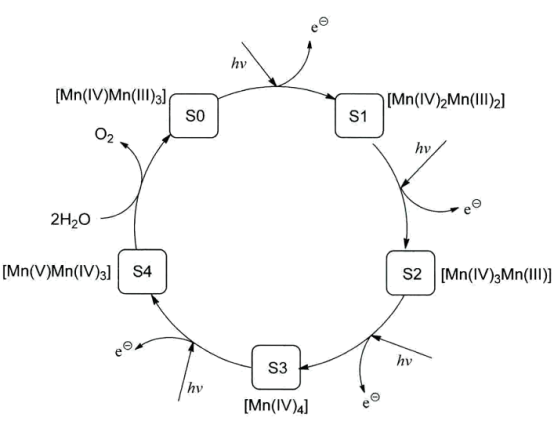
(1)光合作用中,水的氧化是几个电子转移的过程___________ ?
(2) 25°C, 标态下,下列电极反应的电极电势分别为:
a) MnO +4H++e-
+4H++e- MnO2+ 2H2O E
MnO2+ 2H2O E =2.90V
=2.90V
b) MnO2+4H++e- Mn3+ + 2H2O E
Mn3+ + 2H2O E =0.95V
=0.95V
c) O2+4H+ +4e- 2H2O E
2H2O E = 1.23V
= 1.23V
计算上述反应在中性条件下的电极电势___________ 。假定MnO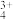 和Mn3+的浓度均为0.10 mol·L-1,氧分压等于其在空气中的分压。回答此条件下MnO
和Mn3+的浓度均为0.10 mol·L-1,氧分压等于其在空气中的分压。回答此条件下MnO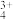 和MnO2能否氧化水
和MnO2能否氧化水___________ 。
(3)在模拟锰氧簇的人工光合作用研究中,研究者注意到如下Mn(III)/Mn(II)体系(25°C);
d) Mn3++e- Mn2+ E
Mn2+ E = 1.51V
= 1.51V
e)在[H2P2O ]=0.40 mol· L-1, [Mn(H2P2O7)
]=0.40 mol· L-1, [Mn(H2P2O7)  ]=[Mn(H2P2O7)
]=[Mn(H2P2O7)  ]的溶液中:Mn(H2P2O7)
]的溶液中:Mn(H2P2O7)  +2H+ +e-
+2H+ +e-  Mn(H2P2O7)
Mn(H2P2O7)  + H4P2O7 E=1.15V
+ H4P2O7 E=1.15V
①计算e)中的半反应的标准电极电势___________ 。
(H4P2O7的酸解离常数: Ka1=1.2 × 10-1,Ka2=7.9 × 10-3, Ka3=2.0×10-7, Ka4=4.5 ×10-10)
②计算Mn(H2P2O7) 和Mn(H2P2O7)
和Mn(H2P2O7)  的稳定常数之比
的稳定常数之比___________ 。

(1)光合作用中,水的氧化是几个电子转移的过程
(2) 25°C, 标态下,下列电极反应的电极电势分别为:
a) MnO
 +4H++e-
+4H++e- MnO2+ 2H2O E
MnO2+ 2H2O E =2.90V
=2.90Vb) MnO2+4H++e-
 Mn3+ + 2H2O E
Mn3+ + 2H2O E =0.95V
=0.95Vc) O2+4H+ +4e-
 2H2O E
2H2O E = 1.23V
= 1.23V计算上述反应在中性条件下的电极电势
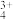 和Mn3+的浓度均为0.10 mol·L-1,氧分压等于其在空气中的分压。回答此条件下MnO
和Mn3+的浓度均为0.10 mol·L-1,氧分压等于其在空气中的分压。回答此条件下MnO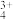 和MnO2能否氧化水
和MnO2能否氧化水(3)在模拟锰氧簇的人工光合作用研究中,研究者注意到如下Mn(III)/Mn(II)体系(25°C);
d) Mn3++e-
 Mn2+ E
Mn2+ E = 1.51V
= 1.51Ve)在[H2P2O
 ]=0.40 mol· L-1, [Mn(H2P2O7)
]=0.40 mol· L-1, [Mn(H2P2O7)  ]=[Mn(H2P2O7)
]=[Mn(H2P2O7)  ]的溶液中:Mn(H2P2O7)
]的溶液中:Mn(H2P2O7)  +2H+ +e-
+2H+ +e-  Mn(H2P2O7)
Mn(H2P2O7)  + H4P2O7 E=1.15V
+ H4P2O7 E=1.15V①计算e)中的半反应的标准电极电势
(H4P2O7的酸解离常数: Ka1=1.2 × 10-1,Ka2=7.9 × 10-3, Ka3=2.0×10-7, Ka4=4.5 ×10-10)
②计算Mn(H2P2O7)
 和Mn(H2P2O7)
和Mn(H2P2O7)  的稳定常数之比
的稳定常数之比
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)物质的量浓度相等的CH3COONa溶液和NaClO溶液pH大小关系为:c(CH3COONa)_____ c(NaClO)(填“>”、“<”或“=”)。
(2)H2CO3的电离方程式为:_____ 。
(3)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式为:_____ 。
(4)泡沫灭火器内筒装有Al2(SO4)3溶液,外筒装有NaHCO3溶液。
① Al2(SO4)3溶液呈酸性的原因是:_____ 。(用离子方程式说明)
② 内、外筒溶液混合后发生反应离子方程式为:_____ 。
(5)常温下0.1 mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变大的是______ 。
A.c(H+) B.c(H+)·c(OH-)
C.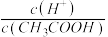 D.
D.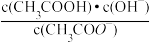
(6)H+浓度相等、体积相等的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应后,仅有一份溶液中剩余锌,放出氢气的质量相同,则下列说法正确的是__ (填写序号)。
①开始反应时的速率A>B ②放出等量氢气所需要的时间B>A
③参加反应的锌的物质的量A=B ④A中有锌剩余
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)物质的量浓度相等的CH3COONa溶液和NaClO溶液pH大小关系为:c(CH3COONa)
(2)H2CO3的电离方程式为:
(3)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式为:
(4)泡沫灭火器内筒装有Al2(SO4)3溶液,外筒装有NaHCO3溶液。
① Al2(SO4)3溶液呈酸性的原因是:
② 内、外筒溶液混合后发生反应离子方程式为:
(5)常温下0.1 mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变大的是
A.c(H+) B.c(H+)·c(OH-)
C.
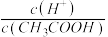 D.
D.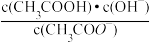
(6)H+浓度相等、体积相等的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应后,仅有一份溶液中剩余锌,放出氢气的质量相同,则下列说法正确的是
①开始反应时的速率A>B ②放出等量氢气所需要的时间B>A
③参加反应的锌的物质的量A=B ④A中有锌剩余
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】已知K、Ka、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是_____________ .
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中KW=Ka·Kh
(2)25℃时,将a mol·L−1的氨水与0.01mol·L−1的盐酸等体积混合所得溶液中c(NH4 +)=c(Cl−),则溶液显____________ (填“酸”、“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=_______________ .
(3)25℃时,H2SO3⇌HSO3−+H+的电离常数Ka=1×10−2mol·L−1,则该温度下pH=3、c(HSO3−)=0.1mol·L−1的NaHSO3溶液中c(H2SO3)=_____________________ ,
已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10−38、1.0×10−11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__________________ .(已知lg 2=0.3)
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中KW=Ka·Kh
(2)25℃时,将a mol·L−1的氨水与0.01mol·L−1的盐酸等体积混合所得溶液中c(NH4 +)=c(Cl−),则溶液显
(3)25℃时,H2SO3⇌HSO3−+H+的电离常数Ka=1×10−2mol·L−1,则该温度下pH=3、c(HSO3−)=0.1mol·L−1的NaHSO3溶液中c(H2SO3)=
已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10−38、1.0×10−11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次
【推荐2】ZnSO4∙7H2O可用于测定钢铁及炉渣的含硫量。某工厂下脚料中含锌、镉(Cd)、铜、铁等金属,以该下脚料为原料制备ZnSO4∙7H2O并回收Cu、Cd的工艺流程如图所示:
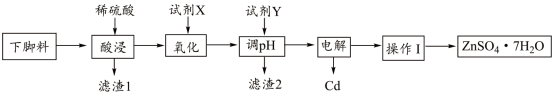
已知部分氢氧化物开始及完全沉淀的pH如表所示(起始时金属离子浓度按0.1mol∙L-1计算):
请回答下列问题:
(1)滤渣1中含有_______ (填化学式)。
(2)试剂X是双氧水时,写出氧化过程中发生反应的离子方程式_______ 。
(3)试剂Y可选用_______ (填字母)
a.NaOHb.ZnOc.ZnCO3
(4)电解时以汞(Hg)作电极可以将镉与锌完全分离,镉单质在_______ (填“阴”或“阳”)极析出,阳极的电极反应式为_______ 。
(5)操作I包括的操作是_______ 及过滤等,过滤后得到的滤液可以加入_______ (填“酸浸”或“氧化”)步骤循环利用。

已知部分氢氧化物开始及完全沉淀的pH如表所示(起始时金属离子浓度按0.1mol∙L-1计算):
| 氢氧化物 | Fe(OH)3 | Cd(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.9 | 7.4 | 6.2 |
| 完全沉淀的pH | 3.2 | 9.5 | 8.2 |
请回答下列问题:
(1)滤渣1中含有
(2)试剂X是双氧水时,写出氧化过程中发生反应的离子方程式
(3)试剂Y可选用
a.NaOHb.ZnOc.ZnCO3
(4)电解时以汞(Hg)作电极可以将镉与锌完全分离,镉单质在
(5)操作I包括的操作是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】难溶电解质的沉淀溶解平衡及其溶度积常数在生产、科研等领域有着诸的应用。25℃时,各物质的溶度积如下表所示:
(1)现将足量AgCl(s)分别加入下列四种溶液:①100mL蒸馏水;②100mL0.1mol·L-1盐酸;③100mL0.1mol·L-1AlCl3溶液,④100mL0.1mol·L-1MgCl2溶液。充分搅拌后,相同温度下,Ag+浓度由大到小的顺序是_______ (填序号)。
(2)大量的碘富集在海藻中,用水浸取后浓缩,该浓缩液中主要含有I-、Cl-等离子。取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 为
为_______ 。
(3)钡餐是医学检查肠胃的常用造影剂。当人体中Ba2+浓度达到2×10-3mol·L-1时会影响健康,若有人误服氯化钡,请回答能否通过服用5%的硫酸钠溶液有效除去胃中的Ba2+并说明理由。(已知:5%的硫酸钠溶液物质的量浓度约0.36mol·L-1)_______ 。
| 难溶电解质 | AgCl | AgBr | AgI | BaSO4 |
| Ksp | 1.8×10-10 | 4.9×10-13 | 8.3×10-17 | 1×10-10 |
(1)现将足量AgCl(s)分别加入下列四种溶液:①100mL蒸馏水;②100mL0.1mol·L-1盐酸;③100mL0.1mol·L-1AlCl3溶液,④100mL0.1mol·L-1MgCl2溶液。充分搅拌后,相同温度下,Ag+浓度由大到小的顺序是
(2)大量的碘富集在海藻中,用水浸取后浓缩,该浓缩液中主要含有I-、Cl-等离子。取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
 为
为(3)钡餐是医学检查肠胃的常用造影剂。当人体中Ba2+浓度达到2×10-3mol·L-1时会影响健康,若有人误服氯化钡,请回答能否通过服用5%的硫酸钠溶液有效除去胃中的Ba2+并说明理由。(已知:5%的硫酸钠溶液物质的量浓度约0.36mol·L-1)
您最近一年使用:0次
【推荐1】用CO2制备CH3OH可实现CO2的能源化利用,同时甲醇也是重要的化工原料,发展前景广阔。制备CH3OH反应如下:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
(1)温度为523K时,测得上述反应中生成8.0gCH3OH(g)放出的热量为12.3kJ。反应的热化学方程式为___________ 。
(2)该反应的化学平衡常数表达式K=___________ 。
在实验室模拟上述反应。一定温度下,向体积为1L的恒容密闭容器中充入3mol 和6moH2,加入合适的催化剂进行反应。已知该温度下反应的化学平衡常数值为K=1/40某时刻测得c(CH3OH)=1mo/L,此时反应___________ (填“已经达到“或未达到”)化学平衡状态。
(3)工业上用CO2制备CH3OH的过程中存在以下副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.2kJ/mol,将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
CO(g)+H2O(g) △H=+41.2kJ/mol,将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
①不同温度和压强下,CH3OH平衡产率和CO2平衡转化率分别如图1、图2。
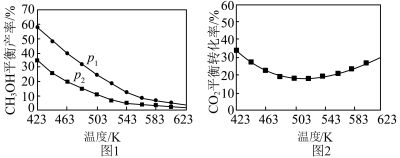
i.图1中,压强p1___________ p2(填“>”“=”或“<”),推断的依据是___________ 。
ii.图2中,压强为p2,温度高于503K后,CO2平衡转化率随温度升高而增大的原因是___________ 。
②实际生产中,测得压强为p3时,相同时间内不同温度下的CH3OH产率如图3。图3中523K时的CH3OH产率最大,可能的原因是___________ (字母序号)。
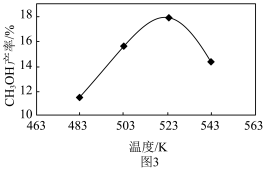
a.此条件下主反应限度最大 b.此条件下主反应速率最快 c.523K时催化剂的活性最强
③某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态):
【注】甲醇选择性:转化的CO2中生成甲醇的百分比
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是______ 。
(4)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a是___________ 极(填“阴”或“阳”)生成甲醇的电极反应式是___________ 。
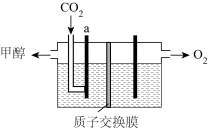
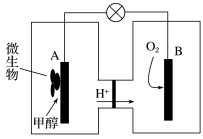
(5)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示,A电极反应是___________ ,B电极反应是___________ 。
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。(1)温度为523K时,测得上述反应中生成8.0gCH3OH(g)放出的热量为12.3kJ。反应的热化学方程式为
(2)该反应的化学平衡常数表达式K=
在实验室模拟上述反应。一定温度下,向体积为1L的恒容密闭容器中充入3mol 和6moH2,加入合适的催化剂进行反应。已知该温度下反应的化学平衡常数值为K=1/40某时刻测得c(CH3OH)=1mo/L,此时反应
(3)工业上用CO2制备CH3OH的过程中存在以下副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.2kJ/mol,将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
CO(g)+H2O(g) △H=+41.2kJ/mol,将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。①不同温度和压强下,CH3OH平衡产率和CO2平衡转化率分别如图1、图2。

i.图1中,压强p1
ii.图2中,压强为p2,温度高于503K后,CO2平衡转化率随温度升高而增大的原因是
②实际生产中,测得压强为p3时,相同时间内不同温度下的CH3OH产率如图3。图3中523K时的CH3OH产率最大,可能的原因是

a.此条件下主反应限度最大 b.此条件下主反应速率最快 c.523K时催化剂的活性最强
③某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态):
| T(K) | CO2实际转化率(%) | 甲醇选择性(%)【注】 |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是
(4)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a是

(5)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示,A电极反应是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】I.已知:CO2(g)+H2(g) CO(g)+H2O(g)△H1=+41.2kJ·mol-1K1
CO(g)+H2O(g)△H1=+41.2kJ·mol-1K1
CO(g)+2H2(g) CH3OH(g)△H2=-90.6kJ·mol-1K2
CH3OH(g)△H2=-90.6kJ·mol-1K2
则CO2(g)和H2(g)的反应生成CH3OH(g)的热化学方程式III为______ ,该反应的化学平衡常数K3=_____ 。(用K1,K2表示)CH3OH(g)燃料电池在碱性条件(KOH溶液)下的负极反应式为__________ ,正极反应式为___ 。
II.已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的△H=______ 0(填“<”“>”“=”);
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1.则A的平均反应速率v(A)=______ 。该反应达到平衡时A的转化率为______ ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率____ (填”变大“、”变小“或”不变“)
(3)1200℃时,若向另一相同容器中充入0.30molA、0.40molB、0.40molC和0.50molD,此时v正______ v逆(填”大于“、”小于“或”等于“)。
 CO(g)+H2O(g)△H1=+41.2kJ·mol-1K1
CO(g)+H2O(g)△H1=+41.2kJ·mol-1K1CO(g)+2H2(g)
 CH3OH(g)△H2=-90.6kJ·mol-1K2
CH3OH(g)△H2=-90.6kJ·mol-1K2则CO2(g)和H2(g)的反应生成CH3OH(g)的热化学方程式III为
II.已知A(g)+B(g)
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/℃ | 700 | 800 | 900 | 1000 | 1200 |
| 平衡常数 | 0.5 | 0.6 | 1.0 | 1.6 | 2.0 |
(1)该反应的△H=
(2)900℃时,向一个固定容器为2L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始到2s内A浓度变化0.05mol•L-1.则A的平均反应速率v(A)=
(3)1200℃时,若向另一相同容器中充入0.30molA、0.40molB、0.40molC和0.50molD,此时v正
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g) 2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g) 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=____ kJ·mol-1。
(2)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g) CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。
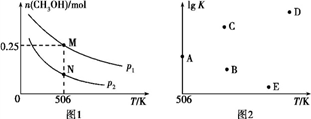
①M点时,H2的转化率为____ ;压强:p1____ (填“>”“<”或“=”)p2。
②反应速率:N点v正(CO)____ (填“>”“<”或“=”)M点v逆(CO)。
③若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图2所示。则温度为506 K时,平衡常数K=____ (保留三位小数),B、C、D、E四点中能正确表示该反应的lg K与T的关系的点为____ 。
④在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为________ 。
(3)某甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,写出此时负极的电极反应式________________________________ 。
①2CH4(g)+O2(g)
 2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1②CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2③2CH4(g)+O2(g)
 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1(1)ΔH2=
(2)在体积可变的密闭容器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。
①M点时,H2的转化率为
②反应速率:N点v正(CO)
③若压强为p1、在1 L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(lg K)如图2所示。则温度为506 K时,平衡常数K=
④在2 L恒容密闭容器中充入a(a>0) mol H2、2 mol CO和7.4 mol CH3OH(g),在506 K下进行上述反应。为了使该反应逆向进行,a的范围为
(3)某甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,写出此时负极的电极反应式
您最近一年使用:0次



