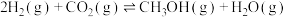烟气中的氮氧化物是造成大气污染的重要因素。
(1)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
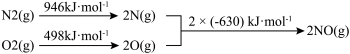
则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为___ 。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1所示。
①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____ 。
②NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示。请写出NO分解的化学方程式:______ 。
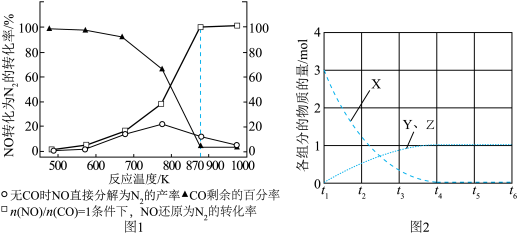
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验,实验结果如图3。
①同时脱硫脱硝时NO的氧化率略低的原因是____ 。
②由图3可知SO2对NO的氧化率影响很小的原因是_____ 。
(4)有人设想采用下列方法减少烟气中的氮氧化物对环境的污染:用天然气中的CH4、H2等还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NOx。请写出这种含硫化合物和NOx反应的化学方程式:_____ 。
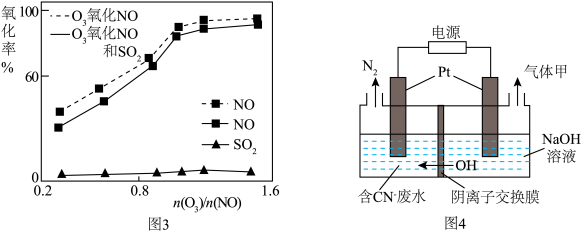
(5)某工业废水中含有毒性较大的CN-,可用电解法将其转变为N2,装置如图4所示。电解池中生成N2的电极反应式为_____ 。
(1)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
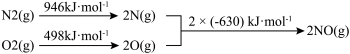
则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1所示。
①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为
②NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示。请写出NO分解的化学方程式:

(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验,实验结果如图3。
①同时脱硫脱硝时NO的氧化率略低的原因是
②由图3可知SO2对NO的氧化率影响很小的原因是

(4)有人设想采用下列方法减少烟气中的氮氧化物对环境的污染:用天然气中的CH4、H2等还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NOx。请写出这种含硫化合物和NOx反应的化学方程式:
(5)某工业废水中含有毒性较大的CN-,可用电解法将其转变为N2,装置如图4所示。电解池中生成N2的电极反应式为
更新时间:2019-06-01 22:15:43
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以粗镍(含少量Fe和Cr杂质)为原料制备醋酸镍的工艺流程如下:
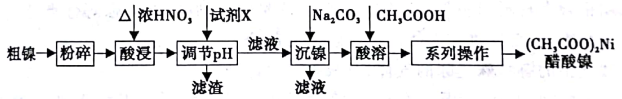
已知:
回答以下问题:
(1)粗镍原料在酸浸前粉碎的原因是_______________ 。
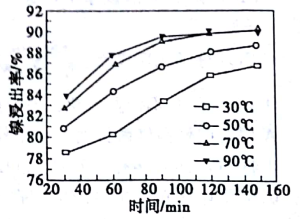
(2)酸浸过程中,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为_____ ℃、_____ min。
(3)酸浸中Ni 和浓硝酸反应的化学方程式为___________ 。
(4)加入试剂X 为_____ (填下列提供试剂的序号),可调节溶液pH 至______ (填pH 范围)。
A.H2SO4 B.Cr2O3 C.NaOH D.Fe2O3
(5)进入“沉镍”步骤的滤液中c(Ni2+)= 2.0mol/L,若要处理1L该滤液使Ni2+ 完全沉淀[c(Ni2+)≤10-5mol/L],则需要加入Na2CO3固体的质量最少为______ g。(已知NiCO3的Ksp=9.6×10-6,结果保留小数点后2 位有效数字)

已知:
| 离子 | Fe3+ | Cr3+ | Ni2+ |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答以下问题:
(1)粗镍原料在酸浸前粉碎的原因是
(2)酸浸过程中,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为

(3)酸浸中Ni 和浓硝酸反应的化学方程式为
(4)加入试剂X 为
A.H2SO4 B.Cr2O3 C.NaOH D.Fe2O3
(5)进入“沉镍”步骤的滤液中c(Ni2+)= 2.0mol/L,若要处理1L该滤液使Ni2+ 完全沉淀[c(Ni2+)≤10-5mol/L],则需要加入Na2CO3固体的质量最少为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】研究NOx、CO2的吸收利用,对促进低碳社会的构建和环境的保护具有重要意义。
(1)已知C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=a kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=b kJ·mol-1
H2O(l)=H2O(g) △H=c kJ·mol-1
则C2H4(g)+6NO(g) 3N2(g)+2CO2(g)+2H2O(l)的反应热△H=
3N2(g)+2CO2(g)+2H2O(l)的反应热△H=______ 。
(2)用NH3催化还原NOx可以消除氮氧化物的污染。如下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(脱氮率即氮氧化物的转化率),反应原理为:NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g) △H<0。
2N2(g)+3H2O(g) △H<0。
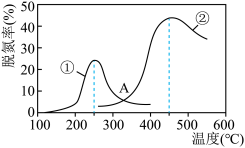
以下说法正确的是______ 。
A.催化剂①、②分别适合于250℃和450℃左右脱氮
B.使用第②种催化剂更有利于提高NOx的平衡转化率
C.相同条件下,改变压强对脱氮率没有影响
D.在交叉点A处,不管使用哪种催化剂,上述反应都未达平衡。
(3)工业合成尿素的反应如下:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2,则此时v(正)______ v(逆)(填>、<或=)。判断的理由是______ 。
②若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和1 mol CO2,在40min时重新达到平衡,请在图中画出25~50min内NH3的浓度变化曲线。______ 。

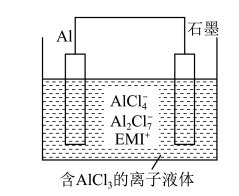
(4)用铝制作的“快速放电铝离子二次电池”的原理如右上图所示(EMI+为有机阳离子、电池工作时离子液体中微粒种类不变)。该电池放电时的负极反应方程式为____________ 。
(1)已知C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) △H=a kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=b kJ·mol-1
H2O(l)=H2O(g) △H=c kJ·mol-1
则C2H4(g)+6NO(g)
 3N2(g)+2CO2(g)+2H2O(l)的反应热△H=
3N2(g)+2CO2(g)+2H2O(l)的反应热△H=(2)用NH3催化还原NOx可以消除氮氧化物的污染。如下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(脱氮率即氮氧化物的转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)
 2N2(g)+3H2O(g) △H<0。
2N2(g)+3H2O(g) △H<0。
以下说法正确的是
A.催化剂①、②分别适合于250℃和450℃左右脱氮
B.使用第②种催化剂更有利于提高NOx的平衡转化率
C.相同条件下,改变压强对脱氮率没有影响
D.在交叉点A处,不管使用哪种催化剂,上述反应都未达平衡。
(3)工业合成尿素的反应如下:2NH3(g)+CO2(g)
 CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。
CO(NH2)2(l)+H2O(l) △H<0,在恒定温度下,将NH3和CO2按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质的浓度变化曲线如图所示。①若保持平衡时的温度和压强不变,再向容器中充入3mol的CO2,则此时v(正)
②若保持平衡时的温度和体积不变,25min时再向容器中充入2mol的NH3和1 mol CO2,在40min时重新达到平衡,请在图中画出25~50min内NH3的浓度变化曲线。


(4)用铝制作的“快速放电铝离子二次电池”的原理如右上图所示(EMI+为有机阳离子、电池工作时离子液体中微粒种类不变)。该电池放电时的负极反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
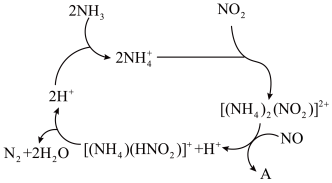
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________ (填化学式)
(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g) HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________ (填字母序号)
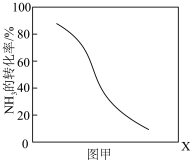
a.温度 b.压强 c.催化剂 d.
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图乙所示。
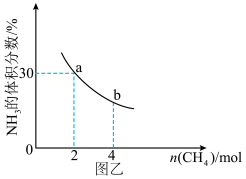
a点时,CH4的转化率为___________ %;平衡常数:K(a)_____ K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g) MbO2(aq),该反应的平衡常数可表示为:
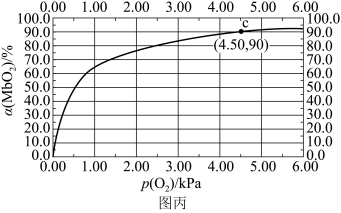
MbO2(aq),该反应的平衡常数可表示为: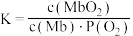 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[ ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________ (用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________ kPa-1。已知k逆=60s-1,则速率常数k正=___________ s-1·kPa-1。
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和

(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)
 HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是

a.温度 b.压强 c.催化剂 d.

②在一定温度下,向2L密闭容器中加入 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图乙所示。

a点时,CH4的转化率为
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)
 MbO2(aq),该反应的平衡常数可表示为:
MbO2(aq),该反应的平衡常数可表示为: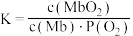 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[ ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=
②试求出图丙中c点时,上述反应的平衡常数K=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】硅和碳及其化合物多是新型无机非金属材料。
(1)金刚石属于_______ 晶体, 属于
属于_______ 晶体,石墨属于_______ 晶体,它们都是碳元素的_______ 。
(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以 为代表,结构如下图。
为代表,结构如下图。
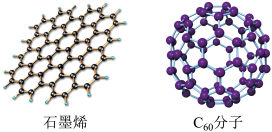
从石墨中剥离得到石墨烯需克服的作用是_______ ;在石墨烯中,每个六元环占有_______ 个C原子。1mol  分子中σ键数为
分子中σ键数为_______ (用 表示)。
表示)。
(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):_______ 。
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:_______ 。
(5)已知化学键的键能数据如下表:
已知反应热:△H=反应物的总键能之和-生成物的总键能之和。则反应 )的△H=
)的△H=_______ kJ/mol。
(1)金刚石属于
 属于
属于(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以
 为代表,结构如下图。
为代表,结构如下图。
从石墨中剥离得到石墨烯需克服的作用是
 分子中σ键数为
分子中σ键数为 表示)。
表示)。(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:
(5)已知化学键的键能数据如下表:
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
| 键能kJ/mol | 360 | 436 | 431 | 176 |
 )的△H=
)的△H=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】NOx储存还原技术法(NSR)利用催化剂消除汽车尾气中的NOx,其原理: △H。
△H。
(1)已知:① △H1;②
△H1;②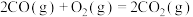 △H2;用含△H1和△H2的代数式表示△H=
△H2;用含△H1和△H2的代数式表示△H=___________ kJ⋅mol-1.汽车发动机工作时,会引发反应①,其能量变化如图所示。则△H1=___________ kJ⋅mol-1。

(2)NSR反应机理及相对能量如下图(TS表示过渡态):

反应过程中,决速步骤的热化学方程式为___________ 。
(3)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO模拟NSR反应,反应过程中c(NO)随时间变化的曲线如下图所示。

线a和b中,表示在该温度下使用NSR催化技术的是曲线_________ (选填“a”或“b”)。线a中前5min内CO的平均反应速率v(CO)=________ ;此温度下该反应的平衡常数K=_________ 。
(4)保持其他条件不变,平衡后再向容器中充入CO和N2各0.8mol,则此时v(正)________ v(逆)(选填“>”“<”或“=”)。
(5)若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是点___________ (选填“A”“B”“C”“D”或“E”)。
 △H。
△H。(1)已知:①
 △H1;②
△H1;②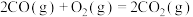 △H2;用含△H1和△H2的代数式表示△H=
△H2;用含△H1和△H2的代数式表示△H=
(2)NSR反应机理及相对能量如下图(TS表示过渡态):

反应过程中,决速步骤的热化学方程式为
(3)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO模拟NSR反应,反应过程中c(NO)随时间变化的曲线如下图所示。

线a和b中,表示在该温度下使用NSR催化技术的是曲线
(4)保持其他条件不变,平衡后再向容器中充入CO和N2各0.8mol,则此时v(正)
(5)若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是点
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】甲醇是一种高效清洁的新能源,在 的恒容密闭容器中充入
的恒容密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: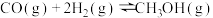 ,测得
,测得 和
和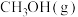 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
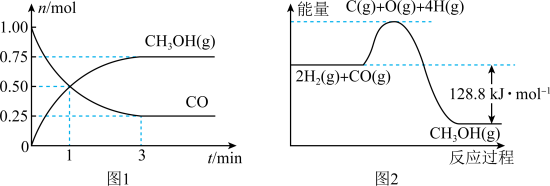
(1)根据题意和反应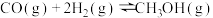 ,下列说法正确的是_______(填字母)。
,下列说法正确的是_______(填字母)。
(2)从反应开始至达到平衡,以 表示的反应的平均反应速率
表示的反应的平均反应速率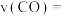
_______  。写出一条能增大反应速率的措施:
。写出一条能增大反应速率的措施:_______ 。
(3)下列描述中能说明上述反应达到平衡状态的是_______。
(4)平衡时 的体积分数为
的体积分数为_______ (保留3位有效数字)。
(5)已知断开 和
和 中的化学键需要吸收的能量为
中的化学键需要吸收的能量为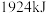 ,则断开
,则断开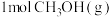 中的化学键所需要吸收
中的化学键所需要吸收_______  的能量。
的能量。
 的恒容密闭容器中充入
的恒容密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: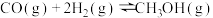 ,测得
,测得 和
和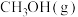 的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
的物质的量变化如图1所示,反应过程中的能量变化如图2所示。
(1)根据题意和反应
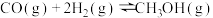 ,下列说法正确的是_______(填字母)。
,下列说法正确的是_______(填字母)。| A.该反应可以用于设计原电池,负极通入氢气 |
| B.该反应为放热反应,∆H>0 |
| C.等质量的甲醇蒸气和液态甲醇分别完全燃烧,后者放出的热量多 |
| D.甲醇属于可再生能源,其燃烧热的热化学方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH= -1800 kJ·mol-1 |
(2)从反应开始至达到平衡,以
 表示的反应的平均反应速率
表示的反应的平均反应速率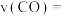
 。写出一条能增大反应速率的措施:
。写出一条能增大反应速率的措施:(3)下列描述中能说明上述反应达到平衡状态的是_______。
A. 和 和 三种物质的浓度相等 三种物质的浓度相等 |
| B.混合气体的密度不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
D.单位时间内消耗 的同时生成 的同时生成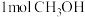 |
(4)平衡时
 的体积分数为
的体积分数为(5)已知断开
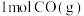 和
和 中的化学键需要吸收的能量为
中的化学键需要吸收的能量为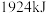 ,则断开
,则断开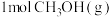 中的化学键所需要吸收
中的化学键所需要吸收 的能量。
的能量。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

回答下列问题:
(1)已知
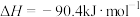 ,请计算
,请计算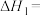
___________ 。
(2)在恒温恒容的容器中发生上述反应,下列说法正确的有___________。
(3)研究表明:其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性。使用该催化剂,将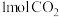 和
和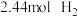 在
在 密闭容器中进行反应,
密闭容器中进行反应, 的平衡转化率和甲醇的选择率(甲醇的选择率:转化的
的平衡转化率和甲醇的选择率(甲醇的选择率:转化的 中生成甲醇的物质的量分数)随温度的变化趋势如图所示:
中生成甲醇的物质的量分数)随温度的变化趋势如图所示:
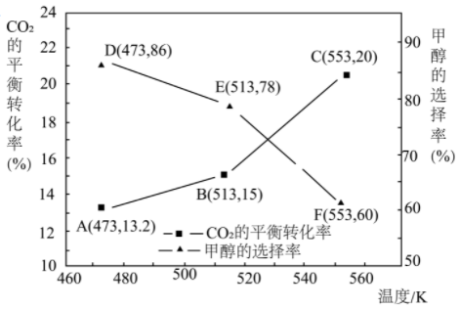
①温度为 ,经
,经 体系达到平衡,则
体系达到平衡,则 的平均反应速率为
的平均反应速率为___________ ,该温度下反应Ⅰ的平衡常数
___________ 。
②随着温度的升高, 的平衡转化率增加但甲醇的选择率降低,分析其原因
的平衡转化率增加但甲醇的选择率降低,分析其原因___________ 。
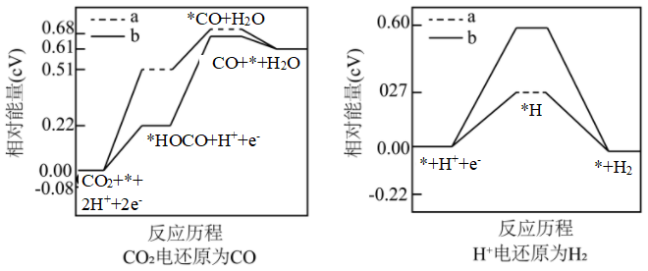
(4)研究表明,在电解质水溶液中, 可以被电化学还原。两种不同催化剂
可以被电化学还原。两种不同催化剂 、
、 上
上 电还原为
电还原为 的反应进程中(溶液中
的反应进程中(溶液中 被还原为
被还原为 的反应也同时发生)相对能量变化如图。由此判断,电解质溶液中主要发生
的反应也同时发生)相对能量变化如图。由此判断,电解质溶液中主要发生 还原为
还原为 反应的是
反应的是___________ (填 或
或 ),理由是
),理由是___________ 。
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.


Ⅱ.


回答下列问题:
(1)已知

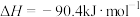 ,请计算
,请计算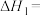
(2)在恒温恒容的容器中发生上述反应,下列说法正确的有___________。
| A.气体平均摩尔质量保持不变,反应体系已达平衡 |
B.加入催化剂,可提高 的平衡转化率 的平衡转化率 |
C.平衡后缩小体积增大体系压强,有利于提高 产率 产率 |
| D.平衡后升高温度,反应Ⅱ的正反应速率增大、逆反应速率减小,平衡正移 |
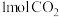 和
和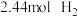 在
在 密闭容器中进行反应,
密闭容器中进行反应, 的平衡转化率和甲醇的选择率(甲醇的选择率:转化的
的平衡转化率和甲醇的选择率(甲醇的选择率:转化的 中生成甲醇的物质的量分数)随温度的变化趋势如图所示:
中生成甲醇的物质的量分数)随温度的变化趋势如图所示:
①温度为
 ,经
,经 体系达到平衡,则
体系达到平衡,则 的平均反应速率为
的平均反应速率为
②随着温度的升高,
 的平衡转化率增加但甲醇的选择率降低,分析其原因
的平衡转化率增加但甲醇的选择率降低,分析其原因(4)研究表明,在电解质水溶液中,
 可以被电化学还原。两种不同催化剂
可以被电化学还原。两种不同催化剂 、
、 上
上 电还原为
电还原为 的反应进程中(溶液中
的反应进程中(溶液中 被还原为
被还原为 的反应也同时发生)相对能量变化如图。由此判断,电解质溶液中主要发生
的反应也同时发生)相对能量变化如图。由此判断,电解质溶液中主要发生 还原为
还原为 反应的是
反应的是 或
或 ),理由是
),理由是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
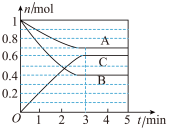
Ⅰ.一定条件下,在容积为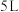 的密闭容器中,
的密闭容器中, 、B、C三种气体的物质的量
、B、C三种气体的物质的量 随时间
随时间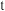 的变化如图甲所示,已知达到平衡后,降低温度,A的体积分数减小。
的变化如图甲所示,已知达到平衡后,降低温度,A的体积分数减小。
(1)该反应的化学方程式为___________ 。
(2)该反应的反应速率 随时间
随时间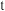 的关系如图所示:
的关系如图所示:

①根据图乙判断,在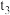 时刻改变的外界条件是
时刻改变的外界条件是___________ 。
② 、
、 、
、 对应的平衡状态中,C的体积分数最大的是状态
对应的平衡状态中,C的体积分数最大的是状态___________ 。
③各阶段的平衡常数如下表所示:
 、
、 、
、 之间的大小关系为
之间的大小关系为___________ (用“ ”“
”“ ”或“
”或“ ”连接)。
”连接)。
Ⅱ.在密闭容器中充入一定量的 ,发生反应:
,发生反应: ,如图所示为
,如图所示为 气体分解生成
气体分解生成 和
和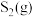 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
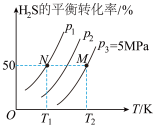
(3)
___________ (填“ ”“
”“ ”或“
”或“ ”)0。
”)0。
(4)图丙中压强( 、
、 、
、 )由大到小的顺序为
)由大到小的顺序为___________ 。
(5)该反应对应的平衡常数表达式K=___________ 。
(6)如果想进一步提高 的转化率,除改变温度、压强外,还可以采取的措施有
的转化率,除改变温度、压强外,还可以采取的措施有___________ 。
Ⅰ.一定条件下,在容积为
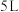 的密闭容器中,
的密闭容器中, 、B、C三种气体的物质的量
、B、C三种气体的物质的量 随时间
随时间 的变化如图甲所示,已知达到平衡后,降低温度,A的体积分数减小。
的变化如图甲所示,已知达到平衡后,降低温度,A的体积分数减小。
(1)该反应的化学方程式为
(2)该反应的反应速率
 随时间
随时间 的关系如图所示:
的关系如图所示:
①根据图乙判断,在
 时刻改变的外界条件是
时刻改变的外界条件是②
 、
、 、
、 对应的平衡状态中,C的体积分数最大的是状态
对应的平衡状态中,C的体积分数最大的是状态③各阶段的平衡常数如下表所示:
 |  |  |
 |  |  |
 、
、 、
、 之间的大小关系为
之间的大小关系为 ”“
”“ ”或“
”或“ ”连接)。
”连接)。Ⅱ.在密闭容器中充入一定量的
 ,发生反应:
,发生反应: ,如图所示为
,如图所示为 气体分解生成
气体分解生成 和
和 的平衡转化率与温度、压强的关系。
的平衡转化率与温度、压强的关系。
(3)

 ”“
”“ ”或“
”或“ ”)0。
”)0。(4)图丙中压强(
 、
、 、
、 )由大到小的顺序为
)由大到小的顺序为(5)该反应对应的平衡常数表达式K=
(6)如果想进一步提高
 的转化率,除改变温度、压强外,还可以采取的措施有
的转化率,除改变温度、压强外,还可以采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氨气是重要的化工原料,广泛应用于化工、轻工、制药、合成纤维等领域。
(1)一定条件下,Haber法工业合成氨反应的能量变化如图所示(ad表示被催化剂吸附,反应历程中粒子均为气态):
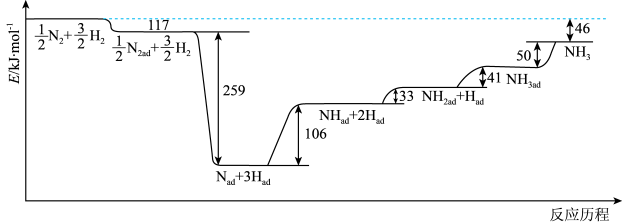
①该条件下,N2(g)+3H2(g)⇌2NH3(g) △H=_______ 。
②写出一条既能加快反应速率又能提高N2平衡转化率的措施_______ 。
(2)工业上用NH3催化还原烟气中NOx可以消除氮氧化物的污染。烟气以一定的流速通过两种不同催化剂,测得烟气脱氮率(即氮氧化物转化率)与温度的关系如图。
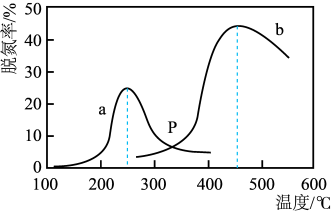
反应原理为:NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g)。
下列说法正确的是_______(填序号)。
(3)温度为T时,在恒容的密闭容器中充入0.5molNH3(g)和1molNO(g),发生反应:4NH3(g)+6NO(g)⇌ 5N2(g)+6H2O(1)。起始压强为pkPa,10min时达到平衡,测得压强为 pkPa。则10min内N2的反应速率v(N2)=
pkPa。则10min内N2的反应速率v(N2)=_______ kPa/min。T时,该反应的平衡常数Kp=_______ (列出含p的计算式即可;分压=总压×物质的量分数)。
(4)我国科学家合成了一种新型的Fe-SnO2催化剂,用该催化剂修饰电极,可实现室温条件下电催化固氮生产氨和硝酸,原理如图所示:
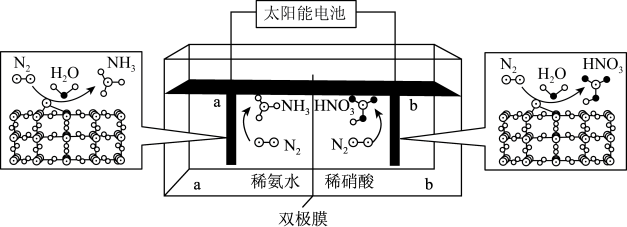
①电解时双极膜中的H2O解离为H+和OH-,H+向_______ 室(填“a”或“b”)移动。
②写出阳极的电极反应式_______ 。
(1)一定条件下,Haber法工业合成氨反应的能量变化如图所示(ad表示被催化剂吸附,反应历程中粒子均为气态):

①该条件下,N2(g)+3H2(g)⇌2NH3(g) △H=
②写出一条既能加快反应速率又能提高N2平衡转化率的措施
(2)工业上用NH3催化还原烟气中NOx可以消除氮氧化物的污染。烟气以一定的流速通过两种不同催化剂,测得烟气脱氮率(即氮氧化物转化率)与温度的关系如图。

反应原理为:NO(g)+NO2(g)+2NH3(g)⇌2N2(g)+3H2O(g)。
下列说法正确的是_______(填序号)。
| A.相同条件下,改变压强对脱氮率没有影响 |
| B.在交叉点P处,不管使用哪种催化剂,上述反应都未达平衡 |
| C.催化剂a、b分别适合于250℃和450℃左右脱氮 |
| D.由曲线a温度升高到一定程度后脱氮率下降可推知该反应为放热反应 |
 pkPa。则10min内N2的反应速率v(N2)=
pkPa。则10min内N2的反应速率v(N2)=(4)我国科学家合成了一种新型的Fe-SnO2催化剂,用该催化剂修饰电极,可实现室温条件下电催化固氮生产氨和硝酸,原理如图所示:

①电解时双极膜中的H2O解离为H+和OH-,H+向
②写出阳极的电极反应式
您最近一年使用:0次
【推荐1】回答下列问题:
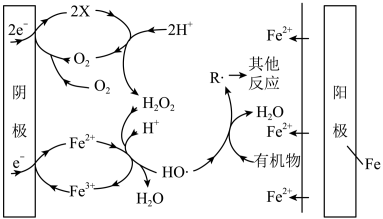
(1)EF、H2O2、FeOx,法可用于水体中有机污染物降解,其反应机理如图所示。阳极的电极反应式为____ ,X微粒的化学式为____ ,阴极附近Fe2+参与反应的离子方程式为___ 。
(2)将一定量的氢基甲酸铵置于恒容真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是___ 。
a.2v正(NH3)=V逆(CO2)
b.密闭容器中c(NH3):c(CO2)=2:1
c.密闭容器中混合气体的密度不变
d.混合气体压强不再发生变化
e.气体的平均相对分子质量不变
(3)中科院化学所研究了下列反应的反应历程,如图所示:
CH3OH(g)+CO2(g)+H2(g) CH3COOH(g)+H2O(g)
CH3COOH(g)+H2O(g)
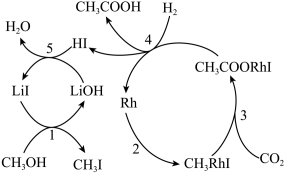
反应历程中,能降低反应活化能的物质有___ (填化学式);中间产物有___ 种。
(1)EF、H2O2、FeOx,法可用于水体中有机污染物降解,其反应机理如图所示。阳极的电极反应式为

(2)将一定量的氢基甲酸铵置于恒容真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是a.2v正(NH3)=V逆(CO2)
b.密闭容器中c(NH3):c(CO2)=2:1
c.密闭容器中混合气体的密度不变
d.混合气体压强不再发生变化
e.气体的平均相对分子质量不变
(3)中科院化学所研究了下列反应的反应历程,如图所示:
CH3OH(g)+CO2(g)+H2(g)
 CH3COOH(g)+H2O(g)
CH3COOH(g)+H2O(g)
反应历程中,能降低反应活化能的物质有
您最近一年使用:0次
【推荐2】推动煤炭清洁高效利用是未来煤炭利用的发展方向,其中煤制天然气(主要成分甲烷)能对燃气资源有重要补充作用。
在催化剂作用下,其涉及的主要反应如下:
CO(g) +3H2(g)⇌CH4(g)+H2O(g)△H1Ⅰ
CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2═-41.2 kJ∙mol−1Ⅱ
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H3Ⅲ
其副反应(积碳反应)如下:
2CO(g)⇌CO2(g)+C(s) △H4═-172.0kJ•mol﹣1Ⅳ
CO2(g)+2H2(g)⇌2H2O(g)+C(s) △H5═-90.0kJ•mol﹣1Ⅴ
CO(g)+H2(g)⇌H2O(g)+C(s) △H6═-131.0kJ•mol﹣1Ⅵ
(1)荷兰埃因霍温大学学者结合实验与计算机模拟结果,研究了在催化剂钴表面上反应Ⅰ的反应历程,如图所示,其中吸附在钴催化剂表面上的物种用*标注。
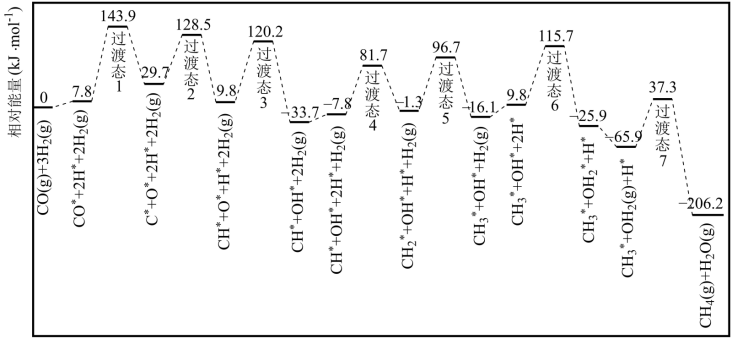
①该历程中最大能垒E正=_____ kJ∙mol−1,写出该步骤的化学方程式_____ 。
②△H3=_____ kJ∙mol−1。
(2)若原料气n(H2):n(CO)=3:1,且反应容器中只考虑主要反应。
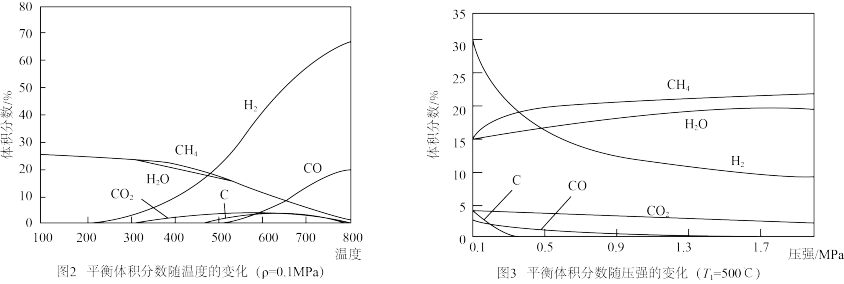
①在催化剂作用下合成天然气,平衡时各组分的体积分数随温度、压强变化如图2、图3所示。根据图象分析,反应Ⅰ在_____ 温(填“高”或“低”)、_____ 压(填“高“或“低”)条件下有利于反应进行。
②T2℃,0.1MPa恒压条件条件下,平衡时反应体系平衡组成如表所示。
该条件下CO的总转化率表达式α=_____ 。Kp、Kx分别是以分压、物质的量分数表示的平衡常数,反应Ⅰ的Kx=_____ 。(以Kp和p总表示)
(3)若反应容器中考虑主、副反应。维持p总=0.1MPa恒定,平衡时CO转化率和积碳的选择性(积碳的选择性=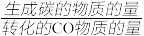 ×100%)随温度和进料气中水蒸气量的变化如图4和图5所示。其中n(H2):n(CO):n(H2O)=3:1:X,代表原料气中H2、CO和H2O三者的物质的量之比,X为一变量,下列说法正确的是
×100%)随温度和进料气中水蒸气量的变化如图4和图5所示。其中n(H2):n(CO):n(H2O)=3:1:X,代表原料气中H2、CO和H2O三者的物质的量之比,X为一变量,下列说法正确的是_____ 。

A图4中,随着X的增大,CO转化率略有降低,可能原因是反应式Ⅰ中H2O为生成物,增加水蒸气的量会促使平衡向逆反应方向移动
B图5中,X较低时,在800~850℃积碳选择性减小的原因可能是副反应为放热反应,温度较高,积碳反应平衡逆向移动
C图5中,X较高时,在550~800℃积碳选择性较低的主要原因是水蒸气的稀释作用使积碳反应速率减小
D总体上说,X较高,温度低于450℃利于降低积碳,减少积碳对催化剂的影响
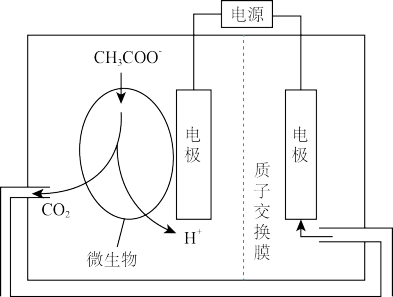
(4)生物电化学系统还原CO2是另一种产生甲烷的方法,装置如图所示,请写出电解时阴极的电极反应式_____ 。
在催化剂作用下,其涉及的主要反应如下:
CO(g) +3H2(g)⇌CH4(g)+H2O(g)△H1Ⅰ
CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2═-41.2 kJ∙mol−1Ⅱ
CO2(g)+4H2(g)⇌CH4(g)+2H2O(g)△H3Ⅲ
其副反应(积碳反应)如下:
2CO(g)⇌CO2(g)+C(s) △H4═-172.0kJ•mol﹣1Ⅳ
CO2(g)+2H2(g)⇌2H2O(g)+C(s) △H5═-90.0kJ•mol﹣1Ⅴ
CO(g)+H2(g)⇌H2O(g)+C(s) △H6═-131.0kJ•mol﹣1Ⅵ
(1)荷兰埃因霍温大学学者结合实验与计算机模拟结果,研究了在催化剂钴表面上反应Ⅰ的反应历程,如图所示,其中吸附在钴催化剂表面上的物种用*标注。

①该历程中最大能垒E正=
②△H3=
(2)若原料气n(H2):n(CO)=3:1,且反应容器中只考虑主要反应。
①在催化剂作用下合成天然气,平衡时各组分的体积分数随温度、压强变化如图2、图3所示。根据图象分析,反应Ⅰ在

②T2℃,0.1MPa恒压条件条件下,平衡时反应体系平衡组成如表所示。
| 组分 | CH4 | H2O | H2 | CO2 | CO |
| 体积分数x | a | b | c | d | e |
(3)若反应容器中考虑主、副反应。维持p总=0.1MPa恒定,平衡时CO转化率和积碳的选择性(积碳的选择性=
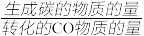 ×100%)随温度和进料气中水蒸气量的变化如图4和图5所示。其中n(H2):n(CO):n(H2O)=3:1:X,代表原料气中H2、CO和H2O三者的物质的量之比,X为一变量,下列说法正确的是
×100%)随温度和进料气中水蒸气量的变化如图4和图5所示。其中n(H2):n(CO):n(H2O)=3:1:X,代表原料气中H2、CO和H2O三者的物质的量之比,X为一变量,下列说法正确的是
A图4中,随着X的增大,CO转化率略有降低,可能原因是反应式Ⅰ中H2O为生成物,增加水蒸气的量会促使平衡向逆反应方向移动
B图5中,X较低时,在800~850℃积碳选择性减小的原因可能是副反应为放热反应,温度较高,积碳反应平衡逆向移动
C图5中,X较高时,在550~800℃积碳选择性较低的主要原因是水蒸气的稀释作用使积碳反应速率减小
D总体上说,X较高,温度低于450℃利于降低积碳,减少积碳对催化剂的影响
(4)生物电化学系统还原CO2是另一种产生甲烷的方法,装置如图所示,请写出电解时阴极的电极反应式

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】杭州第19届亚洲运动会主火炬的燃料是“废碳再生”的绿色甲醇,将利用CO或 来生产甲醇的研究提升到新高度。已知:
来生产甲醇的研究提升到新高度。已知:
回答下列问题:
(1)反应③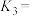
______ (用 、
、 表示),
表示),
______ (填“>”或“<”)0。
(2)向1.0 L恒容密闭容器中充入0.1 mol 和0.3 mol
和0.3 mol  ,在催化剂作用下利用反应③制备甲醇。已知正反应速率可表示为
,在催化剂作用下利用反应③制备甲醇。已知正反应速率可表示为 ,逆反应速率可表示为
,逆反应速率可表示为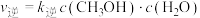 ,其中
,其中 、
、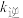 为速率常数。
为速率常数。
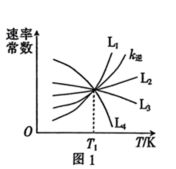
①图1表示速率常数随温度的变化关系,其中能够代表 的曲线为
的曲线为______ (填“ ”“
”“ ”“
”“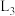 ”“
”“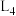 ”)。
”)。 的转化率如图2所示,则温度为T₄K时,该时间段内达到平衡状态后容器内的压强与反应开始时的压强之比为
的转化率如图2所示,则温度为T₄K时,该时间段内达到平衡状态后容器内的压强与反应开始时的压强之比为______ 。 、
、 的循环利用。
的循环利用。______ 极,交换膜为______ ,左室发生的电极反应为____________ 。
②若电解前,左右两室质量相等,得到1 mol ,理论上两室质量差为
,理论上两室质量差为______ g(忽略氧气、二氧化碳在水中的溶解)。
 来生产甲醇的研究提升到新高度。已知:
来生产甲醇的研究提升到新高度。已知:化学反应 | 平衡常数 | 温度/℃ | |
| 450 | 850 | ||
|
| 1.0 | 0.04 |
|
| 4.0 | 0.15 |
|
| ||
(1)反应③
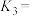
 、
、 表示),
表示),
(2)向1.0 L恒容密闭容器中充入0.1 mol
 和0.3 mol
和0.3 mol  ,在催化剂作用下利用反应③制备甲醇。已知正反应速率可表示为
,在催化剂作用下利用反应③制备甲醇。已知正反应速率可表示为 ,逆反应速率可表示为
,逆反应速率可表示为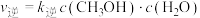 ,其中
,其中 、
、 为速率常数。
为速率常数。①图1表示速率常数随温度的变化关系,其中能够代表
 的曲线为
的曲线为 ”“
”“ ”“
”“ ”“
”“ ”)。
”)。
 的转化率如图2所示,则温度为T₄K时,该时间段内达到平衡状态后容器内的压强与反应开始时的压强之比为
的转化率如图2所示,则温度为T₄K时,该时间段内达到平衡状态后容器内的压强与反应开始时的压强之比为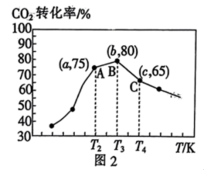
 、
、 的循环利用。
的循环利用。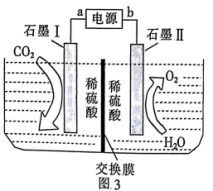
②若电解前,左右两室质量相等,得到1 mol
 ,理论上两室质量差为
,理论上两室质量差为
您最近一年使用:0次