室温下,下列指定溶液中微粒的浓度关系正确的是( )
A.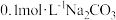 溶液中: 溶液中: |
B.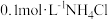 溶液中: 溶液中: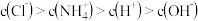 |
C.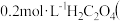 弱酸 弱酸 与 与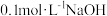 溶液等体积混合的溶液中: 溶液等体积混合的溶液中: 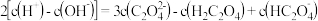 |
D.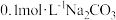 溶液与同浓度等体积盐酸混合的溶液中: 溶液与同浓度等体积盐酸混合的溶液中: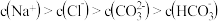 |
更新时间:2019-06-28 08:28:17
|
相似题推荐
多选题
|
较难
(0.4)
名校
【推荐1】向体积为10mL、浓度均为与0.1mol·L-1H2SO3与NaHSO3混合溶液中,逐滴滴加0.1mol·L-1NaOH溶液,滴定曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系正确的是


| A.在a点所示的溶液中:c(HSO3-)>c(Na+)>c(H2SO3)>c(H+) |
| B.在b 点所示的溶液中:2c(Na+)==c(H2S03)+c(HSO3-)+c(S032-) |
| C.在c点所示的溶液中:c(Na+)==c(HSO3-)+c(S032-) |
| D.在d点所示的溶液中:3c(H2S03)+c(HSO3-)>c(S032-) |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐2】25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:c( )>c( )>c( )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
C.在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c( )+c( )+c( )+c(H2CO3) )+c(H2CO3) |
| D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)> c(Cl-)> c(CH3COOH)> c(H+) |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐3】室温下,用相同浓度的NaOH 溶液,分别滴定100mL浓度均为0.1mol·L-1 的三种酸(HM、HN和HR) 溶液,滴定的曲线如图所示,下列判断错误的是( )


| A.三种酸的电离常数关系: KHR>KHN>KHM |
| B.pH=7时,三种溶液中:c (M-) >c (N-)>c (R-) |
| C.滴定至P点时,溶液中:c (Na+) >c (N-) >c (HN) >c (H+) >c (OH-) |
| D.当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR) =c(OH-)-c(H+) |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐1】甲胺(CH3NH2)与盐酸反应生成甲胺盐酸盐(CH3NH3Cl)。25℃时,向一定体积0.01mol·L-1CH3NH2水溶液(对应图中M点)中缓慢通入HCl气体,溶液的pH与pOH[pOH=-lgc(OH-)的关系如图所示。下列叙述不正确的是


| A.图中a=2.7,b=5 |
B.该过程中, 增大 增大 |
| C.Q点溶液中溶质为CH3NH3Cl和CH3NH2 |
D.N点溶液中:c( )=c(Cl-) )=c(Cl-) |
您最近一年使用:0次
多选题
|
较难
(0.4)
解题方法
【推荐2】室温下,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。氨水可用于工业尾气中SO2的吸收。下列指定溶液中微粒的物质的量浓度关系正确的是( )
| A.氨水与SO2反应恰好生成(NH4)2SO3时:c(NH4+)>c(SO32-)>c(OH-)>c(H+) |
| B.氨水与SO2反应所得溶液pH=9时:c(NH4+)+c(H+)<3c(HSO3-)+c(OH-) |
| C.氨水与SO2反应生成等物质的量NH4HSO3和(NH4)2SO3时:3c(NH4+)+3c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) |
| D.氨水与SO2反应恰好生成NH4HSO3时:c(H+)+c(H2SO3)=c(OH-)+c(SO32-)+c(NH3·H2O) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐3】25℃时,在醋酸和醋酸钠混合溶液中有c(CH3COOH)+c(CH3COO―)=0.1mol/L且c(CH3COOH)、c(CH3COO―)与pH的关系如图。有关离子浓度叙述正确的是


| A.pH=3.5溶液中:c(Na+)+c(H+)-c(OH―)+c(CH3COOH) =0.1mol/L |
| B.pH=5.5溶液中:c(CH3COOH)>c(CH3COO―)>c(H+)>c(OH―) |
| C.W点表示溶液中:c(Na+)+c(H+) =c(CH3COO―)+c(OH―) |
| D.向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH―) |
您最近一年使用:0次



