已知:NaHSO3溶液呈酸性。常温下,将0.1 mol/L亚硫酸(忽略H2SO3的分解)与0.1 mol/L NaOH溶液等体积混合,下列关于该混合溶液说法不正确 的是
| A.c(Na+) > c(HSO3-) > c(H2SO3) > c(SO32-) |
| B.c(Na+) = c(HSO3-) + c(SO32-) + c(H2SO3) |
| C.c(HSO3-) + c(H2SO3) + c(SO32-) = 0.05 mol/L |
| D.c(Na+) + c(H+) > c(HSO3-) + c(SO32-) + c(OH-) |
更新时间:2019-07-07 17:45:55
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】25℃时,0.1 mol·L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如下图所示。下列说法正确的是
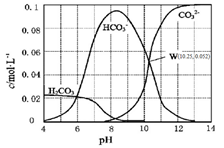

| A.在pH=7.0时,溶液中含碳粒子只有CO32-和HCO3- |
| B.向Na2CO3溶液中通入HCl气体,立即产生CO2气体 |
| C.H2CO3的Ka2=1.0×10-10.25 |
| D.向100 mL 0.1 mol·L-1碳酸钠溶液中滴加盐酸至溶液pH="4.0" ,生成CO2气体224 mL |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列关于NA说法正确的是
| A.28g乙烯与环丙烷混合物,其H原子数目为4NA |
| B.电解精炼铜,阳极(粗铜)质量减少64g,转移电子数目为2NA |
C.常温下,向0.1mol•L-1NH4Cl溶液中通NH3至中性,则溶液中NH 数目为0.1NA 数目为0.1NA |
| D.0.1molCH3COOH与足量CH3CH2OH充分反应生成的CH3COOCH2CH3分子数目为0.1NA |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】常温下,盐酸和氢氧化钠溶液相互反应的pH值变化曲线如图所示,下列说法正确的是( )


| A.NaOH溶液的物质的量浓度为1.0×10﹣13mol•L﹣1 |
| B.a和b曲线上的任何一点都有:c(Na+)+c(H+)=c(Cl﹣)+c(OH﹣) |
| C.P点溶液中:c(Na+)>c(Cl﹣) |
| D.曲线b是氢氧化钠溶液中逐滴加入盐酸的pH值变化曲线 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3 ⑤NH4HCO3,按c(CO32-)由小到大排列顺序正确的是
| A.⑤<④<③<②<① | B.③<⑤<②<④<① |
| C.③<②<⑤<④<① | D.③<⑤<④<②<① |
您最近一年使用:0次

 )+c(
)+c( )+c(H2CO3)
)+c(H2CO3) )
)

