已知2A2(g)+B2(g) 2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________ 。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将______ (填“增大“、“减小”或“不变”)
(3)恒压的密闭容器中发生可逆反应2A2(g)+B2(g) 2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是
2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 ( )
A. v(A2):v(C3)=3:2
B.反应混合气体的密度不再变化
C.反应混合气体的平均摩尔质量不再变化
D.A2、B2两种反应物的转化率不再变化
E. A2、B2、C3三种物质的浓度相等
F.密闭容器内的压强不再变化
(4)改变某一条件,得到如上图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____ ;
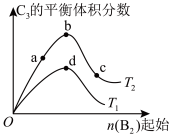
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2_______ Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是_______ (填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
 2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g) △H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。(1)达到平衡时, A2的转化率为
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将
(3)恒压的密闭容器中发生可逆反应2A2(g)+B2(g)
 2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是
2C3(g) △H=-Q1 kJ/mol(Q1>0),在一定条件下达到化学平衡状态的标志是 A. v(A2):v(C3)=3:2
B.反应混合气体的密度不再变化
C.反应混合气体的平均摩尔质量不再变化
D.A2、B2两种反应物的转化率不再变化
E. A2、B2、C3三种物质的浓度相等
F.密闭容器内的压强不再变化
(4)改变某一条件,得到如上图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是

a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2
(6)下列措施可以同时提高反应速率和B2的转化率是
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
更新时间:2019-09-02 18:41:20
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】某化工厂利用CH4制取CO和H2,其生产流程如图。回答下列问题:
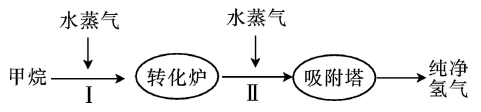
(1)该流程中第Ⅰ步反应为CH4(g)+H2O(g)⇌ CO(g)+3H2(g) ∆H,一定条件下,CH4的平衡转化率与温度、压强的关系如图,则P1______ (填“ ”“
”“ ”或“
”或“ ”,下同) P2,∆H
”,下同) P2,∆H ______ 0。
(2)该流程中第Ⅱ步反应的平衡常数随温度的变化如下表:
①据上表信息分析判断,该反应的∆H ______ (填“ ”“
”“ ”或“
”或“ ”)0。
”)0。
②写出第Ⅱ步反应的化学方程式:______ 。在830℃时,设起始时CO和H2O(g)的浓度均为0.10mol/L,在该条件下反应达到平衡时,CO的转化率为______ 。

(1)该流程中第Ⅰ步反应为CH4(g)+H2O(g)⇌ CO(g)+3H2(g) ∆H,一定条件下,CH4的平衡转化率与温度、压强的关系如图,则P1
 ”“
”“ ”或“
”或“ ”,下同) P2,∆H
”,下同) P2,∆H 
(2)该流程中第Ⅱ步反应的平衡常数随温度的变化如下表:
| 温度/℃ | 300 | 500 | 830 |
| 平衡常数K | 12 | 9 | 1 |
 ”“
”“ ”或“
”或“ ”)0。
”)0。②写出第Ⅱ步反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】PCl3与PCl5均是有机合成的重要中间体,两者存在以下相互转化关系:PCl5(g) PCl3(g)+Cl2(g)△H=a kJ•mol-1。在210℃时,将4 mol PCl5气体充入2 L真空密闭容器中发生上述反应,得到如下数据:
PCl3(g)+Cl2(g)△H=a kJ•mol-1。在210℃时,将4 mol PCl5气体充入2 L真空密闭容器中发生上述反应,得到如下数据:
(1)已知上述反应在温度较高时才能自发进行,则a______ 0(填>、﹦、<)。
(2)计算从20 s至40 s共20 s的时间内,用PCl3表示的平均反应速率为______ 。
(3)反应进行至60 s后,将混合物的温度降低,重新达到平衡后氯气浓度将______ (填“增大”、“减少”或“不变”)。
(4)欲增大该反应的K值,可采取的措施有(填序号)______ 。
A.降低温度 B.向混合气体中通入Cl2
C.使用高效催化剂 D.升高温度
(5)如图是210℃时容器中PCl5物质的量的变化曲线,请在该图中补画出该反应在160℃时PCl5物质的量的变化曲线_______________ 。

 PCl3(g)+Cl2(g)△H=a kJ•mol-1。在210℃时,将4 mol PCl5气体充入2 L真空密闭容器中发生上述反应,得到如下数据:
PCl3(g)+Cl2(g)△H=a kJ•mol-1。在210℃时,将4 mol PCl5气体充入2 L真空密闭容器中发生上述反应,得到如下数据:| 时间(s) | 0 | 20 | 40 | 60 |
| n(PCl5) | 4 | 2.8 | 2 | 2 |
(2)计算从20 s至40 s共20 s的时间内,用PCl3表示的平均反应速率为
(3)反应进行至60 s后,将混合物的温度降低,重新达到平衡后氯气浓度将
(4)欲增大该反应的K值,可采取的措施有(填序号)
A.降低温度 B.向混合气体中通入Cl2
C.使用高效催化剂 D.升高温度
(5)如图是210℃时容器中PCl5物质的量的变化曲线,请在该图中补画出该反应在160℃时PCl5物质的量的变化曲线

您最近一年使用:0次
填空题
|
适中
(0.65)
真题
名校
【推荐3】在温度t1和t2下,X2(g)和 H2反应生成HX的平衡常数如下表:
(1)已知t2>t1,HX的生成反应是_______ 反应(填“吸热”或“放热”)。
(2)HX的电子式是_______ 。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是_______ 。
(4)X2都能与H2反应生成HX,用原子结构解释原因:_______ 。
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:_______ ,原子半径逐渐增大,得电子能力逐渐减弱。
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______ (选填字母)
a. 在相同条件下,平衡时X2的转化率逐渐降低
b. X2与H2反应的剧烈程度逐渐减弱
c. HX的还原性逐渐
d. HX的稳定性逐渐减弱
| 化学方程式 | K (t1 ) | K (t2) |
F2+H2 2HF 2HF | 1.8×1036 | 1.9×1032 |
Cl2+H2 2HCl 2HCl | 9.7×1012 | 4.2×1011 |
Br2+H2 2HBr 2HBr | 5.6×107 | 9.3×106 |
I2+H2 2HI 2HI | 43 | 34 |
(1)已知t2>t1,HX的生成反应是
(2)HX的电子式是
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是
(4)X2都能与H2反应生成HX,用原子结构解释原因:
(5)K的变化体现出X2化学性质的递变性,用原子结构解释原因:
(6)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,
a. 在相同条件下,平衡时X2的转化率逐渐降低
b. X2与H2反应的剧烈程度逐渐减弱
c. HX的还原性逐渐
d. HX的稳定性逐渐减弱
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】自然界的矿物,岩石的成因和变化收到许多条件的影响。地壳内每增加1km,压强增大约25000-30000kPa。在地壳内SiO2和HF存在一下平衡:SiO2(s) +4HF(g)  SiF4(g)+ 2H2O(g) +148.9kJ。
SiF4(g)+ 2H2O(g) +148.9kJ。
(1)写出H2O的电子式:___________ ,SiF4的结构式:____________
(2)在地壳深处容易有___________ 气体逸出,在地壳浅处容易有___________ 沉积。该反应的平衡常数表达式为:K=_______________ 。如果上述反应的平衡常数K值变大,该反应_______ (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______ (选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为______ 。
 SiF4(g)+ 2H2O(g) +148.9kJ。
SiF4(g)+ 2H2O(g) +148.9kJ。(1)写出H2O的电子式:
(2)在地壳深处容易有
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】一定温度(t℃)下,向1 L密闭容器中通入H2和 I2各0.15 mol,发生如下反应: H2(g) + I2(g)  2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
请回答:
(1)反应到第___________ 分钟达到平衡状态。
(2)2 min内,v(H2) =______________ mol/(L·min)。
(3)下列能证明该反应已经达到平衡的是________ (填字母)。
a. v正(H2)= v逆 (HI) b. 混合气体的颜色不再发生变化
c. 混合气体中各组分的物质的量不再发生变化 d. 混合气体的密度不再变化。
(4)①该反应的化学平衡常数表达式为_______________ 。②H2的平衡转化率是__________________ 。
(5)升高温度,化学平衡常数K要___________ (填“变大”或“变小”)。
(6)该温度(t℃)下,若开始通入一定量的H2和 I2,反应达到平衡时,测得c(H2)=0.4mol/L,c(I2)=0.9mol/L,则平衡时c(HI)=______________ mol/L.
 2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
请回答:
(1)反应到第
(2)2 min内,v(H2) =
(3)下列能证明该反应已经达到平衡的是
a. v正(H2)= v逆 (HI) b. 混合气体的颜色不再发生变化
c. 混合气体中各组分的物质的量不再发生变化 d. 混合气体的密度不再变化。
(4)①该反应的化学平衡常数表达式为
(5)升高温度,化学平衡常数K要
(6)该温度(t℃)下,若开始通入一定量的H2和 I2,反应达到平衡时,测得c(H2)=0.4mol/L,c(I2)=0.9mol/L,则平衡时c(HI)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】某温度下,在2L密闭容器中X、Y、Z三种物质(均为气态)间进行反应,其物质的量随时间的变化曲线如图。依图回答:

(1)该反应的化学方程式可表示为________ 。
(2)反应起始至t min(设t=5),Y的平均反应速率是________ 。
(3)反应至t min时,Z所占体积(标准状况下)________ 。
(4)在t min时,该反应达到了_____ 状态,下列可判断反应已达到该状态的是______ (填字母)。
A X、Y、Z的反应速率相等 B X、Y的反应速率比为2:3
C 混合气体的密度不变 D 生成1molZ的同时生成2molX
E X、Y、Z物质的量之比等于系数比 F 混合气体的总压强不再发生改变

(1)该反应的化学方程式可表示为
(2)反应起始至t min(设t=5),Y的平均反应速率是
(3)反应至t min时,Z所占体积(标准状况下)
(4)在t min时,该反应达到了
A X、Y、Z的反应速率相等 B X、Y的反应速率比为2:3
C 混合气体的密度不变 D 生成1molZ的同时生成2molX
E X、Y、Z物质的量之比等于系数比 F 混合气体的总压强不再发生改变
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】向一体积为2 L 的恒温恒容密闭容器中充入一定量的H2 和N2,发生反应:N2(g)+ 3H2(g)  2NH3(g) △H=a kJ•mol-1。体系中气体的物质的量随时间的变化如图所示。
2NH3(g) △H=a kJ•mol-1。体系中气体的物质的量随时间的变化如图所示。

(1)表示N2浓度变化的曲线是________ (填“A”“ B”或“C”),25 min 时,c(NH3)= ______ 。
(2)0~20 min 内,v(H2)=______ 。若该过程中反应放出的热量为47.2 kJ,则a=______ 。
(3)30 min 时,向容器中再充入一定量的NH3,一段时间后,与原化学平衡状态时的反应速率相比,正反应速率______ (填“增大”“ 减小”或“不变”,下同),逆反应速率_______________ 。
 2NH3(g) △H=a kJ•mol-1。体系中气体的物质的量随时间的变化如图所示。
2NH3(g) △H=a kJ•mol-1。体系中气体的物质的量随时间的变化如图所示。
(1)表示N2浓度变化的曲线是
(2)0~20 min 内,v(H2)=
(3)30 min 时,向容器中再充入一定量的NH3,一段时间后,与原化学平衡状态时的反应速率相比,正反应速率
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】一定温度下,将3molA气体和1molB气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______ ;x为______ 。
(2)若反应经2min达到平衡,平衡时C的浓度______ 0.8mol/(填大于,小于或等于”)
(3)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0.请用P0、P来表示达平衡时反应物A的转化率a(A)为______ %
(4)能够说明该反应达到平衡的标志是__________ 。
A .容器内混合气体的密度保持不变
B. v(A)=3v(B)
C .A、B的浓度之比为3:1
D .单位时间内消耗3n molA的同时生成n molB
E.体系的温度不再变化
 xC(g),请填写下列空白:
xC(g),请填写下列空白:(1)反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为
(2)若反应经2min达到平衡,平衡时C的浓度
(3)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0.请用P0、P来表示达平衡时反应物A的转化率a(A)为
(4)能够说明该反应达到平衡的标志是
A .容器内混合气体的密度保持不变
B. v(A)=3v(B)
C .A、B的浓度之比为3:1
D .单位时间内消耗3n molA的同时生成n molB
E.体系的温度不再变化
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】硫酸是重要的化工原料,工业制取硫酸最重要的一步反应为: 2SO2(g)+O2(g) 2SO3(g) △H<0
2SO3(g) △H<0
(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:_________ 。
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图象如下。反应条件:催化剂、一定温度、容积10 L

①实验i中SO2的转化率为________ 。
②a=________ 。
③t1、t2、t3中,达到化学平衡状态的是_______ 。
④t2到t3的变化是因为改变了一个反应条件,该条件可能是_________ 。
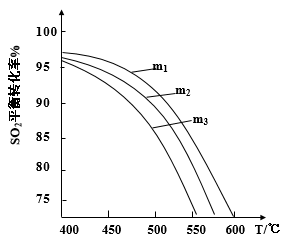
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2和O2的物质的量之比m[m=n(SO2)/n(O2)]不同时,SO2的平衡转化率与温度(T)的关系如下图所示,则m1、m2、m3的大小顺序为____________ 。
 2SO3(g) △H<0
2SO3(g) △H<0(1)为提高SO2的转化率,可通入过量O2,用平衡移动原理解释其原因:
(2)某兴趣小组在实验室对该反应进行研究,部分实验数据和图象如下。反应条件:催化剂、一定温度、容积10 L

| 实验 | 起始物质的量/mol | 平衡时SO3物质的量/mol | ||
| SO2 | O2 | SO3 | ||
| i | 0.2 | 0.1 | 0 | 0.14 |
| ii | 0 | 0 | 0.2 | a |
①实验i中SO2的转化率为
②a=
③t1、t2、t3中,达到化学平衡状态的是
④t2到t3的变化是因为改变了一个反应条件,该条件可能是
(3)将SO2和O2充入恒压密闭容器中,原料气中SO2和O2的物质的量之比m[m=n(SO2)/n(O2)]不同时,SO2的平衡转化率与温度(T)的关系如下图所示,则m1、m2、m3的大小顺序为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】向体积为2 L的固定密闭容器中通入2mol X气体,在一定温度下发生如下反应:2X(g)  Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。
Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。
(1)用Y表示的化学反应速率为_____ ,X的转化率为______ ,平衡时反应吸收的热量为_________ 。
(2)在定温,定容的条件下向平衡体系中再充入1mol X(g)气体,平衡______ (填“正向”“不”“逆向”)移动, X(g)的转化率______ (填“增大”“减小”“不变”),Y(g)的质量分数______ (填“增大”“减小”“不变”)。
(3)在相同温度,相同容积的密闭容器中起始时充入0.8molX(g),0.6molY(g),1.8molZ(g),此时V正______ V逆(填“大于”、“小于”或“等于”);平衡时X(g)的百分含量______ (填“大于”、“小于”或“等于”)原平衡。
 Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。
Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。(1)用Y表示的化学反应速率为
(2)在定温,定容的条件下向平衡体系中再充入1mol X(g)气体,平衡
(3)在相同温度,相同容积的密闭容器中起始时充入0.8molX(g),0.6molY(g),1.8molZ(g),此时V正
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)在一定温度下,将2molA和2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g) xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
①x值等于_________
②A的转化率为__________
③生成D的反应速率为________
④如增大反应体系的压强,则平衡体系中C的质量分数_____ (填增大,减小,不变)
(2)已知某可逆反应mA(g)+nB(g) qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空

①化学计量数的关系:m+n______ q;(填“>”.“<”或“=”)
②该反应的正反应为_________ 反应。(填“吸热”或“放热”
 xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:①x值等于
②A的转化率为
③生成D的反应速率为
④如增大反应体系的压强,则平衡体系中C的质量分数
(2)已知某可逆反应mA(g)+nB(g)
 qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
①化学计量数的关系:m+n
②该反应的正反应为
您最近一年使用:0次
【推荐3】在一定温度下,将2molA和2molB两种气体相混合于体积为2L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g)+2D(g),ΔH<0,2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白:
xC(g)+2D(g),ΔH<0,2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白:
(1)x的值等于__ 。
(2)该反应的化学平衡常数K=__ ,升高温度时K值将__ (选填“增大”、“减小”或“不变”)。
(3)A物质的转化率为__ 。
(4)若维持温度不变,在原平衡混合物的容器中再充入3molC和3molD,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为__ mol。
 xC(g)+2D(g),ΔH<0,2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白:
xC(g)+2D(g),ΔH<0,2min末反应达到平衡状态(温度不变),生成了0.8molD,并测得C的浓度为0.4mol·L-1,请填写下列空白:(1)x的值等于
(2)该反应的化学平衡常数K=
(3)A物质的转化率为
(4)若维持温度不变,在原平衡混合物的容器中再充入3molC和3molD,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B的物质的量为
您最近一年使用:0次



