稀土元素是指元素周期表中原子序数为57到71的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17种元素。稀土元素有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,基态原子电子排布式为____ 。
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有__ 。
(3)Sm(钐)的单质与l,2-二碘乙烷可生成乙烯:Sm + ICH2CH2I →SmI2+ CH2=CH2。
则lmol CH2=CH2中含有的σ键数目为___ 。(用NA表示阿伏加 德罗常数的值)
(4)与N3-互为等电子体的分子有___ (写其中一个的化学式即可)。
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。Ce(铈)原子的配位数为___ ,列式表示Ce(铈)单质的密度:___ g/cm3(用NA表示阿伏加 德罗常数的值,不必计算出结果)

(1)钪(Sc)为21号元素,基态原子电子排布式为
(2)离子化合物Na3[Sc(OH)6]中,存在的化学键除离子键外还有
(3)Sm(钐)的单质与l,2-二碘乙烷可生成乙烯:Sm + ICH2CH2I →SmI2+ CH2=CH2。
则lmol CH2=CH2中含有的σ键数目为
(4)与N3-互为等电子体的分子有
(5)Ce(铈)单质为面心立方晶体,其晶胞参数a=516pm。Ce(铈)原子的配位数为

更新时间:2019-09-18 12:25:18
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
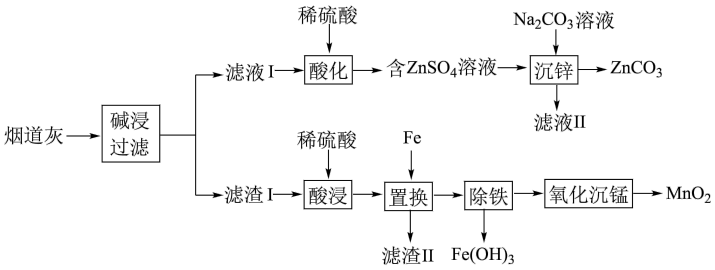
【推荐1】某炼铜厂烟道灰的主要成分为锌、锰、铁、铜的单质及氧化物,一种回收利用烟道灰的工艺流程如图所示:
②离子浓度小于等于10-5mol/L时认为沉淀完全;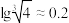 。
。
回答下列问题:
(1)“碱浸”时,Zn被浸出转化为Na2Zn(OH)4,Na2Zn(OH)4中Zn元素的化合价为_______ 。
(2)“沉锌”时防止碱性过强生成Zn(OH)2,可采取的措施为_______ (任写一条)。
(3)滤渣II的主要成分为_______ (填化学式)。
(4)“除铁”时先加入过量的H2O2溶液将Fe2+氧化为Fe3+,发生反应的离子方程式为_______ ;然后再调节溶液的pH为b,若此时c(Mn2+)=0.2 mol/L,则b的取值范围为_______ 。
(5)“氧化沉锰”过程中,MnSO4经O2氧化转化为MnO2,该反应中氧化剂和还原剂的物质的量之比为_______ ;基态锰原子的价层电子排布式为_______ 。
②离子浓度小于等于10-5mol/L时认为沉淀完全;
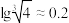 。
。回答下列问题:
(1)“碱浸”时,Zn被浸出转化为Na2Zn(OH)4,Na2Zn(OH)4中Zn元素的化合价为
(2)“沉锌”时防止碱性过强生成Zn(OH)2,可采取的措施为
(3)滤渣II的主要成分为
(4)“除铁”时先加入过量的H2O2溶液将Fe2+氧化为Fe3+,发生反应的离子方程式为
(5)“氧化沉锰”过程中,MnSO4经O2氧化转化为MnO2,该反应中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)Fe2+的最外层电子排布式__ ;基态铜原子的电子排布式为__ 。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-配离子,则钛元素的化合价是__ ,配体是__ 。
(3)TiCl3可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应: ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有__ ;反应中涉及的元素中电负性最大的是__ 。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__ 。
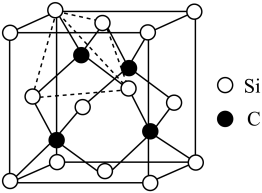
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为__ ,在SiC中,每个C原子周围最近的C原子数目为__ ,若晶胞的边长为apm,则金刚砂的密度为__ 。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-配离子,则钛元素的化合价是
(3)TiCl3可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:
 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为

您最近一年使用:0次
【推荐3】回答下列问题
(1)F2通入稀NaOH溶液中可生成OF2,OF2空间结构为___________ ,电负性O___________ F;其中氧原子的杂化方式为___________ 。
(2)X、Y、Z为短周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等。 空间结构是
空间结构是___________ ;X与Z形成化合物中含有的化学键是___________ 。
(3) 的空间结构为
的空间结构为___________ 。(用文字描述,下同): 的空间结构是
的空间结构是___________ 。
(4)在BF3分子中: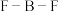 的键角是
的键角是___________ ,B原子的杂化轨道类型为___________ ,BF3和过量NaF作用可生成NaBF4, 的空间结构为
的空间结构为___________ 。
(5)钠在火焰上灼烧产生的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
(6)已知(CN)2是直线形分子,且有对称性,则(CN)2分子的结构式为___________ ;其中π键与σ键的个数比为___________ 。
(7)基态S原子价电子排布式___________ ;S原子的核外电子运动状态有___________ 种,空间运动状态有___________ 种:能量最高的轨道的电子云的形状是___________ 。
(1)F2通入稀NaOH溶液中可生成OF2,OF2空间结构为
(2)X、Y、Z为短周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等。
 空间结构是
空间结构是(3)
 的空间结构为
的空间结构为 的空间结构是
的空间结构是(4)在BF3分子中:
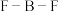 的键角是
的键角是 的空间结构为
的空间结构为(5)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(6)已知(CN)2是直线形分子,且有对称性,则(CN)2分子的结构式为
(7)基态S原子价电子排布式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为_______ 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是_______ (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点________ (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是__________ 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为__________ 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为________ 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为______ 。

(1)F原子基态的外围核外电子排布式为
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是
(3)元素B的简单气态氢化物的沸点
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】(1)福州大学王新晨教授以氨基氰(CH2N2)为原料制得类石墨相氮化碳(g-C3N4),其单层结构如图1。
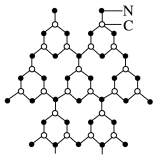
图1
①氨基氰CH2N2)分子中C、N 原子均满足8电子稳定结构,则该分子的结构式为______ ;该分子为______ (填“极性”或“非极性”)分子。
②氨基氰易溶于水或乙醇,其主要原因是_____________ 。
③关于g- C3N4的叙述正确的是_________ 。
A.电负性:C>N B.该物质的熔点比石墨更高
C.该物质属于原子晶体 D.该物质中C和N原子均采取SP2杂化
(2)NH3与Zn2+可形成[Zn(NH3)6]2+离子,部分结构如图2。
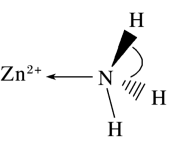
图2
①NH3的空间构型为_________ 。
②[Zn(NH3)6]2+离子中存在的化学键类型有______ ;NH3分子中H-N-H键角为107.3°,判断[Zn(NH3)6]2+离子中H-N-H 键角______ 107.3°( 填">”、"<”或“=”)。
③肼(N2H4)可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。与N2H4互为等电子体的分子有_______ 。(写一种)
(3)N元素形成的简单离子N3-与Xn+形成的晶体的是立方体结构,边长为anm,如图3所示。

①Xn+中所有的电子恰好充满K、L、M 三个电子层,则基态X原子的价电子的轨道表示式为________ 。
②已知该晶体的密度为5.84g·cm-3,则阿伏伽德罗常数NA的计算表示式为_____ (含a)。

图1
①氨基氰CH2N2)分子中C、N 原子均满足8电子稳定结构,则该分子的结构式为
②氨基氰易溶于水或乙醇,其主要原因是
③关于g- C3N4的叙述正确的是
A.电负性:C>N B.该物质的熔点比石墨更高
C.该物质属于原子晶体 D.该物质中C和N原子均采取SP2杂化
(2)NH3与Zn2+可形成[Zn(NH3)6]2+离子,部分结构如图2。

图2
①NH3的空间构型为
②[Zn(NH3)6]2+离子中存在的化学键类型有
③肼(N2H4)可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。与N2H4互为等电子体的分子有
(3)N元素形成的简单离子N3-与Xn+形成的晶体的是立方体结构,边长为anm,如图3所示。

①Xn+中所有的电子恰好充满K、L、M 三个电子层,则基态X原子的价电子的轨道表示式为
②已知该晶体的密度为5.84g·cm-3,则阿伏伽德罗常数NA的计算表示式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】2016 年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB 族元素对应离子的萃取,如La3+、Sc2+。写出基态二价 钪离子(Sc2+)的核外电子排布式:____ ,其中电子占据的轨道数为_____ 个。
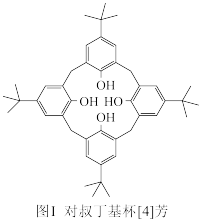
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为_____ ,羟基间的相互作用力为_____ 。
(3)不同大小苯芳烃能识别某些离子,如:N3-、SCN−等。一定条件下,SCN−与 MnO2反应可得到(SCN)2,试写出(SCN)2的结构式_______ 。
(4)NH3分子在独立存在时 H-N-H 键角为 106.7°。 [Zn(NH3)6]2+离子中 H-N-H 键角变为 109.5°,其原因是:_________________________ 。
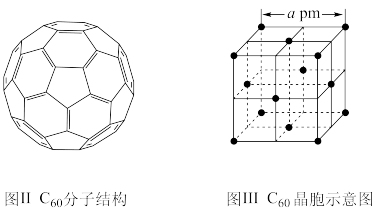
(5)已知 C60 分子结构和 C60 晶胞示意图(如图Ⅱ、图Ⅲ所示):则一个 C60 分子中含有σ键的个数为______ ,C60 晶体密度的计算式为____ g•cm−3。(NA 为阿伏加 德罗常数 的值)
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB 族元素对应离子的萃取,如La3+、Sc2+。写出基态二价 钪离子(Sc2+)的核外电子排布式:

(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为
(3)不同大小苯芳烃能识别某些离子,如:N3-、SCN−等。一定条件下,SCN−与 MnO2反应可得到(SCN)2,试写出(SCN)2的结构式
(4)NH3分子在独立存在时 H-N-H 键角为 106.7°。 [Zn(NH3)6]2+离子中 H-N-H 键角变为 109.5°,其原因是:
(5)已知 C60 分子结构和 C60 晶胞示意图(如图Ⅱ、图Ⅲ所示):则一个 C60 分子中含有σ键的个数为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】铟(In)是制备酞菁铟、磷化铟等半导体的重要基础材料,广泛应用于军工、航天航空、平面显示、光电信息、太阳能电池等领域。从铅锌冶炼烟灰(主要含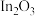 、
、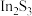 、ZnO、PbO、
、ZnO、PbO、 )中提取金属铟的流程如图:
)中提取金属铟的流程如图: 的形式存在。“萃取”过程中的萃取剂可用
的形式存在。“萃取”过程中的萃取剂可用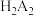 表示,其在酸性溶液中可萃取三价金属离子。
表示,其在酸性溶液中可萃取三价金属离子。
回答下列问题:
(1)“氧化酸浸”过程中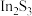 的硫元素被氧化为
的硫元素被氧化为 ,则氧化剂与还原剂的物质的量之比为
,则氧化剂与还原剂的物质的量之比为___________ ,滤渣除含过量 外,还有
外,还有___________ (填化学式)。
(2)一个配体中有两个配位原子的配体叫双齿配体, 就是一种双齿配体。“净化”时加入
就是一种双齿配体。“净化”时加入 的主要作用是络合
的主要作用是络合 ,
, 的配位数是6,则“净化”时的离子方程式是
的配位数是6,则“净化”时的离子方程式是___________ 。
(3)萃取过程的反应方程式为: ,平衡常数为K。一定温度下萃取率(E%)与
,平衡常数为K。一定温度下萃取率(E%)与 的关系如下:
的关系如下: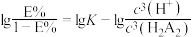 。当pH=2.30时,萃取率为50%;若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%;若将萃取率提升到95%,应调节溶液的pH=___________ [已知 。忽略萃取剂浓度
。忽略萃取剂浓度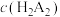 在萃取过程中随pH的变化。结果保留小数点后两位]。
在萃取过程中随pH的变化。结果保留小数点后两位]。
(4)锌可以从___________ 中进行回收(填字母)。
a.滤渣 b.水相 c.有机相 d.滤液
(5)酞菁铟是有机分子酞菁与铟原子形成的复杂分子,结构简式如图所示,该分子中不存在的化学键为___________ (填字母)。
(6)磷化铟的晶胞结构如图所示,晶胞参数为a nm,In的配位数为___________ ;与In原子间距离为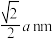 的In原子有
的In原子有___________ 个。
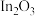 、
、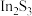 、ZnO、PbO、
、ZnO、PbO、 )中提取金属铟的流程如图:
)中提取金属铟的流程如图: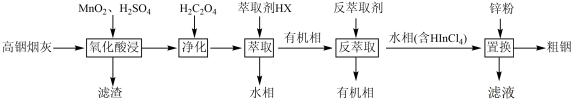
 的形式存在。“萃取”过程中的萃取剂可用
的形式存在。“萃取”过程中的萃取剂可用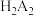 表示,其在酸性溶液中可萃取三价金属离子。
表示,其在酸性溶液中可萃取三价金属离子。回答下列问题:
(1)“氧化酸浸”过程中
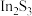 的硫元素被氧化为
的硫元素被氧化为 ,则氧化剂与还原剂的物质的量之比为
,则氧化剂与还原剂的物质的量之比为 外,还有
外,还有(2)一个配体中有两个配位原子的配体叫双齿配体,
 就是一种双齿配体。“净化”时加入
就是一种双齿配体。“净化”时加入 的主要作用是络合
的主要作用是络合 ,
, 的配位数是6,则“净化”时的离子方程式是
的配位数是6,则“净化”时的离子方程式是(3)萃取过程的反应方程式为:
 ,平衡常数为K。一定温度下萃取率(E%)与
,平衡常数为K。一定温度下萃取率(E%)与 的关系如下:
的关系如下: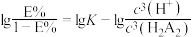 。当pH=2.30时,萃取率为50%;若将萃取率提升到95%,应调节溶液的pH=
。当pH=2.30时,萃取率为50%;若将萃取率提升到95%,应调节溶液的pH= 。忽略萃取剂浓度
。忽略萃取剂浓度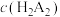 在萃取过程中随pH的变化。结果保留小数点后两位]。
在萃取过程中随pH的变化。结果保留小数点后两位]。(4)锌可以从
a.滤渣 b.水相 c.有机相 d.滤液
(5)酞菁铟是有机分子酞菁与铟原子形成的复杂分子,结构简式如图所示,该分子中不存在的化学键为

(6)磷化铟的晶胞结构如图所示,晶胞参数为a nm,In的配位数为
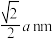 的In原子有
的In原子有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】过渡元素的配合物在物质制备、尖端技术、医药科学、催化反应、材料化学等领域有着广泛的应用。回答下列问题:
Ⅰ. 和
和 都能与
都能与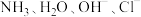 等形成配合物。
等形成配合物。
(1)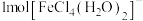 离子中含
离子中含 键的数目为
键的数目为_______ 。
(2) 中存在的化学键类型有
中存在的化学键类型有_______ (填标号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键 E.配位键
Ⅱ.三氯化六氨合钴(Ⅲ) 是一种重要的含钴配合物,由CoCl2在活性炭做催化剂的条件下制备它的流程如下:
是一种重要的含钴配合物,由CoCl2在活性炭做催化剂的条件下制备它的流程如下:
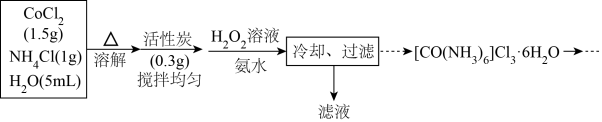
已知: 在水溶液中不易被氧化,
在水溶液中不易被氧化, 具有较强还原性。
具有较强还原性。
回答下列问题:
(3)制备装置如图,仪器M的名称是_______ ,向混合液加入H2O2溶液与氨水时,应最先打开活塞_______ (填字母代号“b”或“d”);加入所有试剂后,水浴的温度控制在55℃左右,反应约30分钟,温度不宜过高的原因是_______ ;干燥管中试剂为_______ 。
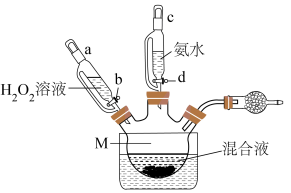
(4)CoCl2制备 的总反应化学方程式为
的总反应化学方程式为_______ 。
(5)称取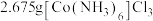 样品,加入盛有足量氢氧化钠溶液的烧瓶中并加热,发生反应:
样品,加入盛有足量氢氧化钠溶液的烧瓶中并加热,发生反应: ,生成的氨气恰好被
,生成的氨气恰好被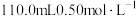 的盐酸吸收,则样品纯度的为
的盐酸吸收,则样品纯度的为_______ 。(保留小数点后一位有效数字)
Ⅰ.
 和
和 都能与
都能与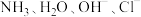 等形成配合物。
等形成配合物。(1)
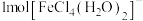 离子中含
离子中含 键的数目为
键的数目为(2)
 中存在的化学键类型有
中存在的化学键类型有A.离子键 B.金属键 C.极性共价键 D.非极性共价键 E.配位键
Ⅱ.三氯化六氨合钴(Ⅲ)
 是一种重要的含钴配合物,由CoCl2在活性炭做催化剂的条件下制备它的流程如下:
是一种重要的含钴配合物,由CoCl2在活性炭做催化剂的条件下制备它的流程如下:
已知:
 在水溶液中不易被氧化,
在水溶液中不易被氧化, 具有较强还原性。
具有较强还原性。回答下列问题:
(3)制备装置如图,仪器M的名称是

(4)CoCl2制备
 的总反应化学方程式为
的总反应化学方程式为(5)称取
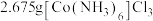 样品,加入盛有足量氢氧化钠溶液的烧瓶中并加热,发生反应:
样品,加入盛有足量氢氧化钠溶液的烧瓶中并加热,发生反应: ,生成的氨气恰好被
,生成的氨气恰好被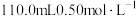 的盐酸吸收,则样品纯度的为
的盐酸吸收,则样品纯度的为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】X、Y、Z、M、G为前四周期元素,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX,1 mol ZX含有的电子总数为12NA;Y、M同主族,可形成MY2、MY3两种分子;G的核电荷数为29。请回答下列问题:
(1)G原子基态时的核外电子排布式为_______ ,ZX的电子式为________ 。
(2)X2M的燃烧热ΔH=-a kJ·mol-1,写出X2M燃烧热的热化学反应方程式:________ 。
(3)向G的硫酸盐溶液中逐滴加入氨水,产生的现象为_______ ,写出该反应加入氨水至过量的离子方程式为________ ,然后加入乙醇,现象为_______ ,加入乙醇的作用为________ 。
(1)G原子基态时的核外电子排布式为
(2)X2M的燃烧热ΔH=-a kJ·mol-1,写出X2M燃烧热的热化学反应方程式:
(3)向G的硫酸盐溶液中逐滴加入氨水,产生的现象为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表中,回答下列问题:
(1)Mn 元素价电子层的电子排布式为___________ ,比较两元素的 I2、I3可知,气态 Mn2+再失去一个电子比气态 Fe2+再失去一个电子难。对此,你的解释是___________ 。
(2)Fe 原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。与 Fe原子或离子形成配合物的分子或离子应具备的结构特征是___________ 。
(3)六氰合亚铁离子中的配体 CN-中 C 原子的杂化轨道类型是___________ 。
(4)三氯化铁常温下为固体,熔点 282 ℃,沸点 315 ℃,在 300 ℃以上易升华。易溶于水, 也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为___________ 。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的 Fe 原子个数之比为___________ 。

| 元素 | Mn | Fe | |
| 电离能/ kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
(2)Fe 原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。与 Fe原子或离子形成配合物的分子或离子应具备的结构特征是
(3)六氰合亚铁离子中的配体 CN-中 C 原子的杂化轨道类型是
(4)三氯化铁常温下为固体,熔点 282 ℃,沸点 315 ℃,在 300 ℃以上易升华。易溶于水, 也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的 Fe 原子个数之比为

您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,以A为原料的有机合成路线如下:

已知: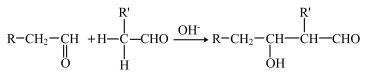
(1)D的核磁共振氢谱中有_______ 组峰,E中官能团名称_______ ,F的结构简式为_______ 。
(2)B→C的化学反应方程式为_______ 。
(3)F→G的反应类型为_______ 。
(4)H→I的化学反应方程式为_______ 。
Ⅱ.碳元素不仅可以形成大量的有机物,也可以形成无机物,例如金刚石。氮化硼晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被B原子代替。根据所学知识回答以下问题。
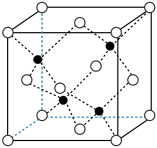
(5)BN晶体其晶胞参数为a pm,与同一个B原子相连的N原子构成的空间结构为_______ ,相邻的N与B之间的最近距离为_______ pm。BN的摩尔质量为M g·mol-1,阿伏加德罗常数的值为 ,则BN晶体的密度为
,则BN晶体的密度为_______ g·cm-3。
(6)晶体中距离同一个B原子最近的其他B原子个数为_______ 。
(7)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,1原子的分数坐标为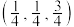 ,则4原子的分数坐标是
,则4原子的分数坐标是_______ 。


已知:

(1)D的核磁共振氢谱中有
(2)B→C的化学反应方程式为
(3)F→G的反应类型为
(4)H→I的化学反应方程式为
Ⅱ.碳元素不仅可以形成大量的有机物,也可以形成无机物,例如金刚石。氮化硼晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被B原子代替。根据所学知识回答以下问题。

(5)BN晶体其晶胞参数为a pm,与同一个B原子相连的N原子构成的空间结构为
 ,则BN晶体的密度为
,则BN晶体的密度为(6)晶体中距离同一个B原子最近的其他B原子个数为
(7)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,1原子的分数坐标为
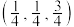 ,则4原子的分数坐标是
,则4原子的分数坐标是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为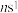 ;B元素的原子价电子排布式为
;B元素的原子价电子排布式为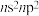 ;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素的原子有5个未成对电子。
;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素的原子有5个未成对电子。
(1)C基态原子的轨道表示式为_______ 。
(2)若A元素的原子最外层电子排布式为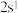 ,B元素的原子价电子排布式为
,B元素的原子价电子排布式为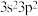 ,A、B、C、D四种元素的第一电离能由大到小的顺序是
,A、B、C、D四种元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(3)E元素的原子结构示意图是_______ ,在元素周期表中的位置是_______ 。
(4)①当 时,用电子式表示B的最简单气态氢化物的形成过程
时,用电子式表示B的最简单气态氢化物的形成过程_______ ;BC2分子的结构式是_______ 。
②当 时,B与C形成的化合物为
时,B与C形成的化合物为_______ 晶体(填“分子,共价,离子,金属”),其与氢氧化钠溶液反应的离子方程式是_______ 。它的晶胞结构如图,晶胞参数为 ,则密度为
,则密度为_______  (列出计算式)。
(列出计算式)。

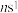 ;B元素的原子价电子排布式为
;B元素的原子价电子排布式为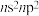 ;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素的原子有5个未成对电子。
;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素的原子有5个未成对电子。(1)C基态原子的轨道表示式为
(2)若A元素的原子最外层电子排布式为
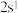 ,B元素的原子价电子排布式为
,B元素的原子价电子排布式为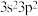 ,A、B、C、D四种元素的第一电离能由大到小的顺序是
,A、B、C、D四种元素的第一电离能由大到小的顺序是(3)E元素的原子结构示意图是
(4)①当
 时,用电子式表示B的最简单气态氢化物的形成过程
时,用电子式表示B的最简单气态氢化物的形成过程②当
 时,B与C形成的化合物为
时,B与C形成的化合物为 ,则密度为
,则密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次



