农业对化肥的需求是合成氨工业发展的持久推动力。在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
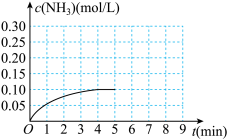
(1)N2(g)+3H2(g) 2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图象,计算从反应开始到平衡时,氮气的平均反应速率为
2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图象,计算从反应开始到平衡时,氮气的平均反应速率为___________________ 。
(2)该温度下,反应N2(g)+3H2(g) 2NH3(g)+ Q(Q>0)的平衡常数表达式为
2NH3(g)+ Q(Q>0)的平衡常数表达式为__________ 。
其平衡常数K与温度T的关系如下表:
试判断K1______ K2(填写“>”“=”或“<”)。原因是_________________________________
(3)下列能说明合成氨反应已达到平衡状态的是________ (填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2) b.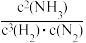 不发生变化 c.混合气体的密度保持不变
不发生变化 c.混合气体的密度保持不变
d.25℃时,测得容器中 c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
(4) 催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式并标出电子转移的方向和数目:____________ ;该反应中氧化产物与还原产物的物质的量之比为____ 。
(5) pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________ n(填“>”、“<”或“=”)

(1)N2(g)+3H2(g)
 2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图象,计算从反应开始到平衡时,氮气的平均反应速率为
2NH3(g),反应中NH3的物质的量浓度的变化情况如右图,根据图象,计算从反应开始到平衡时,氮气的平均反应速率为(2)该温度下,反应N2(g)+3H2(g)
 2NH3(g)+ Q(Q>0)的平衡常数表达式为
2NH3(g)+ Q(Q>0)的平衡常数表达式为其平衡常数K与温度T的关系如下表:
| T/℃ | 25 | 125 | 225 |
| 平衡常数K | 4×106 | K1 | K2 |
试判断K1
(3)下列能说明合成氨反应已达到平衡状态的是
a.3v(N2) = v(H2) b.
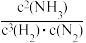 不发生变化 c.混合气体的密度保持不变
不发生变化 c.混合气体的密度保持不变d.25℃时,测得容器中 c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
(4) 催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式并标出电子转移的方向和数目:
(5) pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m
更新时间:2019-10-24 10:48:46
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域.实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
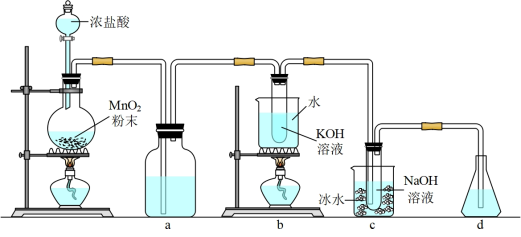
回答下列问题:
(1)a中的试剂为___ 。
(2)b中采用的加热方式是___ ,c中化学反应的离子方程式是___ ,采用冰水浴冷却的目的是___ 。
(3)反应结束后,取出b中试管,经冷却结晶,___ ,___ ,干燥,得到KClO3晶体。
(4)高铁酸钠(Na2FeO4)(其中氧元素是-2价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O。
①用双线桥法在化学方程式中标出电子转移的情况:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O。___
②当反应中有5个FeO 生成时,转移的电子数是
生成时,转移的电子数是___ 个。

回答下列问题:
(1)a中的试剂为
(2)b中采用的加热方式是
(3)反应结束后,取出b中试管,经冷却结晶,
(4)高铁酸钠(Na2FeO4)(其中氧元素是-2价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O。
①用双线桥法在化学方程式中标出电子转移的情况:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O。
②当反应中有5个FeO
 生成时,转移的电子数是
生成时,转移的电子数是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】化学与生产生活密切相关,利用所学化学知识回答下列问题。
(1)雷雨天闪电时空气中有 生成。
生成。 与
与 的关系是互为
的关系是互为_______ ,等质量的 和
和 的分子数之比为
的分子数之比为_______ 。
(2)高温下 粉与
粉与 发生置换反应生成
发生置换反应生成 ,该反应能用来焊接钢轨,其中被还原的物质是
,该反应能用来焊接钢轨,其中被还原的物质是_______ (填化学式)。 溶液可检验反应后的固体中是否有
溶液可检验反应后的固体中是否有 残留,用离子方程式说明其原理
残留,用离子方程式说明其原理_______ 。
(3)阅读下列科普短文并填空。
地表的天然水中含有很多杂质,为满足人们生产生活的需要,必须对其进行处理。利用混凝剂 可除去天然水中的县浮物。
可除去天然水中的县浮物。 在水中发生电离,产生的
在水中发生电离,产生的 与水反应生成
与水反应生成 胶体,可以吸附悬浮物与色素。为获得饮用水,还需对天然水消毒杀菌。过去广泛采用氯水作水体的消毒剂,近年来
胶体,可以吸附悬浮物与色素。为获得饮用水,还需对天然水消毒杀菌。过去广泛采用氯水作水体的消毒剂,近年来 和
和 备受关注。
备受关注。 溶于水能释放大量的原子氧,从而有效杀灭水中的病菌,同时生成具有良好吸附性的
溶于水能释放大量的原子氧,从而有效杀灭水中的病菌,同时生成具有良好吸附性的 胶体,所以
胶体,所以 具有广阔的应用前景。
具有广阔的应用前景。
①可利用_______ 证明 溶于水后得到
溶于水后得到 胶体。
胶体。
②利用数字化实验对光照过程中新制氯水的变化进行检测,下图能表示氯水的 随时间变化的图像是
随时间变化的图像是_______ (填字母),用化学方程式说明这一变化的原因_______ 。

(4)配平 溶于水后发生反应的离子方程式:
溶于水后发生反应的离子方程式:_______ 。
_______ ______
______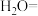 ______
______ _______
_______ 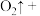 _______
_______ 。
。
每转移电子 ,生成标准状况下
,生成标准状况下 的体积为
的体积为_______ 。
(1)雷雨天闪电时空气中有
 生成。
生成。 与
与 的关系是互为
的关系是互为 和
和 的分子数之比为
的分子数之比为(2)高温下
 粉与
粉与 发生置换反应生成
发生置换反应生成 ,该反应能用来焊接钢轨,其中被还原的物质是
,该反应能用来焊接钢轨,其中被还原的物质是 溶液可检验反应后的固体中是否有
溶液可检验反应后的固体中是否有 残留,用离子方程式说明其原理
残留,用离子方程式说明其原理(3)阅读下列科普短文并填空。
地表的天然水中含有很多杂质,为满足人们生产生活的需要,必须对其进行处理。利用混凝剂
 可除去天然水中的县浮物。
可除去天然水中的县浮物。 在水中发生电离,产生的
在水中发生电离,产生的 与水反应生成
与水反应生成 胶体,可以吸附悬浮物与色素。为获得饮用水,还需对天然水消毒杀菌。过去广泛采用氯水作水体的消毒剂,近年来
胶体,可以吸附悬浮物与色素。为获得饮用水,还需对天然水消毒杀菌。过去广泛采用氯水作水体的消毒剂,近年来 和
和 备受关注。
备受关注。 溶于水能释放大量的原子氧,从而有效杀灭水中的病菌,同时生成具有良好吸附性的
溶于水能释放大量的原子氧,从而有效杀灭水中的病菌,同时生成具有良好吸附性的 胶体,所以
胶体,所以 具有广阔的应用前景。
具有广阔的应用前景。①可利用
 溶于水后得到
溶于水后得到 胶体。
胶体。②利用数字化实验对光照过程中新制氯水的变化进行检测,下图能表示氯水的
 随时间变化的图像是
随时间变化的图像是
(4)配平
 溶于水后发生反应的离子方程式:
溶于水后发生反应的离子方程式:_______
 ______
______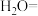 ______
______ _______
_______ 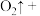 _______
_______ 。
。每转移电子
 ,生成标准状况下
,生成标准状况下 的体积为
的体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硫酸铜可用作家禽养殖饲料的添加剂。一种以含砷氧化铜矿[含CuO、Cu(OH)2·CuCO3、砷的化合物及铅的化合物]为原料制备饲料级硫酸铜的工艺流程如图所示。回答下列问题:
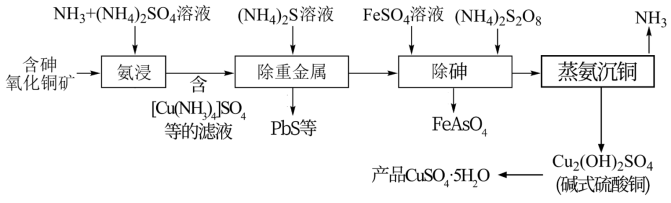
(1)“氨浸”时控制温度为45℃,液固比为1:4,c(NH3)+c( )=1mol·L-1且c(NH3)=c(
)=1mol·L-1且c(NH3)=c( )。
)。
①温度不宜超过55℃,这是因为___ 。
②“氨浸”时,Cu(OH)2·CuCO3转化为[Cu(NH3)4]SO4和NH4HCO3的化学方程式为___ 。
③溶液中Cu2+、[Cu(NH3)n]2+(n=1~4)的物质的量分数δ(x)与lgc(NH3)的关系如图所示。

lgc(NH3)=-3时,浓度最大的含铜微粒是___ ,lgc(NH3)由-1→0时,发生反应的离子方程式为___ 。
(2)“除砷”时控制pH=9, 最终转化为FeAsO4沉淀,
最终转化为FeAsO4沉淀,  中As的化合价为
中As的化合价为___ ,该转化过程中每生成1molFeAsO4,转移___ mol电子。
(3)“蒸氨沉铜”的尾气可返回____ 工序循环使用,由碱式硫酸铜制取产品硫酸铜晶体的方法:将碱式硫酸铜先溶于硫酸,再___ 、过滤、洗涤、干燥。

(1)“氨浸”时控制温度为45℃,液固比为1:4,c(NH3)+c(
 )=1mol·L-1且c(NH3)=c(
)=1mol·L-1且c(NH3)=c( )。
)。①温度不宜超过55℃,这是因为
②“氨浸”时,Cu(OH)2·CuCO3转化为[Cu(NH3)4]SO4和NH4HCO3的化学方程式为
③溶液中Cu2+、[Cu(NH3)n]2+(n=1~4)的物质的量分数δ(x)与lgc(NH3)的关系如图所示。

lgc(NH3)=-3时,浓度最大的含铜微粒是
(2)“除砷”时控制pH=9,
 最终转化为FeAsO4沉淀,
最终转化为FeAsO4沉淀,  中As的化合价为
中As的化合价为(3)“蒸氨沉铜”的尾气可返回
您最近一年使用:0次
【推荐1】研究化学反应中的能量和速率变化对生产、生活有着重要意义。
I.某些常见化学键的键能(将 气体分子AB断裂为中性气态原子A和B所需的能量或A和B合成1molAB气体所放出的能量)数据如下表:
气体分子AB断裂为中性气态原子A和B所需的能量或A和B合成1molAB气体所放出的能量)数据如下表:
(1) 完全燃烧生成
完全燃烧生成 和气态水放出的能量为
和气态水放出的能量为___________ kJ。该反应中反应物的总能量___________ (填“>”、“<”或“=”)生成物的总能量。
II.实验室模拟热气循环法合成尿素, 与
与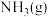 在一定条件下发生反应:
在一定条件下发生反应: 。
。
为了验证反应温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
(2)控制变量是科学研究的重要方法,因此表中数据:
________ ,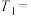
________ 。
(3)对比实验①③,目的是验证___________ (填“反应温度”或“催化剂的比表面积”)对化学反应速率的影响规律。
(4)一定温度下,向1L密闭容器中充入 和
和 发生反应:
发生反应: ,若起始压强为
,若起始压强为 ,反应2min后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则0~2min内,
,反应2min后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则0~2min内,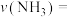
___________  ,
, 的平衡转化率为
的平衡转化率为___________ %。
(5)下列情况中,一定能说明上述反应达到平衡的是___________(填标号)。
(6)“碳呼吸电池”是一种新型化学电源,其工作原理如图。当得到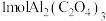 时,电路中转移的电子的物质的量为
时,电路中转移的电子的物质的量为___________ mol。

I.某些常见化学键的键能(将
 气体分子AB断裂为中性气态原子A和B所需的能量或A和B合成1molAB气体所放出的能量)数据如下表:
气体分子AB断裂为中性气态原子A和B所需的能量或A和B合成1molAB气体所放出的能量)数据如下表:| 化学键 |  |  |  |  |
键能/( ) ) | 414 | 803 | 463 | 498 |
(1)
 完全燃烧生成
完全燃烧生成 和气态水放出的能量为
和气态水放出的能量为II.实验室模拟热气循环法合成尿素,
 与
与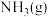 在一定条件下发生反应:
在一定条件下发生反应: 。
。为了验证反应温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
| 实验编号 | 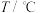 |  初始浓度/( 初始浓度/( ) ) |  初始浓度/( 初始浓度/( ) ) | 催化剂的比表面积/(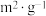 ) ) |
| ① | 280 | 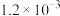 | 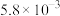 | 82 |
| ② |  | 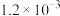 | 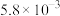 | 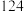 |
| ③ | 350 | a | 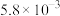 | 82 |
(2)控制变量是科学研究的重要方法,因此表中数据:

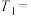
(3)对比实验①③,目的是验证
(4)一定温度下,向1L密闭容器中充入
 和
和 发生反应:
发生反应: ,若起始压强为
,若起始压强为 ,反应2min后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则0~2min内,
,反应2min后该反应达到化学平衡状态,平衡时的压强是起始时的0.8倍,则0~2min内,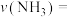
 ,
, 的平衡转化率为
的平衡转化率为(5)下列情况中,一定能说明上述反应达到平衡的是___________(填标号)。
A. 的体积分数保持不变 的体积分数保持不变 |
| B.反应体系中气体的密度保持不变 |
C.反应消耗 ,同时生成 ,同时生成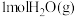 |
D. 的质量保持不变 的质量保持不变 |
(6)“碳呼吸电池”是一种新型化学电源,其工作原理如图。当得到
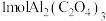 时,电路中转移的电子的物质的量为
时,电路中转移的电子的物质的量为
您最近一年使用:0次
【推荐2】CO是一种重要化工原料,也是一种燃料.工业上,合成 的原理为
的原理为 (正反应是放热反应).向1L恒容密闭容器中充人
(正反应是放热反应).向1L恒容密闭容器中充人 和
和 ,发生上述反应.测得CO浓度随时间,温度变化如图所示.
,发生上述反应.测得CO浓度随时间,温度变化如图所示.
(1)温度
_______  (填“>” “<”或 “=”),判断依据是
(填“>” “<”或 “=”),判断依据是___________ .
(2)下列叙述能说明该反应达到平衡状态的是________(填字母).
(3)a点:正反应速率逆反应速率__________ (填“>” “<”或 “=”,下同),逆反应速率:a_____ b.
(4) 温度下,2~6min内
温度下,2~6min内 的平均反应速率为
的平均反应速率为__________  .
.
(5) 温度下,CO平衡转化率为
温度下,CO平衡转化率为______________ .
(6)CO空气碱性燃料电池放电效率高,写出负极的电极反应式:_____________ .
 的原理为
的原理为 (正反应是放热反应).向1L恒容密闭容器中充人
(正反应是放热反应).向1L恒容密闭容器中充人 和
和 ,发生上述反应.测得CO浓度随时间,温度变化如图所示.
,发生上述反应.测得CO浓度随时间,温度变化如图所示.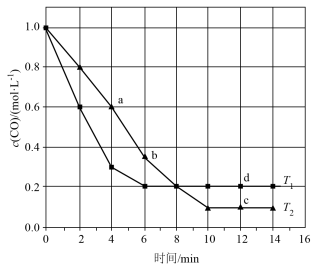
(1)温度

 (填“>” “<”或 “=”),判断依据是
(填“>” “<”或 “=”),判断依据是(2)下列叙述能说明该反应达到平衡状态的是________(填字母).
| A.混合气体密度不随时间变化 |
| B.气体总压强不随时间变化 |
C. 体积分数不随时间变化 体积分数不随时间变化 |
D.CO消耗速率等于 生成速率 生成速率 |
(3)a点:正反应速率逆反应速率
(4)
 温度下,2~6min内
温度下,2~6min内 的平均反应速率为
的平均反应速率为 .
.(5)
 温度下,CO平衡转化率为
温度下,CO平衡转化率为(6)CO空气碱性燃料电池放电效率高,写出负极的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】利用 加氢制甲醇是实现碳中和、碳达峰较为可行的方法。
加氢制甲醇是实现碳中和、碳达峰较为可行的方法。
已知:

回答下列问题:
(1)

___________  。
。
(2)恒温恒容的容器中仅发生反应 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。
(3)一定温度下,在2 L的密闭容器中按物质的量比1:5充入 和
和 ,发生反应
,发生反应 ,测得
,测得 和
和
的物质的量浓度随时间变化关系如图所示。

①3min时,
___________  (填“>”“=”或“<”),0~10min,反应放出
(填“>”“=”或“<”),0~10min,反应放出___________ kJ的热量。
②反应达到化学平衡时, =
=___________ 。
(已知: )
)
若初始总压强为 ,平衡时总压强为P,则
,平衡时总压强为P,则 =
=___________ 。
③反应达到平衡后,下列条件可使化学平衡发生移动的是___________ (填标号)。
A.恒容条件充入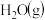 B.升高温度
B.升高温度
C.使用高效催化剂 D.恒容条件充入He
 加氢制甲醇是实现碳中和、碳达峰较为可行的方法。
加氢制甲醇是实现碳中和、碳达峰较为可行的方法。已知:


回答下列问题:
(1)


 。
。(2)恒温恒容的容器中仅发生反应
 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。A.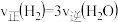 时,说明反应达到平䡓状念 时,说明反应达到平䡓状念 |
B.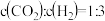 时,说明反应达到平衡状态 时,说明反应达到平衡状态 |
C. 的体积分数保持不变时,说明反应达到平衡状态 的体积分数保持不变时,说明反应达到平衡状态 |
| D.反应达到平衡后,升高温度,正反应速率增大,逆反应速率减小 |
 和
和 ,发生反应
,发生反应 ,测得
,测得 和
和
的物质的量浓度随时间变化关系如图所示。

①3min时,

 (填“>”“=”或“<”),0~10min,反应放出
(填“>”“=”或“<”),0~10min,反应放出②反应达到化学平衡时,
 =
=(已知:
 )
)若初始总压强为
 ,平衡时总压强为P,则
,平衡时总压强为P,则 =
=③反应达到平衡后,下列条件可使化学平衡发生移动的是
A.恒容条件充入
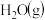 B.升高温度
B.升高温度C.使用高效催化剂 D.恒容条件充入He
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。
(1)Cl2可与NaOH溶液反应制取消毒液,请写出消毒液中有效成分的电子式__________ 。
(2)实验室可用MnO2和浓盐酸反应制取Cl2,反应的化学方程式是____________________ 。
(3)工业上可采取电解饱和食盐水的方法制取Cl2,阳极的电极反应式为________________ 。
(4)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:4HCl(g) + O2(g) 2Cl2(g) + 2H2O(g) ∆H =-115.4 kJ•mol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
2Cl2(g) + 2H2O(g) ∆H =-115.4 kJ•mol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
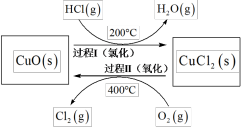
过程I的反应为:2HCl(g) + CuO (s) CuCl2(s) + H2O(g) ∆H1 =-120.4 kJ•mol-1
CuCl2(s) + H2O(g) ∆H1 =-120.4 kJ•mol-1
①过程II反应的热化学方程式为_______ 。
②过程I流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为_______ 。
③相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为_______ 。
④实验测得在不同压强下,总反应的HCl平衡转化率(ɑHCl)随温度变化的曲线如图:
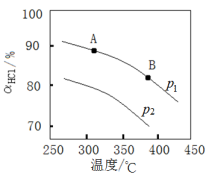
ⅰ.平衡常数比较:K(A)_____ K(B) (填“>”“<”或“=”,下同)。
ⅱ.压强比较:p1_____ p2。
(5)以上三种制取Cl2的原理,其共同之处是_______ 。
(1)Cl2可与NaOH溶液反应制取消毒液,请写出消毒液中有效成分的电子式
(2)实验室可用MnO2和浓盐酸反应制取Cl2,反应的化学方程式是
(3)工业上可采取电解饱和食盐水的方法制取Cl2,阳极的电极反应式为
(4)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:4HCl(g) + O2(g)
 2Cl2(g) + 2H2O(g) ∆H =-115.4 kJ•mol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
2Cl2(g) + 2H2O(g) ∆H =-115.4 kJ•mol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
过程I的反应为:2HCl(g) + CuO (s)
 CuCl2(s) + H2O(g) ∆H1 =-120.4 kJ•mol-1
CuCl2(s) + H2O(g) ∆H1 =-120.4 kJ•mol-1①过程II反应的热化学方程式为
②过程I流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为
③相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为
④实验测得在不同压强下,总反应的HCl平衡转化率(ɑHCl)随温度变化的曲线如图:

ⅰ.平衡常数比较:K(A)
ⅱ.压强比较:p1
(5)以上三种制取Cl2的原理,其共同之处是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】已知化学反应①:Fe(s)+CO2(g)  FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)  FeO(s)+H2(g),其平衡常数为K2。在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2。在温度973K和1173K情况下,K1、K2的值分别如下:
(1)通过表格中的数值可以推断:反应①是__________ (填“吸热”或“放热”)反应。
(2)现有反应③CO2(g)+H2(g) CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=_______________________________________________ 。
(3)能判断反应③已达平衡状态的是_______________________________
A.容器中压强不变 B.混合气体中c(CO)不变
C. (H2)=
(H2)= (H2O) D.c(CO2)=c(CO)
(H2O) D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式_______________________ 。据此关系式及上表数据,也能推断出反应③是______ (填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______ (填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(5)氢气用于工业合成氨 N2(g) + 3H2(g) 2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 、t5 、t7时刻所对应的实验条件改变分别是
2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 、t5 、t7时刻所对应的实验条件改变分别是
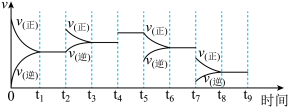
t4___________________ 、t5 ___________________ 、t7___________________ 。
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)  FeO(s)+H2(g),其平衡常数为K2。在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2。在温度973K和1173K情况下,K1、K2的值分别如下:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是
(2)现有反应③CO2(g)+H2(g)
 CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=(3)能判断反应③已达平衡状态的是
A.容器中压强不变 B.混合气体中c(CO)不变
C.
 (H2)=
(H2)= (H2O) D.c(CO2)=c(CO)
(H2O) D.c(CO2)=c(CO) (4)根据反应①与②可推导出K1、K2与K3之间的关系式
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(5)氢气用于工业合成氨 N2(g) + 3H2(g)
 2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 、t5 、t7时刻所对应的实验条件改变分别是
2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 、t5 、t7时刻所对应的实验条件改变分别是
t4
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因_____ 。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为_____ 。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)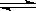 Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______ 0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:

①中和含酸废水工业常用的试剂x是_____ 。
②写出H2S气体与足量NaOH溶液反应的化学方程式____ 。
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:____ 。
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为_____ 。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为
 Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:

①中和含酸废水工业常用的试剂x是
②写出H2S气体与足量NaOH溶液反应的化学方程式
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】25℃时,醋酸、次氛酸、碳酸和亚硫酸电离平衡常数分别为:醋酸 ;次氯酸
;次氯酸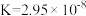 ;碳酸
;碳酸 ,
,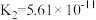 ;亚硫酸
;亚硫酸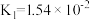 ,
,
(1)写出碳酸的第一级电离平衡常数表达式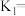
_______ 。
(2)在相同条件下,等浓度的 、
、 、
、 和
和 溶液中结合
溶液中结合 能力最强的是
能力最强的是_______ 。
(3)已知下面三个数据: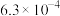 、
、 、
、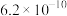 分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
分别是下列有关的三种酸的电离常数,若已知下列反应可以发生: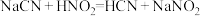 ;
; 。由此可判断下列叙述不正确的是
。由此可判断下列叙述不正确的是
(4)常温下,有 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______(填字母)。(①表示盐酸,②表示醋酸)
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______(填字母)。(①表示盐酸,②表示醋酸)
(5)25℃,将 的
的 溶液加水稀释,请填写下列表达式中的数据情况(填“变大”、“变小”或“不变”)。
溶液加水稀释,请填写下列表达式中的数据情况(填“变大”、“变小”或“不变”)。
①
_______ ;
②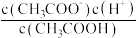
_______ ;
③
_______ 。
(6)已知25℃时,测得浓度为 的碱BOH的溶液中,
的碱BOH的溶液中, 。BOH的电离常数
。BOH的电离常数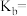
_______ 。
 ;次氯酸
;次氯酸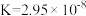 ;碳酸
;碳酸 ,
,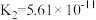 ;亚硫酸
;亚硫酸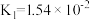 ,
,
(1)写出碳酸的第一级电离平衡常数表达式
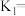
(2)在相同条件下,等浓度的
 、
、 、
、 和
和 溶液中结合
溶液中结合 能力最强的是
能力最强的是(3)已知下面三个数据:
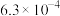 、
、 、
、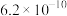 分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
分别是下列有关的三种酸的电离常数,若已知下列反应可以发生: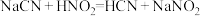 ;
; 。由此可判断下列叙述不正确的是
。由此可判断下列叙述不正确的是 A. |
B. |
C.三种酸的强弱顺序为 |
D. |
 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______(填字母)。(①表示盐酸,②表示醋酸)
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______(填字母)。(①表示盐酸,②表示醋酸)A. | B. | C. | D. |
 的
的 溶液加水稀释,请填写下列表达式中的数据情况(填“变大”、“变小”或“不变”)。
溶液加水稀释,请填写下列表达式中的数据情况(填“变大”、“变小”或“不变”)。①

②
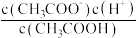
③

(6)已知25℃时,测得浓度为
 的碱BOH的溶液中,
的碱BOH的溶液中, 。BOH的电离常数
。BOH的电离常数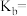
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】化学是一门实验的科学,滴定法是化学上常用的定量分析的方法,有酸碱中和滴定、氧化还原滴定、沉淀滴定等。
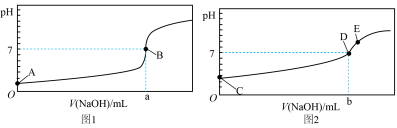
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:________ (填“1”或“2”),滴加2~3滴________ 作指示剂(填“甲基橙”或“酚酞”)。
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>________ 。
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
________ mL。
(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为 。
。
iii.终点时用去bmL 的KMnO4溶液。
的KMnO4溶液。
(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式___________ 。
(7)如何判定滴定终点___________ 。
(8)计算:血液中含钙离子的浓度为___________ mol/L(用字母表示)。
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于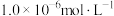 )时,溶液中
)时,溶液中 为
为___________  (已知
(已知 )。
)。
I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
| A.> | B.< | C.= | D.不确定 |
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
| 滴定次数 | 待测液体积(mL) | 标准溶液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 1.02 | 18.97 |
| 2 | 20.00 | 0.60 | 见图 |
| 3 | 20.00 | 0.20 | 18.25 |

(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
| A.盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| B.配制标准溶液的固体NaOH中混有KOH杂质 |
| C.盛装NaOH标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失 |
| D.读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数 |
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵
 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为
 。
。iii.终点时用去bmL
 的KMnO4溶液。
的KMnO4溶液。(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式
(7)如何判定滴定终点
(8)计算:血液中含钙离子的浓度为
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中
 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于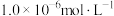 )时,溶液中
)时,溶液中 为
为 (已知
(已知 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】近期发现, 是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是___________ (填标号)
a.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
b.常温下,氢硫酸的导电能力低于相同浓度的亚硫酸
c.常温下, 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的 分别为4.5和2.1
分别为4.5和2.1
d.氢硫酸的还原性强于亚硫酸
(2)向 的水溶液中缓慢通入
的水溶液中缓慢通入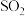 至饱和,再继续通一段时间,整个过程中
至饱和,再继续通一段时间,整个过程中 的变化情况为
的变化情况为___________
(3)常温下,向 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图(忽略溶液体积的变化及
的关系如图(忽略溶液体积的变化及 的挥发)。请计算:
的挥发)。请计算:
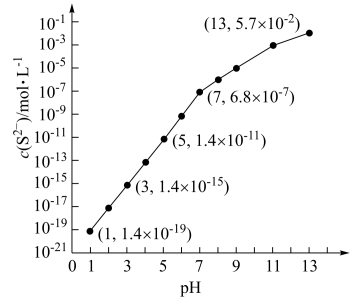
①当溶液中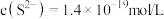 ,溶液中,水电离产生的
,溶液中,水电离产生的
___________ 
②当 时,溶液中
时,溶液中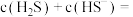
___________ 
(4)向 溶液中滴加饱和
溶液中滴加饱和 溶液,没有沉淀生成,继续滴加一定量的氨水后,生成
溶液,没有沉淀生成,继续滴加一定量的氨水后,生成 沉淀。用电离平衡原理解释上述现象
沉淀。用电离平衡原理解释上述现象___________
 是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是
a.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
b.常温下,氢硫酸的导电能力低于相同浓度的亚硫酸
c.常温下,
 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的 分别为4.5和2.1
分别为4.5和2.1d.氢硫酸的还原性强于亚硫酸
(2)向
 的水溶液中缓慢通入
的水溶液中缓慢通入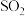 至饱和,再继续通一段时间,整个过程中
至饱和,再继续通一段时间,整个过程中 的变化情况为
的变化情况为(3)常温下,向
 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图(忽略溶液体积的变化及
的关系如图(忽略溶液体积的变化及 的挥发)。请计算:
的挥发)。请计算:
①当溶液中
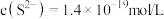 ,溶液中,水电离产生的
,溶液中,水电离产生的

②当
 时,溶液中
时,溶液中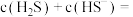

(4)向
 溶液中滴加饱和
溶液中滴加饱和 溶液,没有沉淀生成,继续滴加一定量的氨水后,生成
溶液,没有沉淀生成,继续滴加一定量的氨水后,生成 沉淀。用电离平衡原理解释上述现象
沉淀。用电离平衡原理解释上述现象
您最近一年使用:0次



