I.酸碱中和滴定:常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:
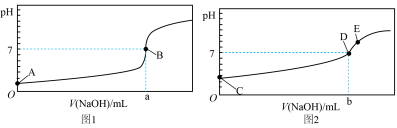
(2)达到B、D状态时,反应消耗NaOH溶液的体积a___________b(填编号)。
| A.> | B.< | C.= | D.不确定 |
(3)A、B、C、E四点水的电离程度由大到小顺序为:E>
(4)某次用氢氧化钠滴定未知浓度的醋酸的滴定结果如表所示:
| 滴定次数 | 待测液体积(mL) | 标准溶液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 1.02 | 18.97 |
| 2 | 20.00 | 0.60 | 见图 |
| 3 | 20.00 | 0.20 | 18.25 |

(5)下列操作中造成第2次所测测定结果明显偏差的是___________。
| A.盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| B.配制标准溶液的固体NaOH中混有KOH杂质 |
| C.盛装NaOH标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失 |
| D.读取NaOH标准溶液的体积时,开始时仰视读数,滴定结束时俯视读数 |
Ⅱ.氧化还原滴定:
如测定血液中钙的含量时,进行如下实验:
i.可将amL血液用蒸馏水稀释后,向其中加入足量草酸铵
 晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。
晶体,反应生成CaC2O4沉淀,过滤、洗涤,将沉淀用稀硫酸处理得H2C2O4溶液。ii.将i得到的H2C2O4溶液,再用KMnO4酸性溶液滴定,氧化产物为CO2,还原产物为
 。
。iii.终点时用去bmL
 的KMnO4溶液。
的KMnO4溶液。(6)写出用KMnO4酸性溶液滴定H2C2O4的离子方程式
(7)如何判定滴定终点
(8)计算:血液中含钙离子的浓度为
Ⅲ.沉淀滴定法:
(9)用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中
 ,利用
,利用 与
与 生成砖红色沉淀,指示到达滴定终点。当溶液中
生成砖红色沉淀,指示到达滴定终点。当溶液中 恰好沉淀完全(浓度等于
恰好沉淀完全(浓度等于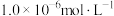 )时,溶液中
)时,溶液中 为
为 (已知
(已知 )。
)。
相似题推荐
(1)某温度下,0.1mol/L的盐酸中水电离出的
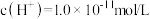 ,该温度下将
,该温度下将 的NaOH溶液与
的NaOH溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
(2)常温下将pH均为3,体积均为
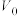 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随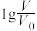 的变化如图所示。
的变化如图所示。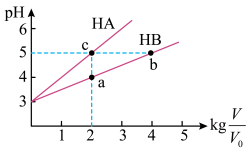
①a、b、c三点水的电离程度
②常温下,取上述pH均为3的HA和HB溶液各100mL,向其中分别加入足量的Zn粒,反应结束时HA中产生氢气的物质的量为
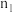 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为 ,则
,则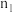
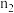 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。(3)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
| 化学式 | HF | HClO |  |  | HSCN |  |
| 电离平衡常数 | 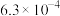 |  | 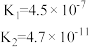 |  | 0.13 | 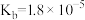 |
②
 溶液的水解平衡常数
溶液的水解平衡常数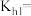
③同浓度的NaF溶液和
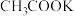 溶液相比,
溶液相比,后者溶液中
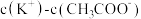
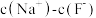 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。④现有25℃时等浓度的5种溶液:
A.
 B.
B. C.
C. D.
D. E.
E.
这5种溶液中
 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①0.1 mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)
②常温下,pH相同的三种溶液A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是
③室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
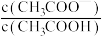
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。
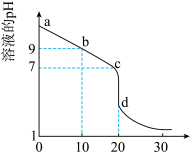
①d点所示的溶液中离子浓度由大到小的顺序依次为
②b点所示的溶液中c(NH3·H2O)-c(NH4+)=
③pH =10的氨水与pH =4的NH4C1溶液中,由水电离出的c(H+)之比为
(1)上述反应在一密闭容器中进行,下列条件的改变会使反应的速率增大的是_______。
| A.将容器体积缩小一半 |
| B.保持压强不变,充入Ne气使容器体积增大 |
| C.保持容器体积不变,向反应容器中充入CO2 |
| D.保持容器体积不变,将反应生成的甲醇及时液化并分离出去 |
 、②
、② 、③HCl、④
、③HCl、④ 、⑤NaOH
、⑤NaOH① pH相等的④和⑤溶液,稀释相同的倍数,稀释之后pH较大的是
② 等浓度的上述溶液中,水电离的程度由大到小的顺序
③ 若将等浓度的③和④的溶液混合后溶液恰好呈中性,则混合前③的体积
④ 取10mL0.1 mol∙L−1的③溶液,加水稀释到1000mL,则此时溶液中由水电离出的
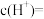
(3)某甲烷—氧气燃料电池的工作原理如下图所示。
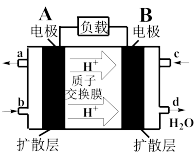
①c处通入的是
②工作一段时间后,当3.2 g甲烷完全反应生成CO2时,有
(1)配制100mL 0.1000mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.1000 | 30.05 | 20.00 |
| 2 | 0.1000 | 29.95 | 20.00 |
| 3 | 0.1000 | 28.20 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为
③排去碱式滴定管中气泡的方法应采用操作
甲.  乙.
乙.  丙.
丙. 
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有
A.碱式滴定管使用前,水洗后未用NaOH标准溶液润洗
B.锥形瓶水洗后未干燥
C.滴定前读数时正确,滴定后俯视刻度线
D.碱式滴定管尖嘴部分有气泡,滴定后消失
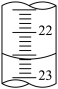
⑤如图是某次滴定时的滴定管中的液面,其读数为
(1)KMnO4溶液应放在
(2)写出KMnO4与H2C2O4反应的离子方程式
(3)滴定终点的现象为
(4)某学生根据 3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol·L-1 KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
②下列操作中可能使测定结果偏低的是
A.酸式滴定管未用标准液润洗就直接注入 KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(5)滴定实验中一般要选择合适的指示剂,下列滴定中指示剂的选择或滴定终点颜色变化错误的是
提示:2KMnO4+5K2SO3+3H2SO4=6K2SO4+2MnSO4+3H2O、I2+Na2S=2NaI+S↓。
选项 | 滴定管中的溶液 | 锥形瓶中的溶液 | 指示剂 | 滴定终点颜色变化 |
A | NaOH溶液 | CH3COOH溶液 | 酚酞 | 无色→浅红色 |
B | 盐酸 | 氨水 | 甲基橙 | 黄色→橙色 |
C | 酸性KMnO4溶液 | K2SO3溶液 | 无 | 无色→浅紫红色 |
D | 碘水 | Na2S溶液 | 淀粉 | 蓝色→无色 |
(1)准确称量10.0 g 含有少量易溶杂质的样品(杂质不与盐酸反应),配成500mL待测溶液。称量时,样品可放在
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000 mol/L的盐酸来滴定待测溶液,
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视
(4)根据下表中数据,计算被测烧碱溶液的物质的量浓度是
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果
②锥形瓶未用待装溶液润洗,使滴定结果
③装标准溶液的滴定管在滴定前尖嘴处有气泡,滴定终了无气泡,使滴定结果
④滴定前平视凹液面,滴定终了俯视凹液面,使滴定结果
(1)常温下,将pH和体积均相同的H2SO4和CH3COOH溶液分别稀释,溶液pH随加水体积的变化如如图:

①曲线Ⅰ代表
②a、b两点对应的溶液中,水的电离程度a
③向上述H2SO4溶液和CH3COOH溶液分别滴加等浓度的NaOH溶液,当恰好中和时,消耗NaOH溶液体积分别为V1 和V2,则V1
(2)某温度下,测得0.01mol·L-1的NaOH溶液的pH=11。
①该温度下,纯水的Kw=
②将pH=12的NaOH溶液Va L与pH=2的H2SO4溶液Vb L混合,所得混合液为中性。则Va︰Vb=
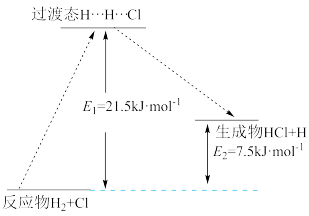
(3)一定温度下,反应H2+Cl2=2HCl中的某一基元反应为H2+Cl=HCl+H,其能量变化如图所示。H…H…Cl表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。该基元反应逆反应的活化能为
(4)键能可用于估算反应的ΔH。已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
| H2(g) | Br2(g) | HBr(g) | |
| 1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
(5)已知:Ⅰ.C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的热化学方程式为
(1)①25℃时,三种弱电解质的电离平衡常数如表:
| 化学式 | HCOOH |  |  |  |
| 电离平衡常数 | 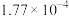 | 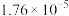 | 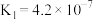  | 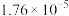 |
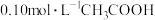 溶液中
溶液中 电离程度增大的是
电离程度增大的是a.通入少量HCl气体 b.加入少量冰醋酸 c.加入少量醋酸钠固体 d.加入少量水
(2)常温下,
 的
的 溶液加水稀释过程,下列表达式的数据一定变小的是
溶液加水稀释过程,下列表达式的数据一定变小的是a.
 b.
b. c.
c. d.
d.
(3)常温下,有pH相同、体积相同的a.
 溶液和b.HCl溶液,现采取以下措施:
溶液和b.HCl溶液,现采取以下措施:①分别加适量醋酸钠晶体后,
 溶液中
溶液中
 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)②分别加等浓度的NaOH溶液至恰好反应,所需NaOH溶液的体积:
 溶液
溶液③温度都升高20℃,
 溶液中
溶液中
 。
。④分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
a.
 b.
b. 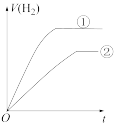 c.
c.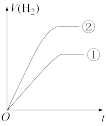 d.
d.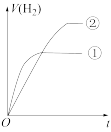
(4)常温下,等体积等物质的量浓度的
 和
和 溶液混合后,溶液的
溶液混合后,溶液的
 ②
② ③
③ ④
④ 溶液的pH大小顺序是
溶液的pH大小顺序是 溶液滴入
溶液滴入 中的离子方程式
中的离子方程式| 化学式 |  |  |  |
| 电离平衡常数 | 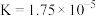 |   | 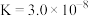 |
(1)常温下,醋酸钠的溶液呈
(2)物质的量浓度为
 的下列四种溶液,pH由大到小的顺序是___________(填编号)。
的下列四种溶液,pH由大到小的顺序是___________(填编号)。A. | B. | C. | D. |
(3)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。则HX的电离平衡常数
 ,将所得的
,将所得的 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到 ,原理如图所示(电极材料为石墨)。
,原理如图所示(电极材料为石墨)。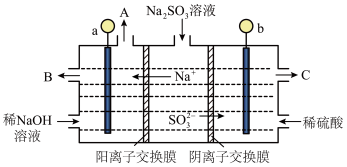
(5)
 放电的电极反应式为
放电的电极反应式为
已知:①还原焙烧的主反应为2MnO2+C=2MnO+CO2↑
②氧化能力S2O
 >MnO
>MnO >
>
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)基态锰原子的价层电子排布式为
(2)在实验室进行步骤A操作时,可能用到的主要仪器为
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是
(4)步骤G发生的离子方程式为
 的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,S2O
 中存在过氧键(-O-O-),请问S2O
中存在过氧键(-O-O-),请问S2O 中S的化合价为
中S的化合价为 、FeO、MgO、CuO等杂质)资源中提取镍和铜的一种工艺流程如下:
、FeO、MgO、CuO等杂质)资源中提取镍和铜的一种工艺流程如下: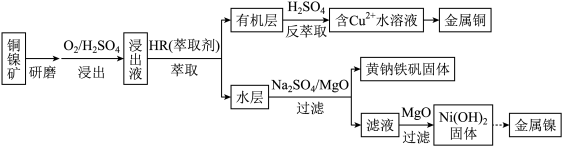
资料:一些物质的
 (25℃)如下。
(25℃)如下。| 物质 |  |  |  |  |
 |  |  |  | 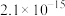 |
(2)浸出过程中通入
 的目的是
的目的是(3)萃取时发生反应:
 (HR、
(HR、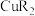 在有机层,
在有机层, 、
、 在水层)。
在水层)。①某种HR的结构简式为
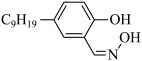 ,该分子中可能与
,该分子中可能与 形成配位键的,原子有
形成配位键的,原子有②解释反萃取时
 的作用:
的作用:(4)黄钠铁矾[
 ]比
]比 更易形成沉淀。反应终点pH与
更易形成沉淀。反应终点pH与 、
、 沉淀率的关系如下表。
沉淀率的关系如下表。| 反应终点pH | 沉淀率/% | |
 |  | |
| 1.5 | 94.04 | 0.19 |
| 2.5 | 99.21 | 0.56 |
| 3.8 | 99.91 | 3.31 |
②沉淀
 时最适宜选用的反应终点pH是
时最适宜选用的反应终点pH是(5)第二次使用MgO调节pH使
 沉淀完全,宜将pH调节至
沉淀完全,宜将pH调节至a.6~7 b.9~10 c.11~12
已知:①CoCO3的溶度积为:Ksp=1.0×10-13;
②溶液中离子浓度小于1.0×10-5mol/L时认为该离子沉淀完全。
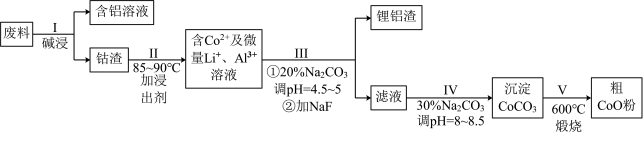
(1)“碱溶”前通常将废料粉碎,其目的是
(2)过程I中采用NaOH溶液溶出废料中的A1,反应的离子方程式为
(3)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出含钻物质的反应化学方程式为 (产物中只有一种酸根)
(4)过程III得到锂铝渣的主要成分是LiF和AI(OH)3,碳酸钠溶液在产生 Al(OH)3时起重要作用,请写出该反应的离子方程式
(5)将2.0×10-4 mol/LCoSO4与2.2×10-4mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为
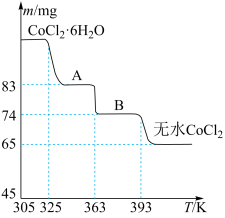
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,物质B的化学式是