自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题。
(1)某温度下,0.1mol/L的盐酸中水电离出的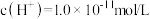 ,该温度下将
,该温度下将 的NaOH溶液与
的NaOH溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
_______ 。
(2)常温下将pH均为3,体积均为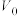 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随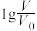 的变化如图所示。
的变化如图所示。
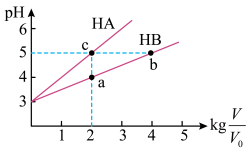
①a、b、c三点水的电离程度_______ (用“>”、“=”、“<”填空)。
②常温下,取上述pH均为3的HA和HB溶液各100mL,向其中分别加入足量的Zn粒,反应结束时HA中产生氢气的物质的量为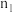 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为 ,则
,则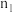
_______ 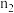 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
(3)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
①KSCN溶液呈弱碱性,用离子方程式解释原因_______ 。
② 溶液的水解平衡常数
溶液的水解平衡常数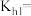
_______ (保留两位有效数字)。
③同浓度的NaF溶液和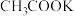 溶液相比,
溶液相比,
后者溶液中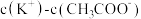
_______ 前者溶液中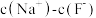 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。
④现有25℃时等浓度的5种溶液:
A. B.
B. C.
C. D.
D. E.
E.
这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:_______ (填字母)。
(1)某温度下,0.1mol/L的盐酸中水电离出的
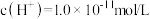 ,该温度下将
,该温度下将 的NaOH溶液与
的NaOH溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的
(2)常温下将pH均为3,体积均为
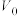 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随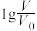 的变化如图所示。
的变化如图所示。
①a、b、c三点水的电离程度
②常温下,取上述pH均为3的HA和HB溶液各100mL,向其中分别加入足量的Zn粒,反应结束时HA中产生氢气的物质的量为
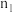 ,HB溶液中产生氢气的物质的量为
,HB溶液中产生氢气的物质的量为 ,则
,则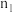
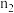 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。(3)查阅资料获得25℃时部分弱电解质的电离平衡常数数据:
| 化学式 | HF | HClO |  |  | HSCN |  |
| 电离平衡常数 | 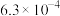 |  | 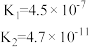 |  | 0.13 | 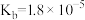 |
②
 溶液的水解平衡常数
溶液的水解平衡常数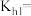
③同浓度的NaF溶液和
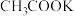 溶液相比,
溶液相比,后者溶液中
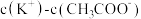
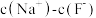 (用“>”、“=”、“<”填空)。
(用“>”、“=”、“<”填空)。④现有25℃时等浓度的5种溶液:
A.
 B.
B. C.
C. D.
D. E.
E.
这5种溶液中
 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:
更新时间:2022-10-28 21:18:47
|
相似题推荐
【推荐1】回答下列问题:
(1)“84”消毒液是一种以NaClO为主要成分的高效消毒剂,NaClO溶液呈_______ 性(填“酸”“碱”或“中”),原因可用离子方程式表示为_______ 。
(2)25℃时,pH均为4的醋酸和硫酸铝两种溶液中,由水电离出的 之比为
之比为_______ 。
(3)已知热化学方程式:
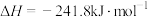 ,其正反应的活化能
,其正反应的活化能_______ 逆反应的活化能(填“>”“=”或“<”)。
(4)向浓度均为 的
的 和
和 混合液中滳加碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滳加碳酸铵溶液至生成两种沉淀,则溶液中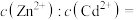
_______ 。[已知: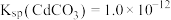 、
、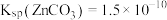 ]
]
(5)相同条件下, 下列溶液中,
下列溶液中, 由小到大的排列顺序是
由小到大的排列顺序是_______ (填序号)。
A. B.
B. C.
C. D.
D. E.
E.
(6)已知:
Ⅰ.
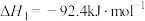
Ⅱ.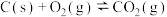
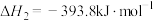
Ⅲ.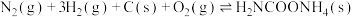
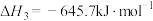
写出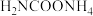 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:_______ 。
(1)“84”消毒液是一种以NaClO为主要成分的高效消毒剂,NaClO溶液呈
(2)25℃时,pH均为4的醋酸和硫酸铝两种溶液中,由水电离出的
 之比为
之比为(3)已知热化学方程式:

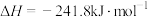 ,其正反应的活化能
,其正反应的活化能(4)向浓度均为
 的
的 和
和 混合液中滳加碳酸铵溶液至生成两种沉淀,则溶液中
混合液中滳加碳酸铵溶液至生成两种沉淀,则溶液中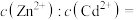
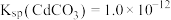 、
、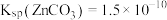 ]
](5)相同条件下,
 下列溶液中,
下列溶液中, 由小到大的排列顺序是
由小到大的排列顺序是A.
 B.
B. C.
C. D.
D. E.
E.
(6)已知:
Ⅰ.

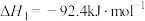
Ⅱ.
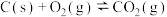
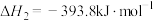
Ⅲ.
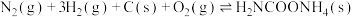
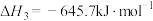
写出
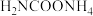 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】I.A、B、C、D、E 为短周期元素且它们的原子序数依次增大,A 的核外电子总数与其周期数相同;其中D原子的 L电子层中,成对电子与未成对电子占据的轨道数相同,并且无空轨道;B原子的 L 电子层中未成对电子数与D相同,但有空轨道;D与E同族,请回答下列问题:
(1)A与其他元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的电子式为____________ ,A分别与 B、C、D形成的共价化合物中既含有极性共价键,又含有非极性共价键的化合物是____________________ (填化学式,任意写出两种)。
(2)B的一种氢化物的相对分子质量是 26,其分子中σ键和π键的数目之比为____________ 。
(3)常温下,相同c(H+)的H2E溶液和硫酸溶液,稀释相同的倍数后的c(H+)前者与后者的关系_________ 。(“大于”、“小于”、“相等”)
Ⅱ.(1)在某温度(T ℃)的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x 与y 关系如图所示。

该温度下,水的离子积为_____ ,T ℃_______ 25℃(填“大于”“小于”或“等于”)。
(2)某温度下,纯水的c(H+)=2.0×10-7mol·L-1。在此温度下,某溶液中由水电离出的c(H+)=4.0×10-13 mol·L-1,则该溶液的pH可能是___________ 。(lg4≈0.6)
(1)A与其他元素形成的二元共价化合物中,一种化合物分子呈三角锥形,该分子的电子式为
(2)B的一种氢化物的相对分子质量是 26,其分子中σ键和π键的数目之比为
(3)常温下,相同c(H+)的H2E溶液和硫酸溶液,稀释相同的倍数后的c(H+)前者与后者的关系
Ⅱ.(1)在某温度(T ℃)的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x 与y 关系如图所示。

该温度下,水的离子积为
(2)某温度下,纯水的c(H+)=2.0×10-7mol·L-1。在此温度下,某溶液中由水电离出的c(H+)=4.0×10-13 mol·L-1,则该溶液的pH可能是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互的转化关系如下图所示。请回答下列问题:
(1)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一.
①A中所含化学键类型为___________ ,D的电子式为___________ ;
②25℃时,0.1mol•L-1 B、C溶液,pH较大的是___________ 溶液(填溶质的化学式),写出B溶液中显电中性的原因___________ ,已知,B溶液里的pH=10,则其水电离出来的H+的浓度为________________ 。
(2)向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
I.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-802.6kJ/mol
II.CH4(g)+O2(g)═CO2(g)+2H2(g)△H2=-322.0kJ/mol
III.CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ/mol
Ⅳ.CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H4=+165.0kJ/mol
请回答下列问题:
①CH4的燃烧热△H________ △H1.(填“>”、“<”或“=”);
②在反应初始阶段,反应II的反应速率大于反应III的反应速率.比较反应II的活化能EII和反应III的活化能EIII的大小:EII________ EIII(填“>”、“<”或“=”)。

(1)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一.
①A中所含化学键类型为
②25℃时,0.1mol•L-1 B、C溶液,pH较大的是
(2)向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
I.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=-802.6kJ/mol
II.CH4(g)+O2(g)═CO2(g)+2H2(g)△H2=-322.0kJ/mol
III.CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+206.2kJ/mol
Ⅳ.CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H4=+165.0kJ/mol
请回答下列问题:
①CH4的燃烧热△H
②在反应初始阶段,反应II的反应速率大于反应III的反应速率.比较反应II的活化能EII和反应III的活化能EIII的大小:EII
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】烟气脱硫脱硝技术是环境科学研究的热点。某小组模拟O3氧化结合(NH4)2SO3溶液吸收法同时脱除SO2和NO的过程示意图如下。

(1)气体反应器中的主要反应原理及相关数据如下表。
①已知: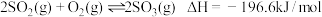 ,则
,则
____ 。
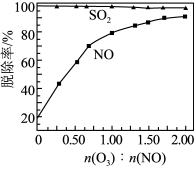
②其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,SO2和NO的转化率随O3的浓度的变化如图。结合数据分析NO的转化率高于SO2的原因_______ 。

(2)其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,O3与NO的物质的量之比对SO2和NO脱除率的影响如图。
①(NH4)2SO3溶液显碱性,用化学平衡原理解释:_______ 。
②O3的浓度很低时,SO2的脱除率超过97%,原因是_______ 。
③在吸收器中,SO 与NO2反应生成
与NO2反应生成 和
和 的离子方程式是
的离子方程式是_______ 。
④在吸收器中,随着吸收过程的进行,部分 被转化为N2,反应中
被转化为N2,反应中 和N2的物质的量之比为1:1,该反应的离子方程式是
和N2的物质的量之比为1:1,该反应的离子方程式是_______ 。

(1)气体反应器中的主要反应原理及相关数据如下表。
| 反应 | 平衡常数(25℃) | 活化能(kJ/mol) |
a: | 1.6×1057 | 3.17 |
b: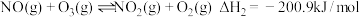 | 6.2×1034 | 3.17 |
c: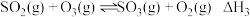 | 1.1×1041 | 58.17 |
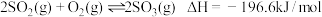 ,则
,则
②其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置1分析,在相同时间内,SO2和NO的转化率随O3的浓度的变化如图。结合数据分析NO的转化率高于SO2的原因

(2)其他条件不变,SO2和NO初始的物质的量浓度相等时,经检测装置2分析,在相同时间内,O3与NO的物质的量之比对SO2和NO脱除率的影响如图。

①(NH4)2SO3溶液显碱性,用化学平衡原理解释:
②O3的浓度很低时,SO2的脱除率超过97%,原因是
③在吸收器中,SO
 与NO2反应生成
与NO2反应生成 和
和 的离子方程式是
的离子方程式是④在吸收器中,随着吸收过程的进行,部分
 被转化为N2,反应中
被转化为N2,反应中 和N2的物质的量之比为1:1,该反应的离子方程式是
和N2的物质的量之比为1:1,该反应的离子方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】高铁酸盐是一种新型绿色净水消毒剂,热稳定性差,在碱性条件下能稳定存在,溶于水发生反应:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-。回答下列问题:
(1)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图:
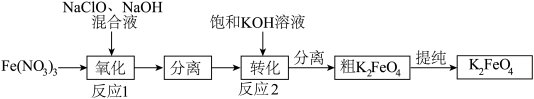
①Na2FeO4中铁元素的化合价为___ ,高铁酸钠用于杀菌消毒时的化学反应类型为___ (填“氧化还原反应”、“复分解反应”或“化合反应”)。
②反应2加入饱和KOH溶液可转化析出K2FeO4,理由是__ 。
(2)化学氧化法生产高铁酸钠(Na2FeO4)是利用Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应,该反应的化学方程式为___ ;理论上每制备0.5mol的Na2FeO4消耗NaClO的质量为___ (保留小数点后1位)。
(3)采用三室膜电解技术制备Na2FeO4的装置如图甲所示,阳极的电极反应式为__ 。电解后,阴极室得到的A溶液中溶质的主要成分为___ (填化学式)。
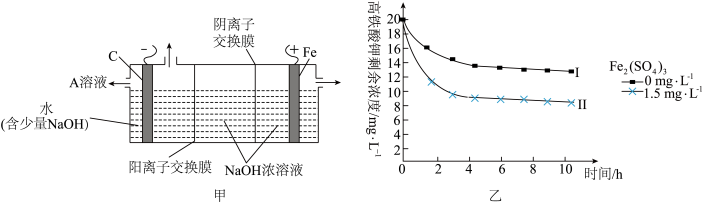
(4)将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是___ 。
(1)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图:

①Na2FeO4中铁元素的化合价为
②反应2加入饱和KOH溶液可转化析出K2FeO4,理由是
(2)化学氧化法生产高铁酸钠(Na2FeO4)是利用Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应,该反应的化学方程式为
(3)采用三室膜电解技术制备Na2FeO4的装置如图甲所示,阳极的电极反应式为

(4)将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】亚硝酸钠(NaNO2)是一种常见的食品添加剂。某实验小组制备NaNO2并对其性质进行探究。
已知:NO+NO2+2NaOH=2NaNO2+H2O,NO2+2NaOH=NaNO2+NaNO3+H2O。
I.NaNO2的制取
(1)利用下图所示装置制备NaNO2(夹持装置略)。仪器a的名称是_______ ,装置B中可观察到_______ 。

II.NaNO2性质探究
(2)用pH计测定NaNO2溶液的pH。溶液pH_____ 7.00(填“>”“<”或“=”),证明HNO2是弱酸。
(3)往溶液通入空气一段时间后,再次测量,溶液的pH减小,原因是_______ 。
(4)取2mL0.1mol·L-1NaNO2溶液于试管中,滴加几滴淀粉溶液,再加入2mL0.1mol/LKI溶液,无明显现象。继续滴加3滴1.00mol/L硫酸溶液,产生气泡,溶液变蓝。 氧化I-的离子方程式是
氧化I-的离子方程式是___ 。
(5)实验小组认为,仅凭步骤(4)不能证明该实验条件下, 能氧化I-,原因是
能氧化I-,原因是_______ 。设计实验证明 氧化了I-,方案是
氧化了I-,方案是_______ 。
已知:NO+NO2+2NaOH=2NaNO2+H2O,NO2+2NaOH=NaNO2+NaNO3+H2O。
I.NaNO2的制取
(1)利用下图所示装置制备NaNO2(夹持装置略)。仪器a的名称是

II.NaNO2性质探究
(2)用pH计测定NaNO2溶液的pH。溶液pH
(3)往溶液通入空气一段时间后,再次测量,溶液的pH减小,原因是
(4)取2mL0.1mol·L-1NaNO2溶液于试管中,滴加几滴淀粉溶液,再加入2mL0.1mol/LKI溶液,无明显现象。继续滴加3滴1.00mol/L硫酸溶液,产生气泡,溶液变蓝。
 氧化I-的离子方程式是
氧化I-的离子方程式是(5)实验小组认为,仅凭步骤(4)不能证明该实验条件下,
 能氧化I-,原因是
能氧化I-,原因是 氧化了I-,方案是
氧化了I-,方案是
您最近一年使用:0次



