高铁酸盐是一种新型绿色净水消毒剂,热稳定性差,在碱性条件下能稳定存在,溶于水发生反应:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-。回答下列问题:
(1)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图:
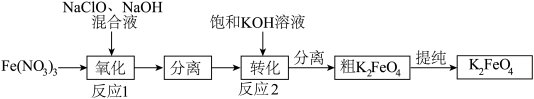
①Na2FeO4中铁元素的化合价为___ ,高铁酸钠用于杀菌消毒时的化学反应类型为___ (填“氧化还原反应”、“复分解反应”或“化合反应”)。
②反应2加入饱和KOH溶液可转化析出K2FeO4,理由是__ 。
(2)化学氧化法生产高铁酸钠(Na2FeO4)是利用Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应,该反应的化学方程式为___ ;理论上每制备0.5mol的Na2FeO4消耗NaClO的质量为___ (保留小数点后1位)。
(3)采用三室膜电解技术制备Na2FeO4的装置如图甲所示,阳极的电极反应式为__ 。电解后,阴极室得到的A溶液中溶质的主要成分为___ (填化学式)。
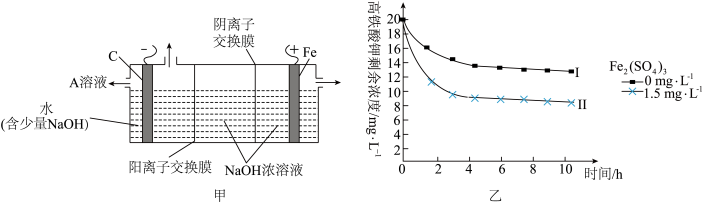
(4)将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是___ 。
(1)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图:

①Na2FeO4中铁元素的化合价为
②反应2加入饱和KOH溶液可转化析出K2FeO4,理由是
(2)化学氧化法生产高铁酸钠(Na2FeO4)是利用Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应,该反应的化学方程式为
(3)采用三室膜电解技术制备Na2FeO4的装置如图甲所示,阳极的电极反应式为

(4)将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是
更新时间:2020-06-03 09:18:51
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠的生产过程如图:

已知:Na2FeO4中在碱性环境中稳定存在。
请回答以下问题:
(1)Na2FeO4中铁元素的化合价为__ ;下列标志中应贴在盛装Na2FeO4容器上的是__ 。

(2)菱铁矿粉碎的目的是__ ,写出“碱浸”过程中SiO2所发生反应的化学方程式为__ 。
(3)操作1与操作2的实验名称均为____ ,步骤③的目的是将Fe2+氧化成Fe3-,其离子方程式为___ 。
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理为__ 。
(5)已知4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH
4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH__ (填“高”或“低”)。


已知:Na2FeO4中在碱性环境中稳定存在。
请回答以下问题:
(1)Na2FeO4中铁元素的化合价为

(2)菱铁矿粉碎的目的是
(3)操作1与操作2的实验名称均为
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理为
(5)已知4FeO42-+10H2O
 4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH
4Fe(OH)3+8OH-+3O2↑,将一定量的Na2FeO4投入到pH不同的工业污水中(污水中其余成分均相同),测得溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示。试分析曲线Ⅰ比曲线Ⅱ对应的污水pH
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
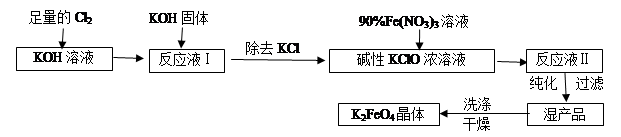
请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式___________ 。
(2)在溶液Ⅰ中加入KOH固体的目的是________ (填编号)。
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3) 从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为________ 。每制得59.4 克K2FeO4,理论上消耗氧化剂的物质的量为________ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: FeO42-+ H2O= Fe(OH)3(胶体) + O2↑+ OH-。___________
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为_____________ 。


请回答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式
(2)在溶液Ⅰ中加入KOH固体的目的是
A.为下一步反应提供碱性的环境
B.使 KClO3 转化为 KClO
C.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3) 从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式: FeO42-+ H2O= Fe(OH)3(胶体) + O2↑+ OH-。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】高铁酸钾(K2FeO4)为紫色固体,易溶于水,在KOH浓溶液中的溶解度较低,难溶于无水乙醇有机溶剂,具有强氧化性,在酸性或中性溶液中不稳定(能产生O2),在碱性溶液中较稳定(碱性越强越稳定)。
(1)用如图所示的装置制备K2FeO4 (夹持装置略)。___________ 。
②B中盛装的液体是___________ 。
③装置C中生成大量紫色固体,发生反应的化学方程式为___________ 。
④向装置C中通入的Cl2不能过量,原因是___________ 。
(2)测定高铁酸钾样品的纯度:
称取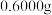 高铁酸钾样品,完全溶解于KOH稀溶液中,再加入足量亚铬酸钾
高铁酸钾样品,完全溶解于KOH稀溶液中,再加入足量亚铬酸钾 溶液,反应后配成
溶液,反应后配成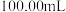 溶液;取上述溶液20.00mL于锥形瓶中,加入稀硫酸调至酸性,用
溶液;取上述溶液20.00mL于锥形瓶中,加入稀硫酸调至酸性,用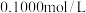 硫酸亚铁铵
硫酸亚铁铵 溶液滴定,消耗标准硫酸亚铁铵溶液18.00mL。
溶液滴定,消耗标准硫酸亚铁铵溶液18.00mL。
已知测定过程中发生反应:
①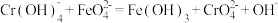 ;
;
② ;
;
③ (未配平)。
(未配平)。
计算K2FeO4样品的纯度(写出计算过程)。___________
(1)用如图所示的装置制备K2FeO4 (夹持装置略)。

②B中盛装的液体是
③装置C中生成大量紫色固体,发生反应的化学方程式为
④向装置C中通入的Cl2不能过量,原因是
(2)测定高铁酸钾样品的纯度:
称取
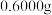 高铁酸钾样品,完全溶解于KOH稀溶液中,再加入足量亚铬酸钾
高铁酸钾样品,完全溶解于KOH稀溶液中,再加入足量亚铬酸钾 溶液,反应后配成
溶液,反应后配成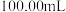 溶液;取上述溶液20.00mL于锥形瓶中,加入稀硫酸调至酸性,用
溶液;取上述溶液20.00mL于锥形瓶中,加入稀硫酸调至酸性,用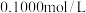 硫酸亚铁铵
硫酸亚铁铵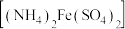 溶液滴定,消耗标准硫酸亚铁铵溶液18.00mL。
溶液滴定,消耗标准硫酸亚铁铵溶液18.00mL。已知测定过程中发生反应:
①
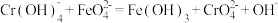 ;
;②
 ;
;③
 (未配平)。
(未配平)。计算K2FeO4样品的纯度(写出计算过程)。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ. 已知部分弱酸的电离平衡常数如下表,请回答下列问题。
(1)同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是___________ ;
(2)体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________ 。
II.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于熔烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是___________ 。(用必要的方程式说明);
(2)相同条件下,0.1mol·L-1 NH4Al(SO4)2中
___________ 0.1mol·L-1 NH4HSO4中 。(填“=”、“﹥”或“﹤”)
。(填“=”、“﹥”或“﹤”)
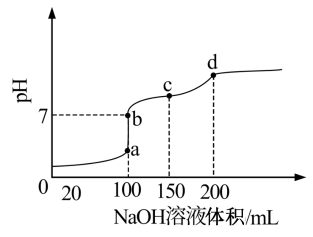
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___________ ,在b点,溶液中各离子浓度由大到小的排列顺序___________ 。
| 弱酸 | HCOOH | HCN | H2CO3 | H3BO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 5.8×10-8 |
(2)体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)
II.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于熔烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是
(2)相同条件下,0.1mol·L-1 NH4Al(SO4)2中

 。(填“=”、“﹥”或“﹤”)
。(填“=”、“﹥”或“﹤”)(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】完成下列填空
(1)已知常温下A-的水解常数Kh=1.61×10-5,常温下,含等物质的量浓度的HA与NaA的混合溶液显___________ (填“酸”、“碱”、“中”)性,c(A-)___________ (填“>”、“<”或“=”)c(HA),该溶液中各离子浓度由大到小的顺序为___________ 。
(2)25℃时,将xmolCH3COONa溶于水,溶液显碱性,向该溶液滴加yL醋酸溶液后溶液呈中性(体积变化忽略不计),则所滴加醋酸溶液的浓度为___________ mol/L(CH3COOH的电离平衡常数取Ka=2×10-5)
(1)已知常温下A-的水解常数Kh=1.61×10-5,常温下,含等物质的量浓度的HA与NaA的混合溶液显
(2)25℃时,将xmolCH3COONa溶于水,溶液显碱性,向该溶液滴加yL醋酸溶液后溶液呈中性(体积变化忽略不计),则所滴加醋酸溶液的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】将过量的 溶液滴入到一定量
溶液滴入到一定量 溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
(一)猜想与假设
猜想一:固体为 。
。
猜想二:固体为 ,理由:
,理由: 溶液呈
溶液呈_______ (填“酸性”或“碱性”)。
猜想三:固体为 和
和 的混合物。
的混合物。
(二)查阅资料
① 和
和 晶体均不带结晶水;
晶体均不带结晶水;
② 、
、 受热易分解分别生成两种氧化物。
受热易分解分别生成两种氧化物。
(三)设计实验
Ⅰ.固体的获取:将反应后的固、液混合物经_______ 、洗涤、低温烘干得蓝色固体。
Ⅱ.用如图所示装置,探究固体的成分。
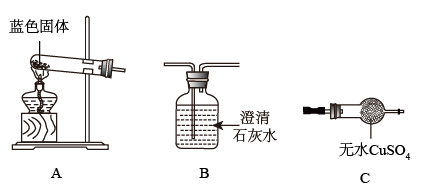
(1)若用装置A、B组合进行实验,B中无现象,则猜想_______ 正确。
(2)若用装置A、C组合进行实验,C中无现象,则猜想_______ 正确。
(3)小组同学将装置按A、_______ 、_______ (填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的。实验中:B中的现象为_______ ,C中的现象为_______ 。
(四)实验结论:固体为 和
和 的混合物。
的混合物。
经实验测得,混合物中两种固体的物质的量之比为1:1,试写出过量的 溶液和一定量
溶液和一定量 反应的离子方程式
反应的离子方程式_______ 。
 溶液滴入到一定量
溶液滴入到一定量 溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。
溶液中得到蓝色固体。某研究性学习小组对蓝色固体的成分进行了如下探究。(一)猜想与假设
猜想一:固体为
 。
。猜想二:固体为
 ,理由:
,理由: 溶液呈
溶液呈猜想三:固体为
 和
和 的混合物。
的混合物。(二)查阅资料
①
 和
和 晶体均不带结晶水;
晶体均不带结晶水;②
 、
、 受热易分解分别生成两种氧化物。
受热易分解分别生成两种氧化物。(三)设计实验
Ⅰ.固体的获取:将反应后的固、液混合物经
Ⅱ.用如图所示装置,探究固体的成分。

(1)若用装置A、B组合进行实验,B中无现象,则猜想
(2)若用装置A、C组合进行实验,C中无现象,则猜想
(3)小组同学将装置按A、
(四)实验结论:固体为
 和
和 的混合物。
的混合物。经实验测得,混合物中两种固体的物质的量之比为1:1,试写出过量的
 溶液和一定量
溶液和一定量 反应的离子方程式
反应的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:
Ⅰ.
 kJ⋅mol
kJ⋅mol ;
;
Ⅱ.
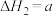 kJ⋅mol
kJ⋅mol ;
;
Ⅲ.
 kJ⋅mol
kJ⋅mol 。
。
(1)
___________ 。
(2)将2.0 mol 和3.0 mol
和3.0 mol  通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得
通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
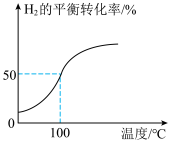
①100℃时反应达到平衡所需的时间为5 min,则反应从起始至5 min内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ ;平衡后向容器中再通入3 mol Ar,平衡___________ (填“正向”“逆向”或“不”)移动。
②100℃时,反应Ⅱ的平衡常数
___________ 。
③若改变条件使平衡常数增大,则从改变条件至再次平衡正反应速率的变化为___________ 。
(3)甲醇会对水质造成一定的污染,有一种电化学法可消除稀硫酸和甲醇这种污染,其原理如下:通电后,将 氧化成
氧化成 ,下图然后以
,下图然后以 作氧化剂,将水中的甲醇氧化成
作氧化剂,将水中的甲醇氧化成 而净化。实验室用如图装置模拟上述过程。
而净化。实验室用如图装置模拟上述过程。
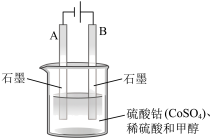
①写出阳极的电极反应式:___________ 。
②写出除去甲醇的离子方程式:___________ 。
 和
和 )在催化剂作用下可合成甲醇,发生的主要反应如下:
)在催化剂作用下可合成甲醇,发生的主要反应如下:Ⅰ.

 kJ⋅mol
kJ⋅mol ;
;Ⅱ.

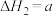 kJ⋅mol
kJ⋅mol ;
;Ⅲ.

 kJ⋅mol
kJ⋅mol 。
。(1)

(2)将2.0 mol
 和3.0 mol
和3.0 mol  通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得
通入容积为3 L的恒容密闭容器中,在一定条件下发生反应Ⅱ,测得 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
①100℃时反应达到平衡所需的时间为5 min,则反应从起始至5 min内,用
 表示该反应的平均反应速率为
表示该反应的平均反应速率为②100℃时,反应Ⅱ的平衡常数

③若改变条件使平衡常数增大,则从改变条件至再次平衡正反应速率的变化为
(3)甲醇会对水质造成一定的污染,有一种电化学法可消除稀硫酸和甲醇这种污染,其原理如下:通电后,将
 氧化成
氧化成 ,下图然后以
,下图然后以 作氧化剂,将水中的甲醇氧化成
作氧化剂,将水中的甲醇氧化成 而净化。实验室用如图装置模拟上述过程。
而净化。实验室用如图装置模拟上述过程。
①写出阳极的电极反应式:
②写出除去甲醇的离子方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】天然气的主要成分为CH4,一般还含有C2H6(乙烷)等,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)⇌C2H4(g)+H2(g) ΔH,若容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。
C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=_______ r1。
②对于处于初期阶段的该反应,下列说法正确的是_______ 。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
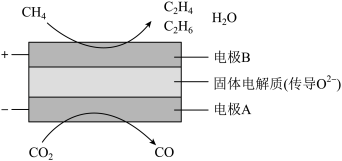
①阴极上的反应式为_______ 。
②若生成的乙烯(C2H4)和乙烷(C2H6)的体积比为2:1,则消耗的CH4和CO2体积比为_______ 。
(1)乙烷在一定条件可发生如下反应:C2H6(g)⇌C2H4(g)+H2(g) ΔH,若容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=
(2)高温下,甲烷生成乙烷的反应如下:2CH4
 C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。
C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
②对于处于初期阶段的该反应,下列说法正确的是
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

①阴极上的反应式为
②若生成的乙烯(C2H4)和乙烷(C2H6)的体积比为2:1,则消耗的CH4和CO2体积比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】金属钴(Co)广泛用作电池材料,草酸钴用途广泛,可用于指示剂和催化剂制备。
某工厂以水钴矿(主要成分为 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备草酸钴的流程如图,回答下列问题:
等)为原料制备草酸钴的流程如图,回答下列问题:

(1) 中钴元素显+2价,则碳元素的化合价为
中钴元素显+2价,则碳元素的化合价为___________ ,固体1的成分是___________ 。
(2)酸浸过程涉及两个氧化还原反应,写出 与盐酸反应(有气体单质生成)的离子方程式:
与盐酸反应(有气体单质生成)的离子方程式:___________ ,另一个反应中氧化剂与还原剂(均指固体)物质的量之比为___________ 。
(3)为实现调pH除杂的目的(溶液中杂质离子浓度不大于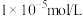 ,溶液的pH不应小于a,则所得固体1的
,溶液的pH不应小于a,则所得固体1的
___________ ,用NaF沉镁而不是用调pH的方法除镁的原因最可能是___________ {已知常温下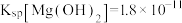 、
、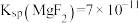 }。
}。
(4) 在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g
在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g 充分加热后,固体质量减少8.8g,写出相应的化学方程式:
充分加热后,固体质量减少8.8g,写出相应的化学方程式:___________ 。
(5)钴酸锂具有功率大的特点而用作电动汽车的动力电池,其工作原理如图,A极中的碳作为金属锂的载体,电池反应式: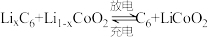 。
。
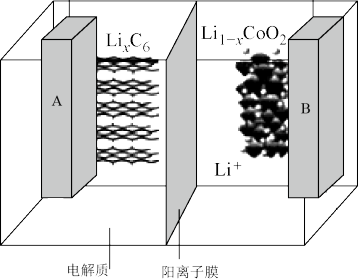
则充电时 从
从___________ (填“A”或“B”)极区移向另一区,阳极上的电极反应式为___________ 。
某工厂以水钴矿(主要成分为
 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备草酸钴的流程如图,回答下列问题:
等)为原料制备草酸钴的流程如图,回答下列问题:
(1)
 中钴元素显+2价,则碳元素的化合价为
中钴元素显+2价,则碳元素的化合价为(2)酸浸过程涉及两个氧化还原反应,写出
 与盐酸反应(有气体单质生成)的离子方程式:
与盐酸反应(有气体单质生成)的离子方程式:(3)为实现调pH除杂的目的(溶液中杂质离子浓度不大于
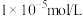 ,溶液的pH不应小于a,则所得固体1的
,溶液的pH不应小于a,则所得固体1的
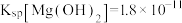 、
、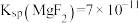 }。
}。(4)
 在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g
在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g 充分加热后,固体质量减少8.8g,写出相应的化学方程式:
充分加热后,固体质量减少8.8g,写出相应的化学方程式:(5)钴酸锂具有功率大的特点而用作电动汽车的动力电池,其工作原理如图,A极中的碳作为金属锂的载体,电池反应式:
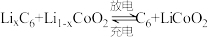 。
。
则充电时
 从
从
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下: 
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
III.Sn(OH)2的性质与Al(OH)3性质相似。 请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是_________________ ;
(2)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子方程式是________________ ;
(3)在反应Ⅰ得到沉淀SnO后,要进行“过滤、漂洗”的操作,检验SnO是否洗干净的操作是_______ ,滤液I溶质的成分是______ (填写化学式)。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是_______________ ;
(5)反应Ⅱ之后的“操作”依次是_______ 、_______ 、过滤、洗涤、低温干燥。
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O,取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是_______________ 。

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
III.Sn(OH)2的性质与Al(OH)3性质相似。 请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是
(2)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子方程式是
(3)在反应Ⅰ得到沉淀SnO后,要进行“过滤、漂洗”的操作,检验SnO是否洗干净的操作是
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是
(5)反应Ⅱ之后的“操作”依次是
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl=SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O,取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】 (熔点
(熔点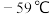 ,沸点11℃)是一种高效消毒灭菌剂,可有效灭活新冠病毒,极易溶于水,在碱性环境中发生反应:
,沸点11℃)是一种高效消毒灭菌剂,可有效灭活新冠病毒,极易溶于水,在碱性环境中发生反应: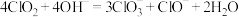 ;稳定性较差,易分解,体积分数大于10%时可能爆炸,常用
;稳定性较差,易分解,体积分数大于10%时可能爆炸,常用 和
和 混合溶液吸收转化为
混合溶液吸收转化为 保存。现利用如下装置及试剂制备
保存。现利用如下装置及试剂制备 。
。

请回答下列问题:
(1)已知75%浓硫酸密度是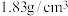 ,其物质的量浓度约为
,其物质的量浓度约为___________  。用98%浓硫酸配制该浓度的溶液
。用98%浓硫酸配制该浓度的溶液 ,除量筒、烧杯、玻璃棒之外还需要的仪器有:
,除量筒、烧杯、玻璃棒之外还需要的仪器有:___________ 。
(2)装置B生成 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为___________ 。实验过程中持续通入 的作用是
的作用是___________ 。
(3)装置C需采用冰水浴的可能原因是___________ (任写一点)。
(4)装置C中 和
和 与
与 反应制取
反应制取 的离子方程式为
的离子方程式为___________ ;加入 过量导致的后果是
过量导致的后果是___________ 。
 (熔点
(熔点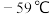 ,沸点11℃)是一种高效消毒灭菌剂,可有效灭活新冠病毒,极易溶于水,在碱性环境中发生反应:
,沸点11℃)是一种高效消毒灭菌剂,可有效灭活新冠病毒,极易溶于水,在碱性环境中发生反应: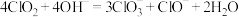 ;稳定性较差,易分解,体积分数大于10%时可能爆炸,常用
;稳定性较差,易分解,体积分数大于10%时可能爆炸,常用 和
和 混合溶液吸收转化为
混合溶液吸收转化为 保存。现利用如下装置及试剂制备
保存。现利用如下装置及试剂制备 。
。
请回答下列问题:
(1)已知75%浓硫酸密度是
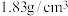 ,其物质的量浓度约为
,其物质的量浓度约为 。用98%浓硫酸配制该浓度的溶液
。用98%浓硫酸配制该浓度的溶液 ,除量筒、烧杯、玻璃棒之外还需要的仪器有:
,除量筒、烧杯、玻璃棒之外还需要的仪器有:(2)装置B生成
 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为 的作用是
的作用是(3)装置C需采用冰水浴的可能原因是
(4)装置C中
 和
和 与
与 反应制取
反应制取 的离子方程式为
的离子方程式为 过量导致的后果是
过量导致的后果是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】碘对动植物的生命是极其重要的,海水里的碘化物和碘酸盐参与大多数海生物的新陈代谢。在高级哺乳动物中,碘以碘化氨基酸的形式集中在甲状腺内,缺乏碘会引起甲状腺肿大。
I.现要从工业含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I-)。设计如图一所示的实验过程:

(1)为了将含碘废液中的I2完全转化为I-而进入水层,向含碘废液中加入了稍过量的A溶液,则A应该具有__ 性。
(2)将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,操作②包含多步操作,操作名称分别为萃取、___ 、__ ,在操作②中必须用到下列所示的部分仪器或装置,这些仪器和装置是__ (填标号)。

(3)将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2,使其在30~40℃反应。写出其中发生反应的离子方程式__ ;Cl2不能过量,因为过量的Cl2将I2氧化为IO3-,写出该反应的离子方程式__ 。

I.现要从工业含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I-)。设计如图一所示的实验过程:

(1)为了将含碘废液中的I2完全转化为I-而进入水层,向含碘废液中加入了稍过量的A溶液,则A应该具有
(2)将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,操作②包含多步操作,操作名称分别为萃取、

(3)将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2,使其在30~40℃反应。写出其中发生反应的离子方程式

您最近一年使用:0次



