Ⅰ. 已知部分弱酸的电离平衡常数如下表,请回答下列问题。
(1)同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是___________ ;
(2)体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________ 。
II.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于熔烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是___________ 。(用必要的方程式说明);
(2)相同条件下,0.1mol·L-1 NH4Al(SO4)2中
___________ 0.1mol·L-1 NH4HSO4中 。(填“=”、“﹥”或“﹤”)
。(填“=”、“﹥”或“﹤”)
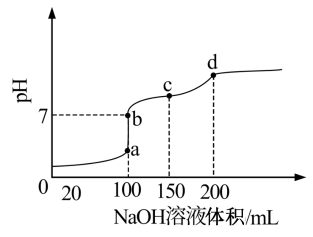
(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___________ ,在b点,溶液中各离子浓度由大到小的排列顺序___________ 。
| 弱酸 | HCOOH | HCN | H2CO3 | H3BO3 |
| 电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 5.8×10-8 |
(2)体积相同、c(H+)相同的三种酸溶液a HCOOH;b HCN;c HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)
II.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于熔烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是
(2)相同条件下,0.1mol·L-1 NH4Al(SO4)2中

 。(填“=”、“﹥”或“﹤”)
。(填“=”、“﹥”或“﹤”)(3)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是

更新时间:2021-02-23 18:31:42
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】(1)含11.2 g KOH的稀溶液与1 L0.1mol/L的H2SO4溶液反应放出11.46 kJ的热量,该反应表示中和热的热化学方程式为___________________ 。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g) 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
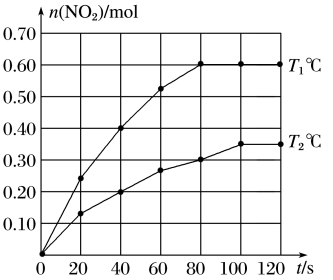
①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为________ mol/(L·s)。
②ΔH________ 0(填“>”、“<”或“=”)。
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:

①甲容器平衡后物质B的转化率为_______ ;
②T℃ 时该反应的平衡常数为________ 。
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显________ 性(填“酸”“碱”或“中”);
②用含a的代数式表示NH3·H2O的电离常数Kb=__________________ 。
(2)将0.40 mol N2O4气体充入2 L的恒容密闭容器中发生如下反应:N2O4(g)
 2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
2NO2(g)ΔH。在T1℃和T2℃时,测得NO2的物质的量随时间变化如图所示:
①T1℃,40~80 s内用N2O4表示该反应的平均反应速率为
②ΔH
(3)向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)
 xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
①甲容器平衡后物质B的转化率为
②T℃ 时该反应的平衡常数为
(4)在25 ℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。
①则溶液显
②用含a的代数式表示NH3·H2O的电离常数Kb=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下向20.00 mL 0.10 mol/L Na2CO3溶液中逐滴加入0.10 mol/L盐酸40.00 mL,所得溶液的pH与加入盐酸体积的关系如表所示:
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?______ (用等式表示)。
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是________ (用离子方程式和必要的文字说明)此时溶液中c(H2CO3)____ (填“>”、“<”或“=”)c(CO32—)。
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3—+H+的电离常数K1=
HCO3—+H+的电离常数K1=_____ 。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____ (填“变大”、“变小”或“不变”)。
(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。
| 溶液的pH | 加入盐酸的总体积 |
| 12 | V(HCl)=0 |
| 8 | V(HCl)=20.00 mL |
| 5 | V(HCl)=40.00 mL |
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 HCO3—+H+的电离常数K1=
HCO3—+H+的电离常数K1=(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】回答下列问题:
(1)稀氨水中存在下述电离平衡:NH3+H2O NH3·H2O
NH3·H2O NH
NH +OH-。试分析向溶液中分别加入下列物质时,平衡如何移动:
+OH-。试分析向溶液中分别加入下列物质时,平衡如何移动:
(2)25℃时,三种酸的电离平衡常数如下:
回答下列问题:
①一般情况下,当温度升高时,Ka_____ (填“增大”、“减小”或“不变”)。
②下列四种离子结合质子能力由大到小的顺序是_____ (填序号)。
a. b.ClO- c.CH3COO- d.
b.ClO- c.CH3COO- d. 
③下列反应不能发生的是______ (填序号)。
a. +CH3COOH=CH3COO-+CO2↑+H2O
+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c. +2HClO=CO2+H2O+2ClO-
+2HClO=CO2+H2O+2ClO-
d.2ClO-+CO2+H2O= +2HClO
+2HClO
④用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是_____ (填序号)。
a.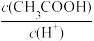 b.
b.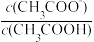 c.
c.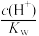 d.
d.
(1)稀氨水中存在下述电离平衡:NH3+H2O
 NH3·H2O
NH3·H2O NH
NH +OH-。试分析向溶液中分别加入下列物质时,平衡如何移动:
+OH-。试分析向溶液中分别加入下列物质时,平衡如何移动:| 加入的物质 | 氯化铵固体 |
| 平衡移动方向 |
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7,K2=5.6×10-11 | 3.0×10-8 |
①一般情况下,当温度升高时,Ka
②下列四种离子结合质子能力由大到小的顺序是
a.
 b.ClO- c.CH3COO- d.
b.ClO- c.CH3COO- d. 
③下列反应不能发生的是
a.
 +CH3COOH=CH3COO-+CO2↑+H2O
+CH3COOH=CH3COO-+CO2↑+H2Ob.ClO-+CH3COOH=CH3COO-+HClO
c.
 +2HClO=CO2+H2O+2ClO-
+2HClO=CO2+H2O+2ClO-d.2ClO-+CO2+H2O=
 +2HClO
+2HClO④用蒸馏水稀释0.10mol•L-1的醋酸,下列各式表示的数值随水量的增加而增大的是
a.
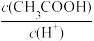 b.
b.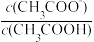 c.
c.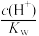 d.
d.
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】生活中常用到酸和碱,已知常温下, 的
的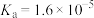 ,
, 的
的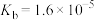 。回答下列问题:
。回答下列问题:
(1)冰醋酸加水稀释过程中溶液的导电能力变化趋势如图所示。

①加水前冰醋酸的导电能力几乎为零,原因是_______ 。
②a、b、c三点中水的电离程度最小的是_______ (用a、b、c表示)。
(2)体积均为100mL、pH均为2的 溶液与一元弱酸HX溶液,分别加水稀释过程中pH与加入水的体积的关系如图所示,则HX的电离平衡常数
溶液与一元弱酸HX溶液,分别加水稀释过程中pH与加入水的体积的关系如图所示,则HX的电离平衡常数_______ (填“大于”“小于”或“等于”) 的电离平衡常数,理由是
的电离平衡常数,理由是_______ 。

(3)常温下,在 的
的 溶液和
溶液和 的
的 溶液中:
溶液中:
① 的
的 溶液中
溶液中 约为
约为_______  (保留两位有效数字)。
(保留两位有效数字)。
②常温下, 溶液的
溶液的
_______ (填具体数字)。
(4)某温度时,测得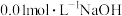 溶液的pH为11,在此温度下,将
溶液的pH为11,在此温度下,将 的NaOH溶液
的NaOH溶液 与
与 的硫酸
的硫酸 混合,若所得混合溶液为中性,则
混合,若所得混合溶液为中性,则
_______ (写比值)。
 的
的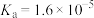 ,
, 的
的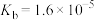 。回答下列问题:
。回答下列问题:(1)冰醋酸加水稀释过程中溶液的导电能力变化趋势如图所示。

①加水前冰醋酸的导电能力几乎为零,原因是
②a、b、c三点中水的电离程度最小的是
(2)体积均为100mL、pH均为2的
 溶液与一元弱酸HX溶液,分别加水稀释过程中pH与加入水的体积的关系如图所示,则HX的电离平衡常数
溶液与一元弱酸HX溶液,分别加水稀释过程中pH与加入水的体积的关系如图所示,则HX的电离平衡常数 的电离平衡常数,理由是
的电离平衡常数,理由是
(3)常温下,在
 的
的 溶液和
溶液和 的
的 溶液中:
溶液中:①
 的
的 溶液中
溶液中 约为
约为 (保留两位有效数字)。
(保留两位有效数字)。②常温下,
 溶液的
溶液的
(4)某温度时,测得
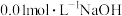 溶液的pH为11,在此温度下,将
溶液的pH为11,在此温度下,将 的NaOH溶液
的NaOH溶液 与
与 的硫酸
的硫酸 混合,若所得混合溶液为中性,则
混合,若所得混合溶液为中性,则
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】基于新材料及3D打印技术,科学家研制出的微胶囊吸收剂,它能将排放的CO2以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入(NH4)2CO3溶液,其原理如图所示。
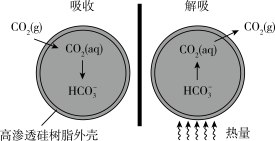
已知:(NH4)2CO3(aq)+CO2(aq)+H2O(l) ⇌2NH4HCO3(aq) ΔH=-25.3 kJ·mol-1
(1)吸收CO2时宜选用_______ (选填“低温”或“高温”)理由 _______ 、_______ 。
(2)已知一水合氨和碳酸室温下电离平衡常数如表:
试结合必要的化学用语与简单计算,判断0.1mol·L-1NH4HCO3溶液的酸碱性_______ 。

已知:(NH4)2CO3(aq)+CO2(aq)+H2O(l) ⇌2NH4HCO3(aq) ΔH=-25.3 kJ·mol-1
(1)吸收CO2时宜选用
(2)已知一水合氨和碳酸室温下电离平衡常数如表:
| 弱电解质 | H2CO3 | NH3·H2O |
| 电离平衡 常数 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】弱电解质的电离平衡与日常生活、工农业生产等息息相关。回答下列问题:
I.部分弱酸的电离平衡常数如下表:
(1)用离子方程式说明Na2C2O4溶液显碱性的原因___________ 。
(2)常温下,pH相同的HCOONa和NaClO溶液,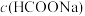
___________ (填“>”“=”或“<”,下同)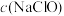 ,一定浓度的NaHS溶液pH
,一定浓度的NaHS溶液pH___________ 7。
(3)已知Ksp(CaC2O4)=a。将0.03 mol∙L−1的CaCl2溶液与0.02 mol∙L−1的Na2C2O4溶液等体积混合,混合溶液中 的浓度约为
的浓度约为_____ mol∙L−1(用含a的代数式表示,混合后溶液体积变化忽略不计)。
Ⅱ.现用浓度为0.0100 mol/L酸性KMnO4溶液滴定未知浓度的草酸(H2C2O4),请回答下列问题:
(4)KMnO4标准溶液应装在___________ (填“酸式”或“碱式”)滴定管中。滴定终点时的实验现象是___________ 。
(5)记录数据如下:
则测出的H2C2O4溶液的物质的量浓度为___________ 。
(6)下列操作会导致测定草酸浓度偏高的是___________。
I.部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | H2S | H2C2O4 | HClO |
| 电离平衡常数(25℃) | Ka=1.8×10−4 | Ka1=1.1×10−7 Ka2=1.3×10−13 | Ka1=5.6×10−2 Ka2=1.5×10−4 | Ka=4.0×10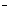 8 8 |
(1)用离子方程式说明Na2C2O4溶液显碱性的原因
(2)常温下,pH相同的HCOONa和NaClO溶液,
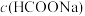
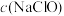 ,一定浓度的NaHS溶液pH
,一定浓度的NaHS溶液pH(3)已知Ksp(CaC2O4)=a。将0.03 mol∙L−1的CaCl2溶液与0.02 mol∙L−1的Na2C2O4溶液等体积混合,混合溶液中
 的浓度约为
的浓度约为Ⅱ.现用浓度为0.0100 mol/L酸性KMnO4溶液滴定未知浓度的草酸(H2C2O4),请回答下列问题:
(4)KMnO4标准溶液应装在
(5)记录数据如下:
| 滴定次数 | 待测溶液体积/mL | KMnO4溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
(6)下列操作会导致测定草酸浓度偏高的是___________。
| A.装高锰酸钾溶液的滴定管滴定前尖嘴中有气泡,滴定后气泡消失 |
| B.配制标准溶液时俯视刻度线 |
| C.未用标准液润洗滴定管 |
| D.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥 |
您最近一年使用:0次



