回答下列问题:
(1)常温下,将pH和体积均相同的H2SO4和CH3COOH溶液分别稀释,溶液pH随加水体积的变化如如图:

①曲线Ⅰ代表_______ 溶液(填“H2SO4”或“CH3COOH”)。
②a、b两点对应的溶液中,水的电离程度a_______ b(填“>”、“<”或“=”)。
③向上述H2SO4溶液和CH3COOH溶液分别滴加等浓度的NaOH溶液,当恰好中和时,消耗NaOH溶液体积分别为V1 和V2,则V1_______ V2(填“>”、“<”或“=”)。
(2)某温度下,测得0.01mol·L-1的NaOH溶液的pH=11。
①该温度下,纯水的Kw=_______ 。
②将pH=12的NaOH溶液Va L与pH=2的H2SO4溶液Vb L混合,所得混合液为中性。则Va︰Vb=_______ 。
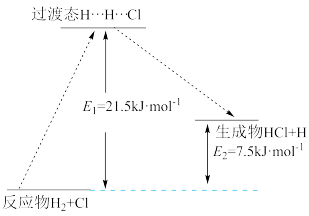
(3)一定温度下,反应H2+Cl2=2HCl中的某一基元反应为H2+Cl=HCl+H,其能量变化如图所示。H…H…Cl表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。该基元反应逆反应的活化能为_______ kJ·mol-1
(4)键能可用于估算反应的ΔH。已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
则表中a为_______ 。
(5)已知:Ⅰ.C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的热化学方程式为_______ 。
(1)常温下,将pH和体积均相同的H2SO4和CH3COOH溶液分别稀释,溶液pH随加水体积的变化如如图:

①曲线Ⅰ代表
②a、b两点对应的溶液中,水的电离程度a
③向上述H2SO4溶液和CH3COOH溶液分别滴加等浓度的NaOH溶液,当恰好中和时,消耗NaOH溶液体积分别为V1 和V2,则V1
(2)某温度下,测得0.01mol·L-1的NaOH溶液的pH=11。
①该温度下,纯水的Kw=
②将pH=12的NaOH溶液Va L与pH=2的H2SO4溶液Vb L混合,所得混合液为中性。则Va︰Vb=
(3)一定温度下,反应H2+Cl2=2HCl中的某一基元反应为H2+Cl=HCl+H,其能量变化如图所示。H…H…Cl表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。该基元反应逆反应的活化能为

(4)键能可用于估算反应的ΔH。已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
| H2(g) | Br2(g) | HBr(g) | |
| 1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
(5)已知:Ⅰ.C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的热化学方程式为
更新时间:2022-12-08 21:05:27
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
I.化石燃料燃烧过程中形成 和
和 等污染物,利用
等污染物,利用 脱除
脱除 的研究获得了广泛关注。在催化剂作用下,
的研究获得了广泛关注。在催化剂作用下, 与
与 的反应为
的反应为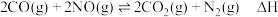 。回答下列问题:
。回答下列问题:
(1)已知: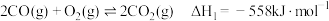
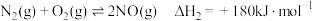
则
___________
(2)向某刚性容器中加入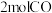 、
、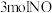 和催化剂,测得平衡时
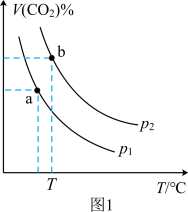
和催化剂,测得平衡时 的体积分数随温度和压强的关系如图1所示。
的体积分数随温度和压强的关系如图1所示。
①下列叙述不能说明反应已经达到平衡状态的是___________ (填标号)。
A.断裂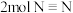 的同时生成
的同时生成
B.压强不再变化
C.混合气体的密度不再变化
D. 的体积分数不再变化
的体积分数不再变化
②压强
___________  (填“>”或“<”,下同),a、b两点的平衡常数
(填“>”或“<”,下同),a、b两点的平衡常数
___________ 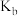 。
。
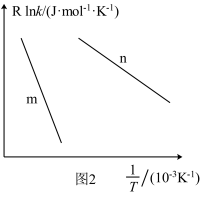
(3)已知Arrhenius经验公式为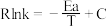 (Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是___________ (填“m”或“n”)。
Ⅱ. 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为 、
、 等物质被认为是一种具有前景的利用
等物质被认为是一种具有前景的利用 的方式。
的方式。
(4) 催化剂中引入
催化剂中引入 能够提高它的选择性。
能够提高它的选择性。 的价电子排布式为
的价电子排布式为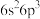 ,其在元素周期表中的位置为
,其在元素周期表中的位置为___________ 。
(5)写出 在酸性介质中电催化还原为
在酸性介质中电催化还原为 的电极反应式
的电极反应式___________ 。
I.化石燃料燃烧过程中形成
 和
和 等污染物,利用
等污染物,利用 脱除
脱除 的研究获得了广泛关注。在催化剂作用下,
的研究获得了广泛关注。在催化剂作用下, 与
与 的反应为
的反应为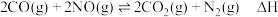 。回答下列问题:
。回答下列问题:(1)已知:
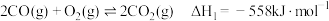
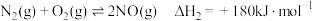
则

(2)向某刚性容器中加入
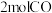 、
、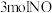 和催化剂,测得平衡时
和催化剂,测得平衡时 的体积分数随温度和压强的关系如图1所示。
的体积分数随温度和压强的关系如图1所示。
①下列叙述不能说明反应已经达到平衡状态的是
A.断裂
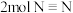 的同时生成
的同时生成
B.压强不再变化
C.混合气体的密度不再变化
D.
 的体积分数不再变化
的体积分数不再变化②压强

 (填“>”或“<”,下同),a、b两点的平衡常数
(填“>”或“<”,下同),a、b两点的平衡常数
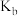 。
。(3)已知Arrhenius经验公式为
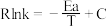 (Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
(Ea为活化能,k为速率常数,R和C为常数),为探究m、n两种催化剂的催化效能进行了实验探究,获得如图2曲线。从图中信息获知催化效能较高的催化剂是
Ⅱ.
 在催化剂作用下,通过电催化还原为
在催化剂作用下,通过电催化还原为 、
、 等物质被认为是一种具有前景的利用
等物质被认为是一种具有前景的利用 的方式。
的方式。(4)
 催化剂中引入
催化剂中引入 能够提高它的选择性。
能够提高它的选择性。 的价电子排布式为
的价电子排布式为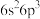 ,其在元素周期表中的位置为
,其在元素周期表中的位置为(5)写出
 在酸性介质中电催化还原为
在酸性介质中电催化还原为 的电极反应式
的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体。2017年我国在南海北部进行的可燃冰采取试验获得成功,标志着我国成为第一个实现在海域可燃冰试开采中获得连续稳定燃气的国家。已知:25℃、101 kPa下,1 g甲烷完全燃烧生成CO2和液态水时放热55.6kJ。甲烷燃烧的热化学方程式为_____________ 。相同条件下,356 g可燃冰(分子式为CH4·9H2O,Mr= 178 )释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_____ kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+ 2H2(g) CH3OH(g) △H1=-90.1 kJ/ mol
CH3OH(g) △H1=-90.1 kJ/ mol
(ii)CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H2=-49.0kJ/ mol
CH3OH(g)+ H2O(g) △H2=-49.0kJ/ mol
水煤气变换反应: (iii) CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-41.1kJ/mol
CO2(g) + H2(g) △H3=-41.1kJ/mol
二甲醚合成反应:(iv) 2CH3OH(g) CH3OCH3(g) + H2O(g) △H4= -24.5kJ/ mol
CH3OCH3(g) + H2O(g) △H4= -24.5kJ/ mol
①分析二甲醚合成反应(iv)对于CO转化率的影响____________________ 。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:______________ 。 根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响__________________________ 。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为____ ,一个二甲醚分子经过电化学氧化,可以产生______ 个电子的电量。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体。2017年我国在南海北部进行的可燃冰采取试验获得成功,标志着我国成为第一个实现在海域可燃冰试开采中获得连续稳定燃气的国家。已知:25℃、101 kPa下,1 g甲烷完全燃烧生成CO2和液态水时放热55.6kJ。甲烷燃烧的热化学方程式为
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+ 2H2(g)
 CH3OH(g) △H1=-90.1 kJ/ mol
CH3OH(g) △H1=-90.1 kJ/ mol(ii)CO2(g) + 3H2(g)
 CH3OH(g)+ H2O(g) △H2=-49.0kJ/ mol
CH3OH(g)+ H2O(g) △H2=-49.0kJ/ mol水煤气变换反应: (iii) CO(g)+ H2O(g)
 CO2(g) + H2(g) △H3=-41.1kJ/mol
CO2(g) + H2(g) △H3=-41.1kJ/mol 二甲醚合成反应:(iv) 2CH3OH(g)
 CH3OCH3(g) + H2O(g) △H4= -24.5kJ/ mol
CH3OCH3(g) + H2O(g) △H4= -24.5kJ/ mol①分析二甲醚合成反应(iv)对于CO转化率的影响
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】锰锌铁氧体是应用广泛的高性能磁性材料。现以akg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如下:
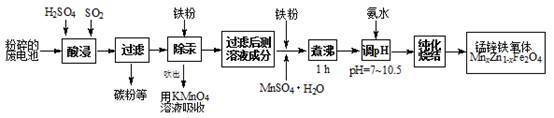
(1)酸浸废电池时,被溶解生成Zn2+的物质有______ ,SO2的作用是_____ (填字母编号)。
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。

①pH<6时反应的离子方程式为___________ 。
②汞的去除速率随pH变化的规律是_________ 。
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) ∆H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) ∆H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是_______________ 。
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为____________ 。若制得这种锰锌铁氧体的质量为100 kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4·H2O)_________ kg。(只列出计算式)

(1)酸浸废电池时,被溶解生成Zn2+的物质有
| A.漂白剂 | B.沉淀剂 | C.氧化剂 | D.还原剂 |
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的。如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围反应的主要产物。

①pH<6时反应的离子方程式为
②汞的去除速率随pH变化的规律是
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得。
已知25℃,101 kPa时:2MnO(s)+O2(g)=2MnO2(s) ∆H=-272.0 kJ/mol
MnCO3(s)=MnO(s)+CO2(g) ∆H=+116.6 kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】I.25℃时,若体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合,恰好中和。请回答:
(1)①若a+b=12,则Va:Vb=________ ;
②若Va<Vb和a=0.5b,则a的取值范围是_________________ 。
II.电子工业中,可用FeCl3溶液作为印刷电路铜板蚀刻液。某探究小组设计如下线路处理废液和资源回收:
请回答:

(2)用足量的FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子是_____________ 。
(3)步骤①中加入H2O2溶液的目的是________________________________________ 。
(4)已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是_____________ 。
(5)若要除去酸性MgCl2溶液中的FeCl3,则可以加入的试剂是_____________ 。(填字母)
A.NaOH B.Mg(OH)2 C.MgCO3 D. NH3・H2O
(1)①若a+b=12,则Va:Vb=
②若Va<Vb和a=0.5b,则a的取值范围是
II.电子工业中,可用FeCl3溶液作为印刷电路铜板蚀刻液。某探究小组设计如下线路处理废液和资源回收:
请回答:

(2)用足量的FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子是
(3)步骤①中加入H2O2溶液的目的是
(4)已知:生成氢氧化物沉淀的pH
| Cu(OH) 2 | Fe(OH) 2 | Fe(OH) 3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)若要除去酸性MgCl2溶液中的FeCl3,则可以加入的试剂是
A.NaOH B.Mg(OH)2 C.MgCO3 D. NH3・H2O
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】(1)砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有 ,其原因是
,其原因是____________ 。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图1和题图2所示。

①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____ 。
②H3AsO4第一步电离方程式H3AsO4 H2AsO4−+H+的电离常数为Ka1,则pKa1=
H2AsO4−+H+的电离常数为Ka1,则pKa1=____ (pKa1=-lgKa1)。
(3)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是______ 。
A.0.1mol/L CH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.含等物质的量的NaX和弱酸HX的混合溶液中一定存在:c(Na+)>c(X-)
C.0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
D.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+)
(4)下列图示与对应的叙述不相符的是______ 。

A.图1表示可逆反应“2X(g) Y(g)△H<0”温度T1<T2的情形
Y(g)△H<0”温度T1<T2的情形
B.图2表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙压强比甲压强大
3C(g)+D(s)的影响,乙压强比甲压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20 mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
 ,其原因是
,其原因是(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图1和题图2所示。

①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为
②H3AsO4第一步电离方程式H3AsO4
 H2AsO4−+H+的电离常数为Ka1,则pKa1=
H2AsO4−+H+的电离常数为Ka1,则pKa1=(3)25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.1mol/L CH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.含等物质的量的NaX和弱酸HX的混合溶液中一定存在:c(Na+)>c(X-)
C.0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
D.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+)
(4)下列图示与对应的叙述不相符的是

A.图1表示可逆反应“2X(g)
 Y(g)△H<0”温度T1<T2的情形
Y(g)△H<0”温度T1<T2的情形B.图2表示压强对可逆反应2A(g)+2B(g)
 3C(g)+D(s)的影响,乙压强比甲压强大
3C(g)+D(s)的影响,乙压强比甲压强大C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20 mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】(1)下列溶液一定呈中性的是________ 。
A.pH=7的溶液 B.c(H+)=10-7 mol·L-1的溶液
C.c(H+)/c(OH-)=10-14的溶液 D.氨水和氯化铵的混合液中c(NH4+)=c(Cl-)
(2)已知T ℃时,Kw=1×10-13,则T ℃________ 25 ℃(填“>”、“ <” 或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________ 。
(3)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:若x+y=13,则 a/b=________ (填数据);
(4)①某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算该NaOH溶液的物质的量浓度________ mol·L-1。
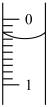
②某次滴定前滴定管液面如图所示,读数为________ mL。
③若酚酞作指示剂,滴定终点现象是_______________________________ 。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________ (填字母)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
A.pH=7的溶液 B.c(H+)=10-7 mol·L-1的溶液
C.c(H+)/c(OH-)=10-14的溶液 D.氨水和氯化铵的混合液中c(NH4+)=c(Cl-)
(2)已知T ℃时,Kw=1×10-13,则T ℃
(3)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:若x+y=13,则 a/b=
(4)①某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据计算该NaOH溶液的物质的量浓度
②某次滴定前滴定管液面如图所示,读数为

③若酚酞作指示剂,滴定终点现象是
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题
(1)工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_______
(2)有pH均为2的CH3COOH、HCl、H2SO4 三种物质的溶液,物质的量浓度由大到小的顺序为_______ ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是_______ 。
(3)NaHSO3溶液显酸性的原因是_______ (用化学用语和必要的文字说明)。
(4)常温时,BaSO4的Ksp=1.08×10-10。现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为_______ 。
(5)下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_______ (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液 c.加入少量醋酸钠晶体
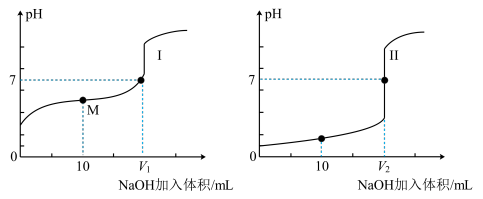
(6)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。图中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______ 。
(1)工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(2)有pH均为2的CH3COOH、HCl、H2SO4 三种物质的溶液,物质的量浓度由大到小的顺序为
(3)NaHSO3溶液显酸性的原因是
(4)常温时,BaSO4的Ksp=1.08×10-10。现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为
(5)下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是
a.滴加少量浓盐酸 b.微热溶液 c.加入少量醋酸钠晶体
(6)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。图中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】硫酸、盐酸、醋酸、碳酸、氨水及其盐是生活中常见的物质。
(1)等浓度的五种溶液①(NH4)2CO3、②NH4Cl、③NH4HSO4、④CH3COONH4、⑤NH3·H2O,则c( )由大到小排列的顺序为
)由大到小排列的顺序为_________ (用序号比较)。
(2)25°C时,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确的是 。
(3)25°C时,pH均等于4的醋酸溶液和氯化铵溶液,醋酸溶液中水电离出的H+浓度与氯化铵溶液中水电离出的H+浓度之比是_________ 。
(4)①常温下,pH=5的NaHSO4溶液中水的电离程度______ pH=9的NH3·H2O中水的电离程度(填“>”“=”或“<”);
②等体积等物质的量浓度的NaHSO4与氨水混合后溶液呈____ 性 (填“酸、中、碱”),针对该混合溶液下列说法正确的是_________ (填选项代号)。
A.c( )+c(H+)=c(
)+c(H+)=c( )+c(OH- )
)+c(OH- )
B. c(Na+)=c(H+)+c( )
)
C. c( )=c(
)=c( )+c(NH3·H2O)
)+c(NH3·H2O)
③常温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+ )+c( )
)______ 2c( ) (填“>”“=”或“<”);
) (填“>”“=”或“<”);
④常温下,向100mL0.2mol·L-1NaHSO4溶液加入0.2mol·L-1Ba(OH)2溶液,则 恰好完全沉淀时溶液的pH=
恰好完全沉淀时溶液的pH=________ 。
(1)等浓度的五种溶液①(NH4)2CO3、②NH4Cl、③NH4HSO4、④CH3COONH4、⑤NH3·H2O,则c(
 )由大到小排列的顺序为
)由大到小排列的顺序为(2)25°C时,浓度均为0.1mol·L-1的盐酸和醋酸溶液,下列说法正确的是 。
| A.两溶液的pH相同 |
| B.两溶液的导电能力相同 |
| C.两溶液中由水电离出的c(OH-)相同 |
| D.中和等物质的量的NaOH,消耗两溶液的体积相同 |
(4)①常温下,pH=5的NaHSO4溶液中水的电离程度
②等体积等物质的量浓度的NaHSO4与氨水混合后溶液呈
A.c(
 )+c(H+)=c(
)+c(H+)=c( )+c(OH- )
)+c(OH- )B. c(Na+)=c(H+)+c(
 )
)C. c(
 )=c(
)=c( )+c(NH3·H2O)
)+c(NH3·H2O)③常温下,若一定量的NaHSO4溶液与氨水混合后,溶液pH=7,则c(Na+ )+c(
 )
) ) (填“>”“=”或“<”);
) (填“>”“=”或“<”);④常温下,向100mL0.2mol·L-1NaHSO4溶液加入0.2mol·L-1Ba(OH)2溶液,则
 恰好完全沉淀时溶液的pH=
恰好完全沉淀时溶液的pH=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】在一定温度下,有a、盐酸b、硫酸c、醋酸三种酸(用a、b、c填空):
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是__ 。
(2)若三者pH相同时,中和等体积的该三种溶液所需NaOH的物质的量由大到小的顺序是___ 。
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是__ 。
(4)在25℃下,将amol/L的醋酸与0.01mol/L的NaOH溶液等体积混合后溶液的pH=7,用含a的代数式表示25℃时CH3COOH的电离常数Ka=__ 。
(5)设计一个实验证明醋酸是弱电解质:
操作:__ ;
现象:__ ;
结论:醋酸是弱电解质。
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是
(2)若三者pH相同时,中和等体积的该三种溶液所需NaOH的物质的量由大到小的顺序是
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序是
(4)在25℃下,将amol/L的醋酸与0.01mol/L的NaOH溶液等体积混合后溶液的pH=7,用含a的代数式表示25℃时CH3COOH的电离常数Ka=
(5)设计一个实验证明醋酸是弱电解质:
操作:
现象:
结论:醋酸是弱电解质。
您最近一年使用:0次



