环戊二烯(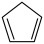 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: (g) =
(g) = 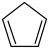 (g)+H2(g) ΔH1=100.3 kJ·mol −1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②,对于反应
(g)+H2(g) ΔH1=100.3 kJ·mol −1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②,对于反应 (g)+ I2(g) =
(g)+ I2(g) =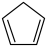 (g)+2HI(g) ③ΔH3=
(g)+2HI(g) ③ΔH3=___________ kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯( )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为___ ,该反应的平衡常数Kp=____ Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有_____ (填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 E.使用合适催化剂
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是____ (填标号)。
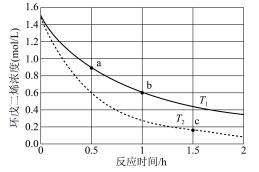
A.T1>T2 B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率 D.b点时二聚体的浓度为0.45 mol·L−1
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:(1)已知:
 (g) =
(g) =  (g)+H2(g) ΔH1=100.3 kJ·mol −1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②,对于反应
(g)+H2(g) ΔH1=100.3 kJ·mol −1 ①,H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②,对于反应 (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ΔH3=
(g)+2HI(g) ③ΔH3=(2)某温度下,等物质的量的碘和环戊烯(
 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了30%,环戊烯的转化率为A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度 E.使用合适催化剂
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是

A.T1>T2 B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率 D.b点时二聚体的浓度为0.45 mol·L−1
更新时间:2019-10-29 21:51:13
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________ ,ΔH3=______________ kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g) 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。
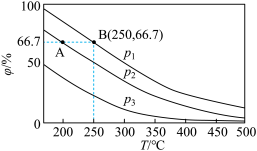
①其中,p1、p2和p3由大到小的顺序是______________________________ ,其原因是__________________________________________________________________ 。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________ vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2的分压p(N2)为_____________________ Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O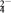 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

(3)①阴极区的电极反应式为_________________________________ 。
②NO吸收转化后的主要产物为NH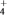 ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________ mL。
Ⅳ、常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________ (用含a和b的代数式表示)。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②二氧化碳重整:CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③则反应①自发进行的条件是
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)
 2NH3(g)。
2NH3(g)。(2)在不同温度、压强和相同催化剂条件下,初始N2、H2分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。

①其中,p1、p2和p3由大到小的顺序是
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)
③若在250 ℃、p1为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2的分压p(N2)为
Ⅲ.以连二硫酸根(S2O
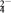 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
(3)①阴极区的电极反应式为
②NO吸收转化后的主要产物为NH
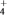 ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为Ⅳ、常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=
您最近一年使用:0次
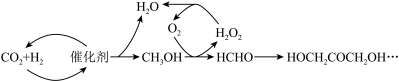
【推荐2】为尽快实现“碳达峰”“碳中和”,碳化学研究已成为当前科学研究的热点。由CO2合成淀粉的部分流程如图所示:
①
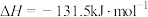
②
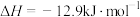
③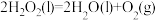
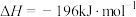
④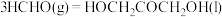
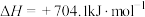
回答下列问题:
(1)反应①中,反应物的总能量_______ (填“大于”、“小于”或“等于”,下同)生成物的总能量,反应④中,反应物的总键能_______ 生成物的总键能。
(2)反应①中使用催化剂的作用有_______ (填标号);
a.有效降低了反应活化能 b.提高了的平衡转化率 c.加快了反应①的反应速率
(3)CO2合成淀粉过程中,当有1kgCO2转化为HOCH2COCH2OH时,理论上反应体系共需向外界_______ (填“吸收”或“放出”)的热量为______ kJ。(所有能量均充分利用,且不考㤐能量的损耗)
①

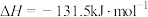
②

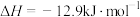
③
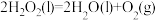
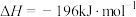
④
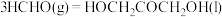
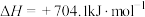
回答下列问题:
(1)反应①中,反应物的总能量
(2)反应①中使用催化剂的作用有
a.有效降低了反应活化能 b.提高了的平衡转化率 c.加快了反应①的反应速率
(3)CO2合成淀粉过程中,当有1kgCO2转化为HOCH2COCH2OH时,理论上反应体系共需向外界
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在密闭容器中进行反应:①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g)
FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g) 2CO2(g) △H2=bkJ·mol-1
2CO2(g) △H2=bkJ·mol-1
(1)写出铁块与氧气生成1mol氧化亚铁固体的热化学方程式____ 。
(2)反应①的化学平衡常数表达式K=___ ,已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为___ ,CO的平衡浓度为____ 。
(3)反应②的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3时都达到了平衡,而t2、t4时都只改变了一种条件,试判断改变的条件:t2时___ ;t4时____ 。

 FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g)
FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g) 2CO2(g) △H2=bkJ·mol-1
2CO2(g) △H2=bkJ·mol-1(1)写出铁块与氧气生成1mol氧化亚铁固体的热化学方程式
(2)反应①的化学平衡常数表达式K=
(3)反应②的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3时都达到了平衡,而t2、t4时都只改变了一种条件,试判断改变的条件:t2时

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下:

(1)写出吸收池中主要反应的离子方程式__________________ ;
在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式_________________ 。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括_____________ 。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式____________ 。当电子转移的物质的量为___________ 时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=______________ ;此时在B点时容器的体积VB______ 10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA______ tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高 CO转化率可采取的措施是_______________ (答出两点即可)。

(1)写出吸收池中主要反应的离子方程式
在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式
(4)工业上常以CO和H2为主要原料,生产甲醇。某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)
 CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA
③在不改变反应物用量情况下,为提高 CO转化率可采取的措施是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下方法来合成甲醇:
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:____________________ 。
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ⇌CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。
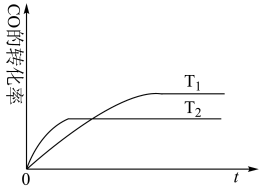
①该反应的焓变ΔH__________ 0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________ 。
(3)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是________________________ ,正极发生的电极反应式是_______________________ 。
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ⇌CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH
②T1和T2温度下的平衡常数大小关系是K1
③若容器容积不变,下列措施可增加甲醇产率的是
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.使用合适的催化剂 | D.充入He,使体系总压强增大 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】在一定条件下,向容积为2L的恒容密闭容器中充入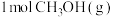 和
和 ,
,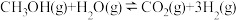
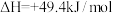 。实验测得:5min达到平衡状态时,吸收热量24.7 kJ。则
。实验测得:5min达到平衡状态时,吸收热量24.7 kJ。则
(1)用 表示5min内的反应速率
表示5min内的反应速率_______ 。
(2)该条件下反应到达平衡时, 的转化率为
的转化率为_______ ,混合气体的压强是反应前的_______ 倍。
(3)该条件下判断该反应达平衡状态的依据是(填序号)_______ 。
a. b.混合气体的密度不变
b.混合气体的密度不变
c.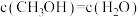 d.混合气体的总物质的量不变
d.混合气体的总物质的量不变
(4)将体积压缩为原来的一半,下列描述正确的是_______ 。
a.正反应速率减小,逆反应速率增大 b.正反应速率增大,逆反应速率增大
c.正反应速率小于逆反应速率 d. 减小
减小
(5)达到平衡后,在相同条件下,再向容器中充入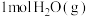 和
和 ,化学平衡
,化学平衡_______ 移动(填“正向”、“逆向”或“不”)。
(6)肼可作为火箭发动机的燃料,与氧化剂 反应生成
反应生成 和水蒸气。
和水蒸气。
已知:①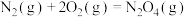
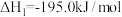
②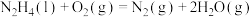
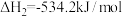
写出肼和 反应的热化学方程式
反应的热化学方程式_______ 。
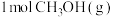 和
和 ,
,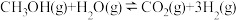
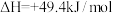 。实验测得:5min达到平衡状态时,吸收热量24.7 kJ。则
。实验测得:5min达到平衡状态时,吸收热量24.7 kJ。则(1)用
 表示5min内的反应速率
表示5min内的反应速率(2)该条件下反应到达平衡时,
 的转化率为
的转化率为(3)该条件下判断该反应达平衡状态的依据是(填序号)
a.
 b.混合气体的密度不变
b.混合气体的密度不变c.
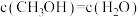 d.混合气体的总物质的量不变
d.混合气体的总物质的量不变(4)将体积压缩为原来的一半,下列描述正确的是
a.正反应速率减小,逆反应速率增大 b.正反应速率增大,逆反应速率增大
c.正反应速率小于逆反应速率 d.
 减小
减小(5)达到平衡后,在相同条件下,再向容器中充入
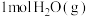 和
和 ,化学平衡
,化学平衡(6)肼可作为火箭发动机的燃料,与氧化剂
 反应生成
反应生成 和水蒸气。
和水蒸气。已知:①
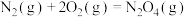
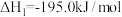
②
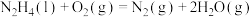
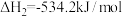
写出肼和
 反应的热化学方程式
反应的热化学方程式
您最近一年使用:0次
【推荐1】研究CO、CO2的转化既可减少碳排放,又可获得许多实用的含碳物质。回答下列问题:
(1)以CO2、H2为原料,在铜基催化剂作用下可合成甲醇,反应如下(不考虑副反应):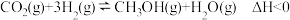 ,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
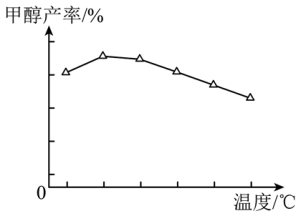
①该反应自发进行的条件是___________ (填“高温”“低温”或“任意温度”)。
②甲醇产率随温度升高先增大后减小的原因是___________ 。
(2)以CO、H2为原料在一定条件下也可合成甲醇,发生的反应如下:
主反应:
副反应:
一定条件下,向体积为V L的恒容密闭容器中投入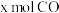 和
和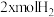 ,发生上述反应,平衡时容器内CH3OH的物质的量为
,发生上述反应,平衡时容器内CH3OH的物质的量为 ,C的物质的量为
,C的物质的量为 。则主反应的平衡常数K=
。则主反应的平衡常数K=___________ 。
(3)我国科学家设计 熔盐捕获与转化装置如图所示:
熔盐捕获与转化装置如图所示:
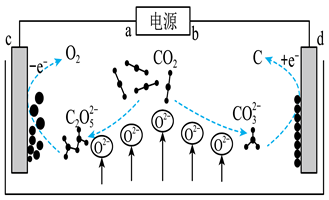
①d极的电极反应式为___________ 。
②若电源使用铅蓄电池,当电路中转移2 mol电子时,Pb电极的质量理论上___________ (填“增加”或“减少”)了____ g。
(4)水煤气变换是重要的化工过程,反应为: 。已知该反应的平衡常数K与热力学温度T的关系为
。已知该反应的平衡常数K与热力学温度T的关系为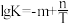 (m、n均为正数)。
(m、n均为正数)。
①水煤气变换是____ (填“吸热”或“放热”)反应。
②热力学温度为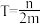 时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为
时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为 ,则
,则____ (填标号)。
A.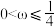 B.
B.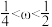 C.
C.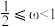
(1)以CO2、H2为原料,在铜基催化剂作用下可合成甲醇,反应如下(不考虑副反应):
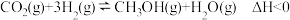 ,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
,反应在恒容密闭容器中进行。反应时间一定,甲醇的产率随温度的变化如图所示(不考虑此过程中催化剂活性的变化)。
①该反应自发进行的条件是
②甲醇产率随温度升高先增大后减小的原因是
(2)以CO、H2为原料在一定条件下也可合成甲醇,发生的反应如下:
主反应:

副反应:

一定条件下,向体积为V L的恒容密闭容器中投入
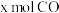 和
和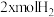 ,发生上述反应,平衡时容器内CH3OH的物质的量为
,发生上述反应,平衡时容器内CH3OH的物质的量为 ,C的物质的量为
,C的物质的量为 。则主反应的平衡常数K=
。则主反应的平衡常数K=(3)我国科学家设计
 熔盐捕获与转化装置如图所示:
熔盐捕获与转化装置如图所示:
①d极的电极反应式为
②若电源使用铅蓄电池,当电路中转移2 mol电子时,Pb电极的质量理论上
(4)水煤气变换是重要的化工过程,反应为:
 。已知该反应的平衡常数K与热力学温度T的关系为
。已知该反应的平衡常数K与热力学温度T的关系为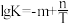 (m、n均为正数)。
(m、n均为正数)。①水煤气变换是
②热力学温度为
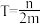 时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为
时,在恒温密闭容器中将等物质的量的CO和H2O(g)混合,选择适当的催化剂进行反应。平衡时体系中H2的物质的量分数为 ,则
,则A.
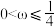 B.
B.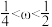 C.
C.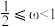
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】碳及其化合物种类繁多,用途广泛。根据要求,回答下列问题:
(1)碳在氧气或臭氧中燃烧的能量变化如图所示:
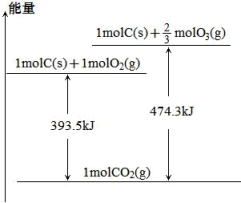
试判断:16gO3(g)全部转化为O2(g)需_______ (填“吸收”或“放出”)热量_______ kJ。
(2)用二氧化碳和丙烷(C3H8)为原料可制备丙烯(C3H6)。一定温度下,向2L恒容密闭容器中通入4molCO2(g)和3molC3H8(g),发生反应:CO2(g)+C3H8(g)⇌C3H6(g)+CO(g)+H2O(g),测得C3H8的物质的量随时间的变化如表所示。
①0~5min内C3H6的平均生成速率为_______ 。
②达平衡时CO2的转化率为_______ 。
③平衡时与初始时容器内压强的比值为_______ (保留两位小数)。
(3)新型高效的甲烷燃料电池采用铂为电极材料,两电极分别通入甲烷和氧气。碱性甲烷燃料电池结构示意图如图所示。
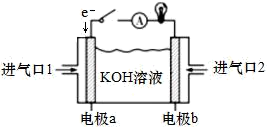
①电极a为_______ (填“正极”或“负极”),电极反应式为___ 。
②当消耗标准状况下5.6L甲烷时,若电池的能量转化效率为90%,则导线中转移电子的个数为___ 。
(1)碳在氧气或臭氧中燃烧的能量变化如图所示:

试判断:16gO3(g)全部转化为O2(g)需
(2)用二氧化碳和丙烷(C3H8)为原料可制备丙烯(C3H6)。一定温度下,向2L恒容密闭容器中通入4molCO2(g)和3molC3H8(g),发生反应:CO2(g)+C3H8(g)⇌C3H6(g)+CO(g)+H2O(g),测得C3H8的物质的量随时间的变化如表所示。
| t/min | 0 | 5 | 10 | 15 | 20 |
| n(C3H8)/mol | 3 | 2.1 | 1.5 | 1.2 | 1.2 |
①0~5min内C3H6的平均生成速率为
②达平衡时CO2的转化率为
③平衡时与初始时容器内压强的比值为
(3)新型高效的甲烷燃料电池采用铂为电极材料,两电极分别通入甲烷和氧气。碱性甲烷燃料电池结构示意图如图所示。

①电极a为
②当消耗标准状况下5.6L甲烷时,若电池的能量转化效率为90%,则导线中转移电子的个数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】文献报道:利用氯化氢氧化反应一脱水耦合工艺,可用有机氯化工艺的副产品氯化氢为原料制备氯气,实现氯的循环利用,原理为4HCl(g)+O2(g) 2Cl2(g)+2H2O(g).将HCl和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化率影响的曲线如图.
2Cl2(g)+2H2O(g).将HCl和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化率影响的曲线如图.
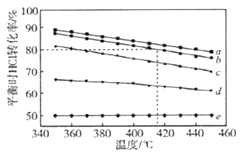
请回答下列问题:
(1)可以判断该反应已经达到化学平衡的是__ . (填字母).
A.密闭容器中总压强不变 B.密闭容器中混合气体的密度不变
C.v(HCl)=2v(Cl2) D.密闭容器中氯气的体积分数不变
(2)d曲线对应的投料比是__ (填比值,从题干中选择,下同).有机工业需要含O2量低的氧气和氯化氢混合气体,可控制n(HCl):n(O2)=_______ 制备.
(3)该反应的平衡常数表达式为________ .
(4)若按b曲线对应的投料比进行反应,且温度为415℃,反应达到平衡时Cl2的体积分数为_______ .
 2Cl2(g)+2H2O(g).将HCl和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化率影响的曲线如图.
2Cl2(g)+2H2O(g).将HCl和O2分别以5种物质的量比:①1:1 ②2:1 ③4:1 ④6:1 ⑤8:1,向五个容积可变的容器中投料时,反应温度对HCl平衡转化率影响的曲线如图.
请回答下列问题:
(1)可以判断该反应已经达到化学平衡的是
A.密闭容器中总压强不变 B.密闭容器中混合气体的密度不变
C.v(HCl)=2v(Cl2) D.密闭容器中氯气的体积分数不变
(2)d曲线对应的投料比是
(3)该反应的平衡常数表达式为
(4)若按b曲线对应的投料比进行反应,且温度为415℃,反应达到平衡时Cl2的体积分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)捕集处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料,已知:①CO(g)+H2O(g) CO2(g)+H2(g),△H1=-41.0kJ•mol-1,②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1,③CH3OCH2(g)+H2O(g)
CO2(g)+H2(g),△H1=-41.0kJ•mol-1,②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1,③CH3OCH2(g)+H2O(g)  2CH3OH(g)△H3=+23.5kJ•mol-1,则反应2CO(g)+4H2(g)
2CH3OH(g)△H3=+23.5kJ•mol-1,则反应2CO(g)+4H2(g)  CH3OCH2(g)+H2O(g)的△H=
CH3OCH2(g)+H2O(g)的△H=______ 。
(2)采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如下表,依据表中数据,写出NaClO2溶液脱硝过程中发生的总反应的离子方程式:______ 。
(3)已知973K时,SO2与NO2反应生成SO3和NO,混合气体经冷凝分离出的SO3可用于制备硫酸。
①973K时测得:NO2(g) NO(g)+1/2O2(g)K1=0.018;SO2(g)1/2+O2(g)⇌SO3(g)K3=20.则反应SO2(g)+NO2(g)
NO(g)+1/2O2(g)K1=0.018;SO2(g)1/2+O2(g)⇌SO3(g)K3=20.则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=
SO3(g)+NO(g)的K3=______ 。
②973K时,向体积为1L的恒容密闭容器中充入SO2、NO2各aml,平衡时SO2的转化率为______ 。
③恒压下SO2的分压p(SO2)随温度的变化如图所示。当温度升高时,SO2(g)+NO2(g) SO2(g)+NO(g)的化学平衡常数
SO2(g)+NO(g)的化学平衡常数______ (填“增大”或”减小”),判断理由是______ 。
(4)用纳米铁可去除污水中的NO ,反应的离子方程式为4Fe+NO
,反应的离子方程式为4Fe+NO +10H+=4Fe2++NH
+10H+=4Fe2++NH +3H2O;相同温度下,纳米铁粉去除不同水样中的NO
+3H2O;相同温度下,纳米铁粉去除不同水样中的NO 的速率有较大差异,下表中Ⅰ和Ⅱ产生差异的原因可能是
的速率有较大差异,下表中Ⅰ和Ⅱ产生差异的原因可能是______ ;II中0~20min内用NO 表示的平均反应速率为
表示的平均反应速率为______ mol•L-1•min-1。
(1)捕集处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料,已知:①CO(g)+H2O(g)
 CO2(g)+H2(g),△H1=-41.0kJ•mol-1,②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1,③CH3OCH2(g)+H2O(g)
CO2(g)+H2(g),△H1=-41.0kJ•mol-1,②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1,③CH3OCH2(g)+H2O(g)  2CH3OH(g)△H3=+23.5kJ•mol-1,则反应2CO(g)+4H2(g)
2CH3OH(g)△H3=+23.5kJ•mol-1,则反应2CO(g)+4H2(g)  CH3OCH2(g)+H2O(g)的△H=
CH3OCH2(g)+H2O(g)的△H=(2)采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如下表,依据表中数据,写出NaClO2溶液脱硝过程中发生的总反应的离子方程式:
离子 | NO | NO | Cl- |
c/(mol•L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①973K时测得:NO2(g)
 NO(g)+1/2O2(g)K1=0.018;SO2(g)1/2+O2(g)⇌SO3(g)K3=20.则反应SO2(g)+NO2(g)
NO(g)+1/2O2(g)K1=0.018;SO2(g)1/2+O2(g)⇌SO3(g)K3=20.则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=
SO3(g)+NO(g)的K3=②973K时,向体积为1L的恒容密闭容器中充入SO2、NO2各aml,平衡时SO2的转化率为
③恒压下SO2的分压p(SO2)随温度的变化如图所示。当温度升高时,SO2(g)+NO2(g)
 SO2(g)+NO(g)的化学平衡常数
SO2(g)+NO(g)的化学平衡常数(4)用纳米铁可去除污水中的NO
 ,反应的离子方程式为4Fe+NO
,反应的离子方程式为4Fe+NO +10H+=4Fe2++NH
+10H+=4Fe2++NH +3H2O;相同温度下,纳米铁粉去除不同水样中的NO
+3H2O;相同温度下,纳米铁粉去除不同水样中的NO 的速率有较大差异,下表中Ⅰ和Ⅱ产生差异的原因可能是
的速率有较大差异,下表中Ⅰ和Ⅱ产生差异的原因可能是 表示的平均反应速率为
表示的平均反应速率为反应时间/min | 0 | 10 | 20 | 30 | 40 | |
| I | c(NO | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
| II | c(NO | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是___ 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式__ 。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为_________ 。
(4)化学反应3A2(g)+C2(g) 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是_______ 。温度为T℃时,将4amolA2和2amolC2放入1L密闭容器中,充分反应后测得C2的转化率为50%,则反应的平衡常数_______ 。

(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为
(4)化学反应3A2(g)+C2(g)
 2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
2CA3(g)。当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】我国政府承诺,到2020年,单位GDP CO2排放量比2005年下降40%-45%。请回答下列问题:
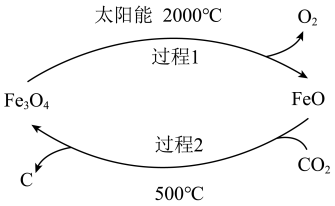
(1)利用太阳能工艺可将Fe3O4转化为FeO,然后利用FeO捕获CO2可得炭黑,其流程如上图所示。该循环中Fe3O4可视为_______ (填“催化剂”、“中间产物”),过程2捕获1molCO2转移电子的物质的量是_______ mol。
(2)以CO2和NH3为原料合成尿素[CO(NH2)2],反应如下:
2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-1595kJ·mol-1
H2NCOONH4 (s)=CO(NH2)2(s)+H2O(g) ΔH=+1165kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
CO2(g)与NH3(g)合成尿素和液态水的热化学方程式_______________________ ;
(3)CH4-CO2催化重整可以得到燃料CO和H2。一定条件下在恒容的密闭容器中发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是
2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是______ (填字母序号)。
A.CO2和CH4的浓度相等
B.v正(CO2)=2v逆(CO)
C.每断裂4molC—H键的同时,断裂2molH—H键
D.容器中混合气体的平均相对分子质量保持不变
E.容器中混合气体的密度保持不变
(4)CO2是一种温室气体,但其本身无毒,处理废气时常将一些有毒物质转化为CO2。一定温度下,在三个容积均为2.0 L的密闭容器中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
不同温度下,容器中各物质起始和平衡时的物质的量如下表所示:
下列说法正确的是___________
A.该反应的正反应为吸热反应
B.50℃时,若起始时向甲中充入0.1 mol N2和0.2 mol CO2,则达平衡时N2的转化率为40%
C.100℃时,若起始时向乙中充入的NO、CO、N2和CO2均为0.40 mol,则此时v正>v逆
D.达到平衡时,丙中CO2的体积分数比乙中的小

(1)利用太阳能工艺可将Fe3O4转化为FeO,然后利用FeO捕获CO2可得炭黑,其流程如上图所示。该循环中Fe3O4可视为
(2)以CO2和NH3为原料合成尿素[CO(NH2)2],反应如下:
2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-1595kJ·mol-1
H2NCOONH4 (s)=CO(NH2)2(s)+H2O(g) ΔH=+1165kJ·mol-1
H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
CO2(g)与NH3(g)合成尿素和液态水的热化学方程式
(3)CH4-CO2催化重整可以得到燃料CO和H2。一定条件下在恒容的密闭容器中发生反应:CO2(g)+CH4(g)
 2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是
2CO(g)+2H2(g)能够说明上述反应已达到平衡状态的是A.CO2和CH4的浓度相等
B.v正(CO2)=2v逆(CO)
C.每断裂4molC—H键的同时,断裂2molH—H键
D.容器中混合气体的平均相对分子质量保持不变
E.容器中混合气体的密度保持不变
(4)CO2是一种温室气体,但其本身无毒,处理废气时常将一些有毒物质转化为CO2。一定温度下,在三个容积均为2.0 L的密闭容器中发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g)
N2(g)+2CO2(g)不同温度下,容器中各物质起始和平衡时的物质的量如下表所示:
| 容器 | 温度/℃ | 起始物质的量/mol | 平衡时物质的量/mol | |
| NO(g) | CO(g) | CO2 | ||
| 甲 | 50 | 0.2 | 0.2 | 0.12 |
| 乙 | 100 | 0.2 | 0.2 | 0.1 |
| 丙 | 100 | 0.3 | 0.3 | |
A.该反应的正反应为吸热反应
B.50℃时,若起始时向甲中充入0.1 mol N2和0.2 mol CO2,则达平衡时N2的转化率为40%
C.100℃时,若起始时向乙中充入的NO、CO、N2和CO2均为0.40 mol,则此时v正>v逆
D.达到平衡时,丙中CO2的体积分数比乙中的小
您最近一年使用:0次




