高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
下列说法不正确的是( )
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A.在冰醋酸中这四种酸都是弱酸 |
| B.在冰醋酸中可能发生:HClO4+NaHSO4=NaClO4+H2SO4 |
| C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++ SO42- |
| D.酸性:HCl>HNO3 |
更新时间:2019-11-13 12:07:44
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】室温下,浓度均为0.1mol/L.体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与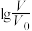 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

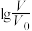 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
| A.HX、HY都是弱酸,且Ka(HX)>Ka(HY) |
B.图中pOH随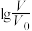 变化始终满足直线关系 变化始终满足直线关系 |
C.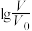 =3时,NaX溶液中所含离子总数小于NaY溶液 =3时,NaX溶液中所含离子总数小于NaY溶液 |
| D.分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知部分弱酸的电离平衡常数如表所示:
下列离子方程式正确的是
| 弱酸 | CH3COOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.80×10-5 | Ka=2.95×10-8 | Ka1=4.30×10-7 Ka2=5.60×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-= +2HClO +2HClO |
| B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
C.少量SO2通入Na2CO3溶液中:SO2+H2O+2 = = +2 +2 |
D.相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++ =CO2↑+H2O =CO2↑+H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】常温下,体积均为1L的HA、HB的两种一元酸溶液,分别向其中加水稀释至体积V,pH随lgV的变化关系如图所示。下列说法正确的是
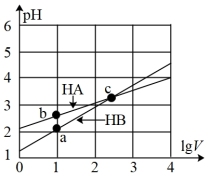

| A.HA是弱酸,HB是强酸 |
| B.相同温度、相同浓度的NaA、NaB溶液的pH,后者大 |
| C.c点处,分别加入足量的锌粒,HA中产生氢气多 |
| D.a、b、c三点,由水电离出来的c(H+)·c(OH-)相等 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】25℃,分别取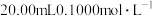 一元酸HA、HB、HC,向其中逐滴滴入
一元酸HA、HB、HC,向其中逐滴滴入 溶液,并测出溶液pH随V(NaOH)/mL的变化如图。下列说法不正确的是
溶液,并测出溶液pH随V(NaOH)/mL的变化如图。下列说法不正确的是

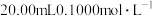 一元酸HA、HB、HC,向其中逐滴滴入
一元酸HA、HB、HC,向其中逐滴滴入 溶液,并测出溶液pH随V(NaOH)/mL的变化如图。下列说法不正确的是
溶液,并测出溶液pH随V(NaOH)/mL的变化如图。下列说法不正确的是
| A.反应完全后,若继续分别滴入NaOH溶液,溶液的pH主要取决于过量NaOH浓度 |
| B.反应完全后,各混合液的pH均大于7 |
| C.中和滴定实验中,HA被同浓度NaOH溶液滴定时误差最小 |
| D.反应完全后,将三种溶液混合均匀:c(HA)+c(HB)+c(HC)+c(H+)+0.05=c(OH-)+c(Na+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列说法正确的是
| A.随温度升高,纯水中c(H+)=c(OH-),pH不变 |
| B.相同条件下,同浓度同体积的HCl和CH3COOH溶液,HCl溶液的导电性好;稀释相同倍数后,CH3COOH溶液导电性好 |
| C.常温下,某盐溶液pH<7,则该盐一定是酸式盐 |
| D.已知CH3COONH4溶液呈中性,则c(CH3COOH)-c(OH-)=c(NH3·H2O)-c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列有关叙述中正确的是
| A.强电解质的水溶液中不存在电离平衡 |
| B.用pH试纸测得氯水的pH为4 |
| C.易溶于水的电解质一定是强电解质 |
| D.共价化合物可能为强电解质,如H2SO4 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】NA为阿伏加德罗常数的值,下列说法正确的是
| A.18gH218O中含有的质子数为10NA |
| B.标准状况下,2.24L乙烯与Br2完全反应,断裂共价键总数为0.1NA |
| C.2.3g钠用铝箔包裹与足量水反应,生成H2分子数为0.05NA |
| D.1L2mol/LH3PO4溶液中H+离子数小于2NA |
您最近一年使用:0次

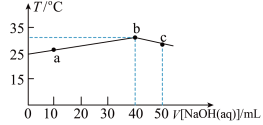
 的
的 溶液中加水稀释,并测定
溶液中加水稀释,并测定
 的水解是吸热过程
的水解是吸热过程 与稀硫酸反应体系中加少许
与稀硫酸反应体系中加少许 溶液
溶液 溶液中滴加2滴
溶液中滴加2滴 溶液,再滴加2滴
溶液,再滴加2滴 溶液
溶液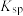 :
:


