“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221 kJ·mol-1
若某反应的平衡常数表达式为K=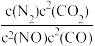 ,则此反应的热化学方程式为
,则此反应的热化学方程式为____________________ 。
(2)N2O5在一定条件下可发生分解反应:2N2O5(g) 4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=________ 。2~5 min内用NO2表示的该反应的平均反应速率为________________ 。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________________ (填字母)。
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g) NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________________ (用k正、k逆表示)。
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
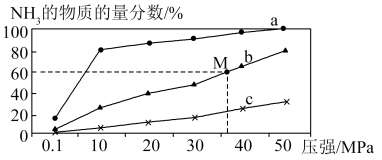
①曲线a对应的温度是________ 。
②M点对应的H2的转化率是________ 。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221 kJ·mol-1
若某反应的平衡常数表达式为K=
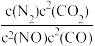 ,则此反应的热化学方程式为
,则此反应的热化学方程式为(2)N2O5在一定条件下可发生分解反应:2N2O5(g)
 4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/ (mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)
 NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。

①曲线a对应的温度是
②M点对应的H2的转化率是
2019高三·全国·专题练习 查看更多[6]
(已下线)第七单元单元测试(测)-《2020年高考一轮复习讲练测》1(已下线)第24讲 化学平衡常数及转化率的计算(精练)-2021年高考化学一轮复习讲练测山东省商河县第一中学2020-2021学年高二上学期期中考试化学试题福建省福州市福建师范大学附属中学2020-2021学年高二上学期期中考试化学试题(已下线)第20讲 化学平衡常数及转化率的计算(练) — 2022年高考化学一轮复习讲练测(新教材新高考)山东省济南市商河县第一中学2021-2022学年高三上学期11月期中考试化学试题
更新时间:2019-12-03 19:45:07
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下Al2O3(s)+AlCl3(g)+3C(s) =3AlCl (g)+3CO(g) △H = a kJ·mol-1
3AlCl(g)=2Al(l)+ AlCl3 (g) △H = b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________ kJ·mol-1(用含a、b的代数式表示)。
②Al4C3也是该反应过程中的一种中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为_______________ 。
③甲烷和水反应可以制水煤气(混合气体),在恒温、固定体积为V升的密闭容器中的反应微观示意图如下所示,根据微观示意图得出的结论中,正确的是_____________ 。
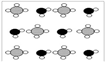
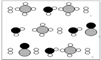
一定条件下经过t分钟达到化学平衡
a. 该反应方程式为:CH4+H2O = CO+3H2
b. 该反应平衡前后压强比为3:4
c. 该反应体系中含氢元素的化合物有3种
d. 该反应中甲烷的平衡转化率为50%
④水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g) [Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是____________________ 。该条件下用气体表示的平衡常数表达式为:K=______________
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,一般在氩气环境中将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下可完全吸氢得到的混合物Y(含MgH2 和Al),Y在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________ 。
②写出镁铝合金(Mg17Al12 ) 在一定条件下完全吸氢的化学方程式_________________ 。
③在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为_________ 。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下Al2O3(s)+AlCl3(g)+3C(s) =3AlCl (g)+3CO(g) △H = a kJ·mol-1
3AlCl(g)=2Al(l)+ AlCl3 (g) △H = b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=
②Al4C3也是该反应过程中的一种中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为
③甲烷和水反应可以制水煤气(混合气体),在恒温、固定体积为V升的密闭容器中的反应微观示意图如下所示,根据微观示意图得出的结论中,正确的是


一定条件下经过t分钟达到化学平衡
a. 该反应方程式为:CH4+H2O = CO+3H2
b. 该反应平衡前后压强比为3:4
c. 该反应体系中含氢元素的化合物有3种
d. 该反应中甲烷的平衡转化率为50%
④水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g)
 [Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)3]Ac·CO(aq) △H<0[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,一般在氩气环境中将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下可完全吸氢得到的混合物Y(含MgH2 和Al),Y在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
②写出镁铝合金(Mg17Al12 ) 在一定条件下完全吸氢的化学方程式
③在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知下列热化学方程式:
FeSO4·7H2O(s) FeSO4(s)+7H2O(g) ΔH1=akJ·mol−1
FeSO4(s)+7H2O(g) ΔH1=akJ·mol−1
FeSO4·xH2O(s) FeSO4(s)+xH2O(g) ΔH2=bkJ·mol−1
FeSO4(s)+xH2O(g) ΔH2=bkJ·mol−1
FeSO4·yH2O(s) FeSO4(s)+yH2O(g) ΔH3=ckJ·mol−1
FeSO4(s)+yH2O(g) ΔH3=ckJ·mol−1
则FeSO4·7H2O(s)+FeSO4·yH2O(s) 2FeSO4·xH2O(s)的ΔH=
2FeSO4·xH2O(s)的ΔH=_____ kJ·mol−1.
FeSO4·7H2O(s)
 FeSO4(s)+7H2O(g) ΔH1=akJ·mol−1
FeSO4(s)+7H2O(g) ΔH1=akJ·mol−1FeSO4·xH2O(s)
 FeSO4(s)+xH2O(g) ΔH2=bkJ·mol−1
FeSO4(s)+xH2O(g) ΔH2=bkJ·mol−1FeSO4·yH2O(s)
 FeSO4(s)+yH2O(g) ΔH3=ckJ·mol−1
FeSO4(s)+yH2O(g) ΔH3=ckJ·mol−1则FeSO4·7H2O(s)+FeSO4·yH2O(s)
 2FeSO4·xH2O(s)的ΔH=
2FeSO4·xH2O(s)的ΔH=
您最近一年使用:0次
【推荐3】NOx、CO是重要污染物,处理NOx、CO等污染物对建设美丽中国具有重要意义。回答下列问题。
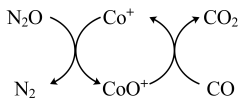
(1)已知CO(g)还原 的反应机理如图所示
的反应机理如图所示
已知:


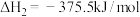
CO(g)与 反应的热化学方程式为
反应的热化学方程式为___________ 。
(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为 ,发生反应
,发生反应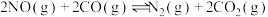 ,达到平衡时NO(g)和
,达到平衡时NO(g)和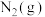 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为___________ (结果保留一位小数),该反应的化学平衡常数Kp=___________ 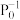 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,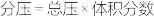 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则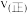
___________ 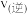 (填“>”“<”或“=”)
(填“>”“<”或“=”)
(3)对于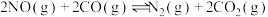 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
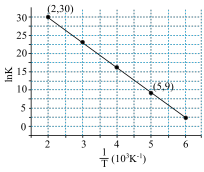
则该反应的活化能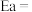
___________  。
。
(4)电解法转化 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
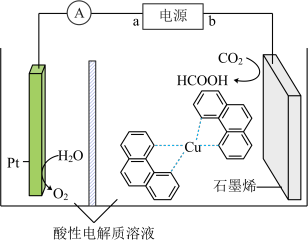
①a为电源的___________ (填“正极”或“负极”),该装置的阴极的电极反应式为___________ 。
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为___________ g。

(1)已知CO(g)还原
 的反应机理如图所示
的反应机理如图所示已知:



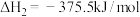
CO(g)与
 反应的热化学方程式为
反应的热化学方程式为(2)温度T℃,在恒容密闭容器中充入1:1的NO(g)和CO(g),测得此时压强为
 ,发生反应
,发生反应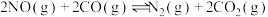 ,达到平衡时NO(g)和
,达到平衡时NO(g)和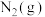 的物质的量之比为1:1,则平衡时CO的转化率为
的物质的量之比为1:1,则平衡时CO的转化率为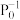 (
( 表示以分压表示的平衡常数,
表示以分压表示的平衡常数,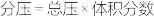 )。若T℃时,向某容器中同时充入NO、CO、
)。若T℃时,向某容器中同时充入NO、CO、 、
、 各1mol,则
各1mol,则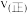
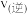 (填“>”“<”或“=”)
(填“>”“<”或“=”)(3)对于
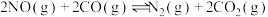 ,反应的活化能Ea,速率常数k满足Arrhenius公式
,反应的活化能Ea,速率常数k满足Arrhenius公式 ,其中R、C为常数,且
,其中R、C为常数,且 ,T为温度。上述反应的实验数据如图所示
,T为温度。上述反应的实验数据如图所示
则该反应的活化能
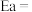
 。
。(4)电解法转化
 是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
是实现可再生能源有效利用的关键手段之一,其装置原理如图所示。
①a为电源的
②若电解开始前两极室溶液质量相等,当电解过程转移了2mol电子,则阴阳极室溶液质量差为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题。
Ⅰ.已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH=a kJ·mol-1;
CO(g)+ O2(g)===CO2(g) ΔH=b kJ·mol-1 ;
O2(g)===CO2(g) ΔH=b kJ·mol-1 ;
C(石墨)+O2(g)===CO2(g) ΔH=c kJ·mol-1
则反应:4Fe(s)+3O2(g)===2Fe2O3(s)的焓变ΔH=________ kJ·mol-1。
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是________ (填序号)。
A.C(s)+CO2(g)===2CO(g) B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
C.2H2O(l)===2H2(g)+O2(g) D.CH4(g)+2O2(g)===CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。负极:__________________ ,正极:______________________ 。
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:

已知:电解过程中发生的反应为NH4Cl+2HCl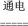 NCl3+3H2↑,NCl3中氮元素为+3价。
NCl3+3H2↑,NCl3中氮元素为+3价。
①写出电解时阴极的电极反应式______________________ 。
②写出电解时阳极的电极反应式______________________ 。
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的____________ 腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的________ (填“正”或“负”)极相连。利用______________ 保护法防止其被腐蚀。
Ⅰ.已知:Fe2O3(s)+3C(石墨)===2Fe(s)+3CO(g) ΔH=a kJ·mol-1;
CO(g)+
 O2(g)===CO2(g) ΔH=b kJ·mol-1 ;
O2(g)===CO2(g) ΔH=b kJ·mol-1 ; C(石墨)+O2(g)===CO2(g) ΔH=c kJ·mol-1
则反应:4Fe(s)+3O2(g)===2Fe2O3(s)的焓变ΔH=
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
A.C(s)+CO2(g)===2CO(g) B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
C.2H2O(l)===2H2(g)+O2(g) D.CH4(g)+2O2(g)===CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应。负极:
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂。ClO2是一种黄绿色气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:

已知:电解过程中发生的反应为NH4Cl+2HCl
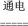 NCl3+3H2↑,NCl3中氮元素为+3价。
NCl3+3H2↑,NCl3中氮元素为+3价。①写出电解时阴极的电极反应式
②写出电解时阳极的电极反应式
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】已知:
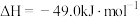 ,该反应一般通过如下步骤来实现:
,该反应一般通过如下步骤来实现:
①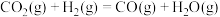

②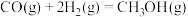
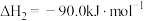
(1)反应①的
___________ 。
(2)反应①为慢反应,下列示意图中能体现该反应能量变化的是___________。
(3)若 和
和 按一定投料比发生反应
按一定投料比发生反应 ,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示。490K之后,甲醇产率下降,请分析其变化产生的原因:
,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示。490K之后,甲醇产率下降,请分析其变化产生的原因:
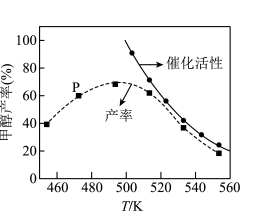
原因1:___________ 、原因2:___________ 。(任填2个原因)

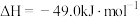 ,该反应一般通过如下步骤来实现:
,该反应一般通过如下步骤来实现:①
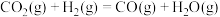

②
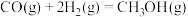
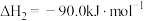
(1)反应①的

(2)反应①为慢反应,下列示意图中能体现该反应能量变化的是___________。
A.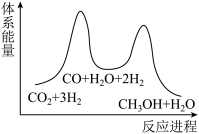 | B.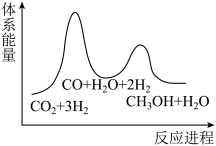 |
C. | D.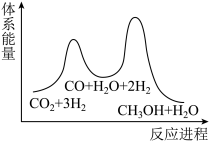 |
(3)若
 和
和 按一定投料比发生反应
按一定投料比发生反应 ,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示。490K之后,甲醇产率下降,请分析其变化产生的原因:
,一定时间内甲醇的产率和催化剂的催化活性与温度的关系如图所示。490K之后,甲醇产率下降,请分析其变化产生的原因:
原因1:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。

(1)上图是 和
和 反应生成
反应生成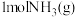 过程中能量的变化示意图,下列有关说法正确的是
过程中能量的变化示意图,下列有关说法正确的是_______ 。
a. 反应物的总能量比生成物的总能量高
b. 反应物的活化能比生成物的活化能高
c. 反应物的总键能比生成物的总键能高
d. 该反应为熵增反应
(2)请写出 和
和 反应的热化学方程式:
反应的热化学方程式:_______ ,决定该反应进行方向的主要判据为________ 。
(3)试根据表中及图中数据计算 的键能
的键能______________ kJ/mol;
(4)用 催化还原
催化还原 还可以消除氮氧化物的污染。已知:
还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=-akJ/mol
N2(g)+O2(g)=2NO(g);△H2=-bkJ/mol
若1molNH3还原NO至N2,则该反应过程中的反应热△H3=_____________ kJ/mol(用含a、b的式子表示)。

(1)上图是
 和
和 反应生成
反应生成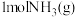 过程中能量的变化示意图,下列有关说法正确的是
过程中能量的变化示意图,下列有关说法正确的是a. 反应物的总能量比生成物的总能量高
b. 反应物的活化能比生成物的活化能高
c. 反应物的总键能比生成物的总键能高
d. 该反应为熵增反应
(2)请写出
 和
和 反应的热化学方程式:
反应的热化学方程式:(3)试根据表中及图中数据计算
 的键能
的键能| 化学键 |  |  |
| 键能/ kJ/mol | 390 | 943 |
(4)用
 催化还原
催化还原 还可以消除氮氧化物的污染。已知:
还可以消除氮氧化物的污染。已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=-akJ/mol
N2(g)+O2(g)=2NO(g);△H2=-bkJ/mol
若1molNH3还原NO至N2,则该反应过程中的反应热△H3=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】一定条件下,向容积可变的密闭容器中通入N2和H2,发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0达到平衡后,试回答下列问题:
2NH3(g) ΔH<0达到平衡后,试回答下列问题:
(1)该条件下,反应的平衡常数表达式K=______ ;若降低温度,K值将______ (填“增大”、“减小”或“不变”)。
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将____ (填“向逆反应方向”、“向正反应方向”或“不”)移动,平衡常数K将_____ (填“增大”、“减小”或“不变”)。
(3)达到平衡后,在恒压条件下,向容器中通入氦气(He),氮气的转化率将___ (填“增大”、“减小”或“不变”)。
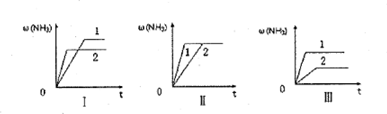
(4)在三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图所示。下列说法正确的是_______ (填序号)。
a.图I可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅱ可能是不同温度对反应的影响,且T1>T2
(5)A、B两个容积相同的容器中各充入1molN2和3molH2,A容器保持恒温恒容达到平衡时氢气的物质的量为x,B容器保持恒温恒压达到平衡时氢气的物质的量为y,则x____ y(“>”“<”或“=”)。
 2NH3(g) ΔH<0达到平衡后,试回答下列问题:
2NH3(g) ΔH<0达到平衡后,试回答下列问题:(1)该条件下,反应的平衡常数表达式K=
(2)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将
(3)达到平衡后,在恒压条件下,向容器中通入氦气(He),氮气的转化率将
(4)在三个相同的容器中各充入1molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数ω随时间变化如图所示。下列说法正确的是
a.图I可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是同温同压下催化剂对反应的影响,且催化性能1>2
c.图Ⅱ可能是不同温度对反应的影响,且T1>T2

(5)A、B两个容积相同的容器中各充入1molN2和3molH2,A容器保持恒温恒容达到平衡时氢气的物质的量为x,B容器保持恒温恒压达到平衡时氢气的物质的量为y,则x
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】下列反应在210 ℃达到平衡:
①PCl5(g) PCl3(g)+Cl2(g) ΔH=Q1 K=1
PCl3(g)+Cl2(g) ΔH=Q1 K=1
②CO(g)+Cl2(g) COCl2(g) ΔH=-Q2 K'=5×104
COCl2(g) ΔH=-Q2 K'=5×104
③COCl2(g) CO(g)+Cl2(g) ΔH=Q3 K″
CO(g)+Cl2(g) ΔH=Q3 K″
(1)根据反应①的平衡常数K表达式,下列等式必定成立的是___ 。
A.c(PCl5)=c(PCl3)=c(Cl2)=1
B.c(PCl5)=c(PCl3)·c(Cl2)=1
C.c(PCl5)=c(PCl3)·c(Cl2)
(2)反应②和反应③的平衡常数K'和K″存在的关系为_________ 。
(3)温度不变,降低Cl2的浓度,反应③的K″的值___ (填“增大”“减小”或“不变”)。
(4)要使反应①和反应②的K值相等,应采取的措施是___ 。
A.反应①、②同时升高温度
B.反应①、②同时降低温度
C.反应①降低温度,反应②维持210 ℃
①PCl5(g)
 PCl3(g)+Cl2(g) ΔH=Q1 K=1
PCl3(g)+Cl2(g) ΔH=Q1 K=1②CO(g)+Cl2(g)
 COCl2(g) ΔH=-Q2 K'=5×104
COCl2(g) ΔH=-Q2 K'=5×104③COCl2(g)
 CO(g)+Cl2(g) ΔH=Q3 K″
CO(g)+Cl2(g) ΔH=Q3 K″(1)根据反应①的平衡常数K表达式,下列等式必定成立的是
A.c(PCl5)=c(PCl3)=c(Cl2)=1
B.c(PCl5)=c(PCl3)·c(Cl2)=1
C.c(PCl5)=c(PCl3)·c(Cl2)
(2)反应②和反应③的平衡常数K'和K″存在的关系为
(3)温度不变,降低Cl2的浓度,反应③的K″的值
(4)要使反应①和反应②的K值相等,应采取的措施是
A.反应①、②同时升高温度
B.反应①、②同时降低温度
C.反应①降低温度,反应②维持210 ℃
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响。

已知:2NO2(g) N2O4(g) ΔH=-52.7 kJ·mol-1
N2O4(g) ΔH=-52.7 kJ·mol-1
(1)该化学反应的浓度平衡常数的表达式为_______________ 。
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答:
①加入浓硫酸的烧杯中溶液温度________ ,A中的现象为____________________
②由上述实验现象可知,降低温度,该反应化学平衡向________ (选填“正”或“逆”)反应方向移动。
③升高温度,该反应的化学平衡常数将________ (选填“增大”“减小”或“不变”)。

已知:2NO2(g)
 N2O4(g) ΔH=-52.7 kJ·mol-1
N2O4(g) ΔH=-52.7 kJ·mol-1(1)该化学反应的浓度平衡常数的表达式为
(2)该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。请回答:
①加入浓硫酸的烧杯中溶液温度
②由上述实验现象可知,降低温度,该反应化学平衡向
③升高温度,该反应的化学平衡常数将
您最近一年使用:0次
【推荐1】硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
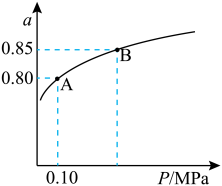
(1)将2.0molSO2和1.0molO2置于10L密闭容器中,10min时反应达平衡,体系总压强为0.10MPa。
①该反应的平衡常数等于____________ ;
②此时用SO2表示的化学反应速率为____________ 。
③在该条件下再通入2.0molSO2和1.0molO2,此时v(正)______ v(逆)(填“>”、“<”或“=”)。
(2)平衡状态由A变到B时,平衡常数K(A)____________ K(B)(填“>”、“<”或“=”)。
(3)在一定温度下的定容容器中,下列能说明该反应达到平衡状态的是____________ 。
A.混合气体的压强 B.混合气体的密度
C.SO2的物质的量浓度不变 D.混合气体的平均相对分子质量
 2SO3(g)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
2SO3(g)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图示回答下列问题:
(1)将2.0molSO2和1.0molO2置于10L密闭容器中,10min时反应达平衡,体系总压强为0.10MPa。
①该反应的平衡常数等于
②此时用SO2表示的化学反应速率为
③在该条件下再通入2.0molSO2和1.0molO2,此时v(正)
(2)平衡状态由A变到B时,平衡常数K(A)
(3)在一定温度下的定容容器中,下列能说明该反应达到平衡状态的是
A.混合气体的压强 B.混合气体的密度
C.SO2的物质的量浓度不变 D.混合气体的平均相对分子质量
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在80℃时,将0.40 mol的N2O4气体充入1 L固定容积的密闭容器中发生反应:N2O4  2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
(1)在20s — 40s之间,用N2O4表示的平均反应速率为_______________ 。
(2)在80℃时该反应的平衡常数K=________________ 。
(3)要增大该反应的平衡常数,可采取的措施有(填序号)_______________ 。
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色_________ (填“变浅”、“变深”或“不变”)。
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平衡后N2O4的转化率将________ (填“增大”、“减小”或“不变”)。
 2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:
2NO2(ΔH >0),每隔一段时间对容器内的物质进行测定,得到如下数据:时间(s) | 0 | 4 | 8 | 12 | 16 | 20 |
n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)在20s — 40s之间,用N2O4表示的平均反应速率为
(2)在80℃时该反应的平衡常数K=
(3)要增大该反应的平衡常数,可采取的措施有(填序号)
①增大N2O4的起始浓度 ②向混合气体中通入NO2
③使用高效催化剂 ④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色
(5)反应进行至100s后若向容器中再充入0.40 mol的N2O4气体,则达到新平衡后N2O4的转化率将
您最近一年使用:0次



