(1)三聚氰胺(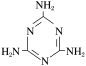 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
①三聚氰胺中,环上与环外的氮原子杂化轨道类型分别为________ 。
②导致三聚氰胺与硝基苯熔点相差很大的根本原因是____________ 。
(2)一定条件下,碳、氮两种元素可形成一种化合物,该化合物可作耐磨材料,其熔点______ (填“高于”“低于”或“无法判断”)金刚石的熔点。
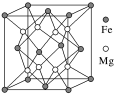
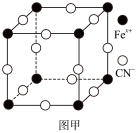
(3)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为____ ,若该晶胞的参数为d nm,则该合金的密度为______ (不必化简,用NA表示阿伏加 德罗常数)。
 )中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。
)中六元环结构与苯环类似,它与硝基苯的相对分子质量之差为3,三聚氰胺的熔点为354 ℃,硝基苯的熔点是5.7 ℃。①三聚氰胺中,环上与环外的氮原子杂化轨道类型分别为
②导致三聚氰胺与硝基苯熔点相差很大的根本原因是
(2)一定条件下,碳、氮两种元素可形成一种化合物,该化合物可作耐磨材料,其熔点
(3)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为
2019高三·全国·专题练习 查看更多[2]
更新时间:2019-12-04 06:42:38
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】I.氟化镁钾(KMgF3)是一种具有优良光学性能的材料,其晶胞结构如图。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。

(1)KMgF3晶体中,每个Mg2+位于( )个距离最近的F-构成的( )空隙中。填选项字母______ 。
a.3 三角形 b.4 正四面体 c.6 正八面体 d.8 立方体
(2)Fe3+半径与Mg2+接近,将Mg2+部分由Fe3+取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态Fe3+价电子的轨道表示式为______ 。
②某实验室合成新型催化剂材料KMg0.8Fe0.2F3O0.1(O2-是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为anm。若要合成厚度为0.3mm、面积为1m2的催化剂材料,理论上需要掺杂的Fe3+约为______ mol。(1nm=10-9m,1mm=10-3m,阿伏加德罗常数取6×1023mol-1)。
(3)AthMn(N3)3晶体结构与KMgF3类似。已知Ath+与N 的结构简式如图:
的结构简式如图:
Ath+: N
N :
: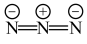
①Ath+中N原子的杂化方式为_______ ,N 中心N原子的杂化方式为
中心N原子的杂化方式为_______ 。
②Ath+的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的Mn2+与N 还存在着
还存在着______ ,上述相互作用不会随Ath+的转动改变。
Ⅱ.钴酸锂(LiCoO2)是常见的锂离子电池正极材料,其晶胞结构示意图及Co的晶胞俯视投影图如图。晶体中O围绕Co形成八面体,八面体共棱形成层状空间结构,与Li+层交替排列。在充放电过程中,Li+在层间脱出或嵌入。
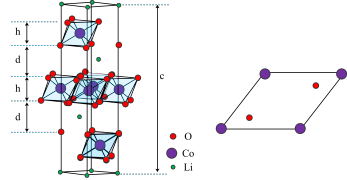
(4)基态Co原子中未成对的电子数为______ 。
(5)该晶胞中O的个数为______ 。
(6)Li+在______ (填“充电”或“放电”)过程中会从八面体层间脱出。该过程会导致晶胞高度c变大,解释原因:_______ 。

(1)KMgF3晶体中,每个Mg2+位于( )个距离最近的F-构成的( )空隙中。填选项字母
a.3 三角形 b.4 正四面体 c.6 正八面体 d.8 立方体
(2)Fe3+半径与Mg2+接近,将Mg2+部分由Fe3+取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态Fe3+价电子的轨道表示式为
②某实验室合成新型催化剂材料KMg0.8Fe0.2F3O0.1(O2-是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为anm。若要合成厚度为0.3mm、面积为1m2的催化剂材料,理论上需要掺杂的Fe3+约为
(3)AthMn(N3)3晶体结构与KMgF3类似。已知Ath+与N
 的结构简式如图:
的结构简式如图:Ath+:
 N
N :
: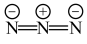
①Ath+中N原子的杂化方式为
 中心N原子的杂化方式为
中心N原子的杂化方式为②Ath+的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的Mn2+与N
 还存在着
还存在着Ⅱ.钴酸锂(LiCoO2)是常见的锂离子电池正极材料,其晶胞结构示意图及Co的晶胞俯视投影图如图。晶体中O围绕Co形成八面体,八面体共棱形成层状空间结构,与Li+层交替排列。在充放电过程中,Li+在层间脱出或嵌入。

(4)基态Co原子中未成对的电子数为
(5)该晶胞中O的个数为
(6)Li+在
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】氮的化合物应用广泛:
(1)Reineckesalt的结构如图所示:
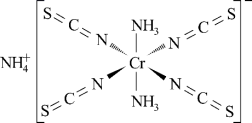
其中配位原子为___________ (填元素符号),阳离子的空间结构为___________ ,NCS—中碳原子杂化方式为___________ 。
(2)重铬酸铵[(NH4)2Cr2O7]为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O 的结构如图。(NH4)2Cr2O7中N、O、Cr三种元素第一电离能由大到小的顺序是
的结构如图。(NH4)2Cr2O7中N、O、Cr三种元素第一电离能由大到小的顺序是___________ (填元素符号),1mol该物质中含σ键的数目为___________ NA。

(3)[Zn(IMI)4](ClO4)2是Zn2+的一种配合物,IMI的结构为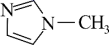 ,IMI的某种衍生物与甘氨酸形成的离子化合物
,IMI的某种衍生物与甘氨酸形成的离子化合物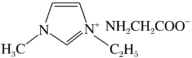 常温下为液态而非固态,原因是
常温下为液态而非固态,原因是_____ 。
(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。
。
①下列微粒中存在“离域Π键”的是_____ 。
A.CH2=CH—CH=CH2 B.CCl4 C.H2O D.SO2
②NaN3中阴离子N 与CO2互为等电子体,均为直线型结构,N
与CO2互为等电子体,均为直线型结构,N 中的2个大π键可表示为
中的2个大π键可表示为_____ 。
(1)Reineckesalt的结构如图所示:

其中配位原子为
(2)重铬酸铵[(NH4)2Cr2O7]为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O
 的结构如图。(NH4)2Cr2O7中N、O、Cr三种元素第一电离能由大到小的顺序是
的结构如图。(NH4)2Cr2O7中N、O、Cr三种元素第一电离能由大到小的顺序是
(3)[Zn(IMI)4](ClO4)2是Zn2+的一种配合物,IMI的结构为
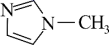 ,IMI的某种衍生物与甘氨酸形成的离子化合物
,IMI的某种衍生物与甘氨酸形成的离子化合物 常温下为液态而非固态,原因是
常温下为液态而非固态,原因是(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用
 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。
。①下列微粒中存在“离域Π键”的是
A.CH2=CH—CH=CH2 B.CCl4 C.H2O D.SO2
②NaN3中阴离子N
 与CO2互为等电子体,均为直线型结构,N
与CO2互为等电子体,均为直线型结构,N 中的2个大π键可表示为
中的2个大π键可表示为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】庆祝新中国成立 70 周年阅兵式上,“东风-41 洲际弹道导弹”“歼 20”等护国重器闪耀亮相,它们都采用了大量合金材料。
回答下列问题:
(1)某些导弹的外壳是以碳纤维为增强体,金属钛为基体的复合材料。基态钛原子的外围电子排布式为_____ 。钛可与 C、N、O 等元素形成二元化合物,C、N、O 元素的电负性由大到小的顺序是_________ 。
(2)钛比钢轻,比铝硬,钛硬度比铝大的原因是_____ 。
(3)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为_____ ,S 的_____ 杂化轨道与 O 的 2p 轨道形成_____ 键(填 “π”或“σ”)。
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为_____ (填字母序号)。

(5)氮化钛熔点高,硬度大,其晶胞结构如图所示。

若氮化钛晶体中 Ti 原子的半径为 a pm,N 原子的半径为 b pm,则氮化钛晶体中原子的空间利用率的计算式为_____ (用含 a、b 的式子表示)。碳氮化钛化合物在航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____ 。
回答下列问题:
(1)某些导弹的外壳是以碳纤维为增强体,金属钛为基体的复合材料。基态钛原子的外围电子排布式为
(2)钛比钢轻,比铝硬,钛硬度比铝大的原因是
(3)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为

(5)氮化钛熔点高,硬度大,其晶胞结构如图所示。

若氮化钛晶体中 Ti 原子的半径为 a pm,N 原子的半径为 b pm,则氮化钛晶体中原子的空间利用率的计算式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】(1)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为______ 。②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________ g·cm-3(列出计算式即可)。③GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是__________________ 。

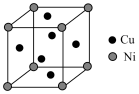
(2)单质铜及镍都是由______ 键形成的晶体。某镍白铜合金的立方晶胞结构如图所示。①晶胞中铜原子与镍原子的数量比为_____ 。②若合金的密度为d g/cm3,晶胞参数a=________ nm。
③第ⅡA族金属碳酸盐分解温度如下:
分解温度为什么越来越高?_______ 。
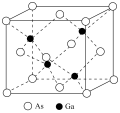
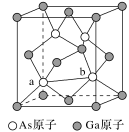
(3)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如左图所示。该晶体的类型为_______ ,Ga与As以________ 键键合。Ga和As的摩尔质量分别为MGa g·mol-1 和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加 德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_____ 。甲烷晶体的晶胞如右图所示,该晶胞中含有__ 个甲烷分子,此晶体在常温、常压下不能存在的原因______________________ 。

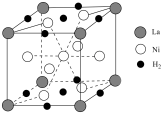
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,如图是一种镍镧合金储氢后的晶胞结构示意图,该合金储氢后,含1 mol La的合金可吸附H2的数目为____ 。
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为____ ;若该晶体的晶胞棱长为a pm,则该合金密度为____ g/cm3。(列出计算式,不要求计算结果,阿伏加 德罗常数的值为NA)
(6)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为____ g·cm-3(用含c的式子表示,设NA为阿伏加 德罗常数的值),a位置As原子与b位置As原子之间的距离为____ pm(用含c的式子表示)。
(7)碳化硅SiC是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列各种晶体:①晶体硅 ②硝酸钾 ③金刚石 ④碳化硅 ⑤干冰 ⑥冰,它们的熔点由高到低的顺序是________ (填序号)。
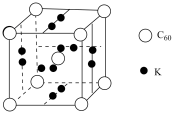
(8)①科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如图所示,该物质中K原子和C60分子的个数比为________ 。
②继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点Si60>N60>C60,而破坏分子所需要的能量N60>C60>Si60,其原因是_________ 。
(9)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为________ ,微粒间存在的作用力是______ 。SiC晶体和晶体Si的熔沸点高低顺序是________ 。
(10)氧化物MO的电子总数与SiC的相等,则M为________ (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是_________ 。Na、M、Ca 三种晶体共同的物理性质是______ (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
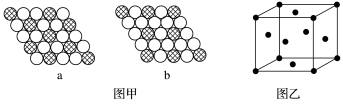
(11)如图甲所示为二维平面晶体示意图,所表示的物质化学式为AX3的是________ (填“a”或“b”)。图乙为金属铜的晶胞,此晶胞立方体的边长为a pm,金属铜的密度为ρ g·cm-3,则阿伏加 德罗常数可表示为________ mol-1(用含a、ρ的代数式表示)。
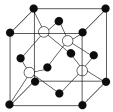
(12)FeO、NiO的晶体结构与NaCl晶体结构相同,其中Fe2+与Ni2+的离子半径分别为7.8×10-2 nm、6.9×10-2 nm,则熔点FeO___ (填“<”、“>”或“=”)NiO,原因是_____________ 。磷化硼是一种超硬耐磨的涂层材料,其晶胞如图所示。P原子与B原子的最近距离为a cm,则磷化硼晶胞的边长为________ cm(用含a的代数式表示)。
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
(2)单质铜及镍都是由

③第ⅡA族金属碳酸盐分解温度如下:
| BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 | |
| 分解温度 | 100 ℃ | 540 ℃ | 960 ℃ | 1 289 ℃ | 1 360 ℃ |
分解温度为什么越来越高?
(3)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如左图所示。该晶体的类型为


(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,如图是一种镍镧合金储氢后的晶胞结构示意图,该合金储氢后,含1 mol La的合金可吸附H2的数目为

(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为
(6)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为

(7)碳化硅SiC是一种晶体,具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列各种晶体:①晶体硅 ②硝酸钾 ③金刚石 ④碳化硅 ⑤干冰 ⑥冰,它们的熔点由高到低的顺序是
(8)①科学家把C60和K掺杂在一起制造了一种富勒烯与钾的化合物,该物质在低温时是一种超导体,其晶胞如图所示,该物质中K原子和C60分子的个数比为
②继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点Si60>N60>C60,而破坏分子所需要的能量N60>C60>Si60,其原因是
(9)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(10)氧化物MO的电子总数与SiC的相等,则M为
①有金属光泽 ②导电性 ③导热性 ④延展性
(11)如图甲所示为二维平面晶体示意图,所表示的物质化学式为AX3的是

(12)FeO、NiO的晶体结构与NaCl晶体结构相同,其中Fe2+与Ni2+的离子半径分别为7.8×10-2 nm、6.9×10-2 nm,则熔点FeO

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
(1) 可以与
可以与 、
、 、有机分子等形成配合物。基态
、有机分子等形成配合物。基态 的电子排布式为
的电子排布式为_______ ;
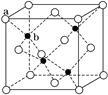
(2)普鲁士蓝俗称铁蓝,结构如图甲所示( 未画出),平均每两个立方体中含有一个
未画出),平均每两个立方体中含有一个 ,该晶体的化学式为
,该晶体的化学式为_______ 。又知该晶体中铁元素有+2价和+3价两种,则 与
与 的个数比为
的个数比为_______ 。
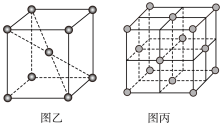
(3)在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为_______ ,两种晶体中空间利用率较高的是_______ 。(填“图乙”或“图丙”)
(1)
 可以与
可以与 、
、 、有机分子等形成配合物。基态
、有机分子等形成配合物。基态 的电子排布式为
的电子排布式为(2)普鲁士蓝俗称铁蓝,结构如图甲所示(
 未画出),平均每两个立方体中含有一个
未画出),平均每两个立方体中含有一个 ,该晶体的化学式为
,该晶体的化学式为 与
与 的个数比为
的个数比为
(3)在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示,则图乙和图丙的结构中铁原子的配位数之比为

您最近一年使用:0次
【推荐3】新材料的出现改变了人们的生活,对新材料的研究越来越重要。
(1)硫化锌在荧光体、光导体材料、涂料、颜料等行业中应用广泛。其晶胞结构如右图所示,a位置是S2-、b位置Zn2+,则此晶胞中含有________ 个S2-,Zn2+的配位数为________ 。

(2)最近发现一种钛原子和碳原子构成的气态团簇分子,如图所示,项角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为___________ 。
(3)由甲烷分子,在一定条件下可以得到“碳正离子”CH3+,和“碳负离子”CH3—,CH3+中C—H键键角是_____________ ;CH3—的空间构型是__________ 。
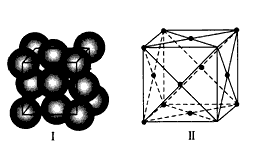
(4)某金属材料的结构如图I所示,属于面心立方的结构,晶胞结构如图Ⅱ所示。若晶胞的边长为a pm,金属的密度为ρ g/cm3,金属的摩尔质量为M g/mol,则阿伏加德罗常数NA=__________ mol-1。
(1)硫化锌在荧光体、光导体材料、涂料、颜料等行业中应用广泛。其晶胞结构如右图所示,a位置是S2-、b位置Zn2+,则此晶胞中含有



(2)最近发现一种钛原子和碳原子构成的气态团簇分子,如图所示,项角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为
(3)由甲烷分子,在一定条件下可以得到“碳正离子”CH3+,和“碳负离子”CH3—,CH3+中C—H键键角是
(4)某金属材料的结构如图I所示,属于面心立方的结构,晶胞结构如图Ⅱ所示。若晶胞的边长为a pm,金属的密度为ρ g/cm3,金属的摩尔质量为M g/mol,则阿伏加德罗常数NA=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】氢是重要而洁净的能源。要利用氢气作能源,必须解决好安全有效地储存氢气问题。化学家研究出利用合金储存氢气,LaNi5是一种储氢材料。LaNi5的晶体结构已经测定,属六方晶系,晶胞参数a=511pm,c=397pm,晶体结构如图所示:
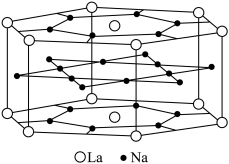
(1)从LaNi5晶体结构图中勾画出一个LaNi5晶胞__________ 。
(2)每个晶胞中含有多少个La原子和Ni原子_________ ?
(3)LaNi5晶胞中含有3个八面体空隙和6个四面体空隙,若每个空隙填入1个H原子,计算该储氢材料吸氢后氢的密度________ ,该密度是标准状态下氢气密度(8.987×10-5g·cm-3)的_______ 倍?(氢的相对原子质量为1.008;光速c为2.998×108m·s-1;忽略吸氢前后晶胞的体积变化)。

(1)从LaNi5晶体结构图中勾画出一个LaNi5晶胞
(2)每个晶胞中含有多少个La原子和Ni原子
(3)LaNi5晶胞中含有3个八面体空隙和6个四面体空隙,若每个空隙填入1个H原子,计算该储氢材料吸氢后氢的密度
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】Fe、Co、Ni、Cu、Ag是一系列合金的重要金属元素。
(1)Fe元素位于周期表的_______ 区,基态Fe2+与Fe3+离子中未成对电子数之比为_______ 。元素周期表中,铜、银位于同一副族相邻周期,则基态银原子的价层电子排布式为_______ 。
(2)将过量的NH3通入CuSO4溶液中可以得到Cu(NH3)4SO4,Cu(NH3)4SO4中第一电离能最大的是_______ (填元素符号),NH3、CH4和H2O的沸点由高到低的顺序为_______ 。
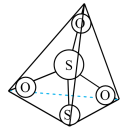
(3)照相底片定影时,常用定影液硫代硫酸钠(Na2S2O3)溶解未曝光的溴化银(AgBr),生成含Na3[Ag(S2O3)2]的废定影液。S2O 离子结构如图所示,其中心硫原子的杂化方式为
离子结构如图所示,其中心硫原子的杂化方式为_______ 。基态S原子中,核外电子占据的最高能级的符号是_______ ,占据最高能级电子的电子云轮廓图为_______ 形。
(4)Co可形成[Co(NH3)6]Cl2配合物。1mol [Co(NH3)6]Cl2中含有σ键的数目为_______ NA;
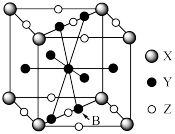
(5)镧镍合金是重要储氢材料。镧镍合金储氢后所得的晶体的化学式为LaNi5H6,晶胞如图所示,则Z表示的微粒为_______ (填化学式),晶胞参数=_______ pm。(用代数式表示,已知LaNi5H6的摩尔质量为440 g/mol,晶体密度为ρ g/cm3,NA为阿伏加德罗常数的值)。
(1)Fe元素位于周期表的
(2)将过量的NH3通入CuSO4溶液中可以得到Cu(NH3)4SO4,Cu(NH3)4SO4中第一电离能最大的是
(3)照相底片定影时,常用定影液硫代硫酸钠(Na2S2O3)溶解未曝光的溴化银(AgBr),生成含Na3[Ag(S2O3)2]的废定影液。S2O
 离子结构如图所示,其中心硫原子的杂化方式为
离子结构如图所示,其中心硫原子的杂化方式为
(4)Co可形成[Co(NH3)6]Cl2配合物。1mol [Co(NH3)6]Cl2中含有σ键的数目为
(5)镧镍合金是重要储氢材料。镧镍合金储氢后所得的晶体的化学式为LaNi5H6,晶胞如图所示,则Z表示的微粒为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】完成下列问题。
(1)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。
一些氧化物的熔点如下表所示:
解释表中氧化物之间熔点差异的原因___________ 。
(2)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。回答下列问题:
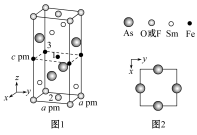
①图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为___________ ;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=___________ g·cm-3。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为___________ 、___________ 。
(1)在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。
一些氧化物的熔点如下表所示:
| 氧化物 | Li2O | MgO | P4O6 | SO2 |
| 熔点/℃ | 1570 | 2800 | 23.8 | -75.5 |
解释表中氧化物之间熔点差异的原因
(2)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。回答下列问题:

①图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
 ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为
您最近一年使用:0次



