在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为______ 。
(2)Na、O、S简单离子半径由大到小的顺序为___________ (用简单离子符号表示离子半径)。
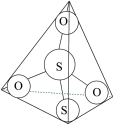
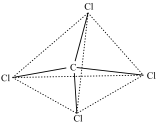
(3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为________ 。
(4)Na3[Ag(S2O3)2]中存在的作用力有_____________ 。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为____________________ ;与SO3相比,____________ 的键角更大,原因是________________________________ 。
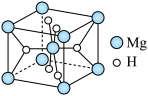
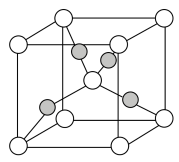
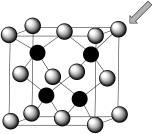
(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为____________________ ,已知该晶体的密度为ρg/cm3,则该晶胞的体积为_________ cm3(用含ρ、NA的代数式表示)。
(1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为
(2)Na、O、S简单离子半径由大到小的顺序为

(3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为
(4)Na3[Ag(S2O3)2]中存在的作用力有
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为

(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为
19-20高三上·湖北荆门·阶段练习 查看更多[3]
湖北省龙泉中学、潜江中学2020届高三12月联考理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)03 物质结构与性质综合题型集训(3) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
更新时间:2019-12-25 15:43:01
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D为四种原子序数依次增大的短周期元素,其中B、C、D位于同一周期,A、B形成的分子具有对称的正四面体结构,C的单质分子是NO+(亚硝酰离子)的等电子体,D是元素周期表中电负性最大的元素。根据上述,回答下列问题:
⑴B原子的核外电子排布式是______________ ;
⑵写出上述A、B所形成的分子的电子式:____________ ;
⑶NO+的结构中可能含____ 个σ键,含___ 个π键。
⑷写出B、C的氢化物的立体构型分别是________ 、_________ ;
⑸用氢键表示式写出D的氢化物溶液中存在的所有氢键______________ 。
⑴B原子的核外电子排布式是
⑵写出上述A、B所形成的分子的电子式:
⑶NO+的结构中可能含
⑷写出B、C的氢化物的立体构型分别是
⑸用氢键表示式写出D的氢化物溶液中存在的所有氢键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】I.超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
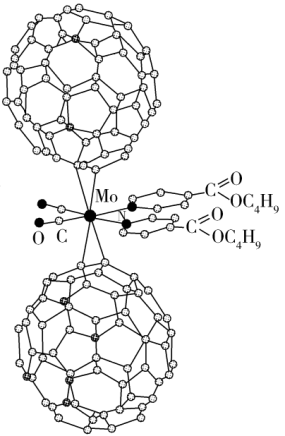
(1)Mo处于第五周期第VIB族,核外电子排布与Cr相似,它的基态价电子排布式是_______ ;核外未成对电子数是_______ 个。
(2)该超分子中存在的化学键类型有_______。
(3)该超分子中配体CO提供孤电子对的原子是_______ (填元素符号)。
(4)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是_______ 。
II.开发新型储氢材料是氢能利用的重要研究方向。
(5)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。基态原子Ti有_______ 种能量不同的电子。Li、B、H元素的电负性由大到小排列顺序为_______ 。
(6)NaH具有NaCl型晶体结构。已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为_______ ,NaH的理论密度是_______ g·cm-3(只列算式,不必计算出数值,阿伏加德罗常数的值为NA)。

(1)Mo处于第五周期第VIB族,核外电子排布与Cr相似,它的基态价电子排布式是
(2)该超分子中存在的化学键类型有_______。
| A.σ键 | B.π键 | C.离子键 | D.氢键 |
(4)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是
II.开发新型储氢材料是氢能利用的重要研究方向。
(5)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。基态原子Ti有
(6)NaH具有NaCl型晶体结构。已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H-的半径为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___________ ,Zn的基态原子能级最高的电子的电子云轮廓图形状为___________ 。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___________ 。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___________ mol,其阴离子中心原子的杂化方式是___________ ,NH3的沸点高于PH3的原因是___________ 。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
请根据原子结构中外围电子排布推测Sc3+、Zn2+的水合离子为无色的原因:___________ 。
(5)Fe晶体中堆积方式为体心立方堆积,则这种堆积方式的空间利用率为___________ ,这种堆积方式的配位数为___________ 。
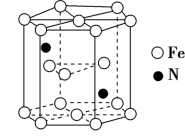
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xnm,高为ynm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g·cm-3(列出计算式即可)。
(1)Fe2+电子排布式为
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
(5)Fe晶体中堆积方式为体心立方堆积,则这种堆积方式的空间利用率为
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xnm,高为ynm,NA为阿伏加德罗常数的值,则晶胞的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铁、铜和镁是生命必需的元素,也是人类使用广泛的金属,铁和铜及其重要化合物在生产中有着重要的应用。回答下列问题:
(1)某元素X与铜同周期,基态X原子是该周期基态原子中未成对电子最多的,其原子结构示意图为_______ 。
(2)Fe2+变为基态铁原子时所得的电子填充到_______ 能级。
(3)新制备的Cu(OH)2可将乙醛氧化成乙酸(CH3COOH),而自身还原成Cu2O。1个乙酸分子中共平面的原子最多为_______ 个。图所示的Cu2O晶胞中,铜周围紧邻且等距的氧有_______ 个,已知其晶胞密度为bg/cm3,则该晶胞棱长为_______ pm(设NA为阿伏加德罗常数的值)。
(4)叶绿素的结构示意如图所示。
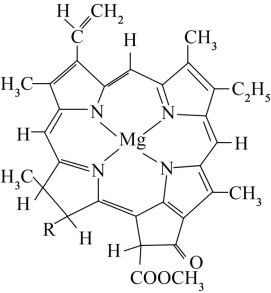
①该结构中包含的作用力有_______ (用字母填空)。
a.离子键 b.σ键 c.π键 d.分子间作用力
②其中碳原子的杂化类型为_______ ,碳、氮、氧三种元素的电负性由大到小的顺序是_______ 。元素As与N同族预测As的简单氢化物的VSEPR模型为_______ ,其键角_______ 109º28´(填“大于”、“小于”或“等于”)原因是_______ 。
(1)某元素X与铜同周期,基态X原子是该周期基态原子中未成对电子最多的,其原子结构示意图为
(2)Fe2+变为基态铁原子时所得的电子填充到
(3)新制备的Cu(OH)2可将乙醛氧化成乙酸(CH3COOH),而自身还原成Cu2O。1个乙酸分子中共平面的原子最多为

(4)叶绿素的结构示意如图所示。

①该结构中包含的作用力有
a.离子键 b.σ键 c.π键 d.分子间作用力
②其中碳原子的杂化类型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E为原子序数依次增大的前四周期元素。A原子最外层电子数等于周期序数且原子半径最小;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;D原子2p轨道上成对电子数等于未成对电子数;基态E原子的价电子排布式为3d74s2。
(1)基态B原子的核外电子排布式为_______ ;其最高能级的电子云形状为_______ 。
(2)A、C形成的最简单分子的空间构型为_______ ;该分子与A、B形成最简单分子的键角相比_______ 大(填“前者”或“后者”)。
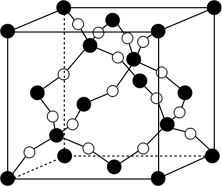
(3)BD2在高温高压下可形成的晶胞如图所示。该晶体熔点可高达1800K,其晶体的类型属于_______ 晶体;1 mol BD2晶体中含有的共价键数目为_______ (阿伏加德罗常数的值为NA)。
(4)[E(NH3)6]3+的空间构型为正八面体,则配合物[E(NH3)3Cl3]的空间结构有_______ 种,[E(NH3)3Cl3]中含有的化学键类型有_______ 。
A.极性共价键 B.离子键 C.配位键 D.金属键 E.氢键
(1)基态B原子的核外电子排布式为
(2)A、C形成的最简单分子的空间构型为
(3)BD2在高温高压下可形成的晶胞如图所示。该晶体熔点可高达1800K,其晶体的类型属于

(4)[E(NH3)6]3+的空间构型为正八面体,则配合物[E(NH3)3Cl3]的空间结构有
A.极性共价键 B.离子键 C.配位键 D.金属键 E.氢键
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】 、
、 常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
(1) 的VSEPR模型是
的VSEPR模型是______ 。已知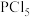 中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知
中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知 中P的杂化类型为
中P的杂化类型为______ (填标号)。 B.
B. C.
C. D.
D.
(2)已知,①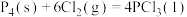
 kJ⋅mol
kJ⋅mol ,
,
②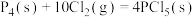
 kJ⋅mol
kJ⋅mol (
(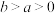 )。
)。
则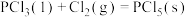

______ (用含a、b、c的式子表示)kJ⋅mol 。
。
(3)实验测得 的速率方程为
的速率方程为 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为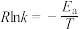 (R为常数,
(R为常数, 为活化能,T为绝对温度)。
为活化能,T为绝对温度)。 和
和 ,实验测得在催化剂Cat1、Cat2下
,实验测得在催化剂Cat1、Cat2下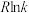 与
与 的关系如图乙所示。催化效能较高的是
的关系如图乙所示。催化效能较高的是______ (填“Cat1”或“Cat2”),判断依据是____________ 。
②将2n mol 和n mol
和n mol 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时, 为a mol,如果此时移走n mol
为a mol,如果此时移走n mol 和0.5n mol
和0.5n mol  ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时 的物质的量为x,则x为
的物质的量为x,则x为______ (填标号)。
A. mol B.
mol B. mol C.
mol C. mol D.0.5a mol
mol D.0.5a mol mol
mol
(4)向恒容密闭容器中投入0.2 mol 和0.2 mol
和0.2 mol  ,发生反应:
,发生反应: ,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。____________ ;曲线c改变的条件可能是____________ 。
②曲线b条件下,该反应平衡常数( )为
)为______ 。[提示:用分压计算的平衡常数为压强平衡常数 ,分压=总压×物质的量分数。]
,分压=总压×物质的量分数。]
 、
、 常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:(1)
 的VSEPR模型是
的VSEPR模型是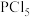 中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知
中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知 中P的杂化类型为
中P的杂化类型为
 B.
B. C.
C. D.
D.
(2)已知,①
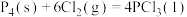
 kJ⋅mol
kJ⋅mol ,
,②
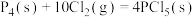
 kJ⋅mol
kJ⋅mol (
(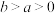 )。
)。则
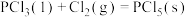

 。
。(3)实验测得
 的速率方程为
的速率方程为 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为 (R为常数,
(R为常数, 为活化能,T为绝对温度)。
为活化能,T为绝对温度)。
 和
和 ,实验测得在催化剂Cat1、Cat2下
,实验测得在催化剂Cat1、Cat2下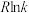 与
与 的关系如图乙所示。催化效能较高的是
的关系如图乙所示。催化效能较高的是②将2n mol
 和n mol
和n mol 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时, 为a mol,如果此时移走n mol
为a mol,如果此时移走n mol 和0.5n mol
和0.5n mol  ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时 的物质的量为x,则x为
的物质的量为x,则x为A.
 mol B.
mol B. mol C.
mol C. mol D.0.5a mol
mol D.0.5a mol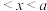 mol
mol(4)向恒容密闭容器中投入0.2 mol
 和0.2 mol
和0.2 mol  ,发生反应:
,发生反应: ,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
②曲线b条件下,该反应平衡常数(
 )为
)为 ,分压=总压×物质的量分数。]
,分压=总压×物质的量分数。]
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】(1)钛镁合金是制造高性能飞机的重要材料。金属钛、镁均采用六方最密堆积,下列说法正确的是_____ (填序号)。
A.钛镁合金用于制造高性能飞机主要是由于它们的价格昂贵,制造出的飞机能卖好价钱
B.钛、镁金属晶体中,其配位数均为12
C.金属钛的熔点(1668℃)很高,与金属键无关
(2)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有很好的电学性能。下列说法正确的是______ (填序号)。
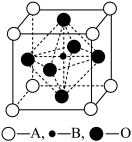
A.金属Ca、Sr、Ba采用体心立方密堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式可表示为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子
(3)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有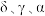 三种同素异形体,其晶胞结构如图所示。
三种同素异形体,其晶胞结构如图所示。
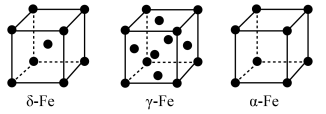
① 晶胞中含有的铁原子数为
晶胞中含有的铁原子数为___________ 。
②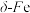 、
、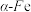 两种晶体中铁原子的配位数之比为
两种晶体中铁原子的配位数之比为___________ 。
③若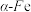 晶胞的边长为a cm,
晶胞的边长为a cm,  晶胞的边长为b cm,则两种晶体的密度之比为
晶胞的边长为b cm,则两种晶体的密度之比为___________ 。
A.钛镁合金用于制造高性能飞机主要是由于它们的价格昂贵,制造出的飞机能卖好价钱
B.钛、镁金属晶体中,其配位数均为12
C.金属钛的熔点(1668℃)很高,与金属键无关
(2)钙钛型复合氧化物可用于制造航母中的热敏传感器,其晶胞结构如图所示,其中A为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有很好的电学性能。下列说法正确的是

A.金属Ca、Sr、Ba采用体心立方密堆积
B.用A、B、O表示的钙钛型复合氧化物晶体的化学式可表示为ABO3
C.在制造Fe薄片时,金属键完全断裂
D.V、Cr、Mn、Fe晶体中均存在金属阳离子和阴离子
(3)辽宁号航母飞行甲板等都是由铁及其合金制造的。铁有
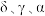 三种同素异形体,其晶胞结构如图所示。
三种同素异形体,其晶胞结构如图所示。
①
 晶胞中含有的铁原子数为
晶胞中含有的铁原子数为②
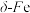 、
、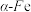 两种晶体中铁原子的配位数之比为
两种晶体中铁原子的配位数之比为③若
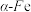 晶胞的边长为a cm,
晶胞的边长为a cm,  晶胞的边长为b cm,则两种晶体的密度之比为
晶胞的边长为b cm,则两种晶体的密度之比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTe5)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。请回答下列问题:
(1)Zr是Ti的同族相邻元素,位于周期表的
(2)周期表中As与Se同周期相邻,Te与Se同主族且相邻,这三种元素第一电离能由大到小的顺序是
(3)Cd2+与NH3可形成配离子[Cd(NH3)4]2+。
①该离子中不含的化学键类型有
A.离子键 B.配位键 C.σ键 D.共价键 E.π键
②已知该离子中2个NH3被2个Cl-替代只得到一种结构,则该离子的立体构型为
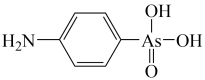
(4)含砷有机物“对氨基苯砷酸”的结构简式如图所示,As原子的轨道杂化类型为
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系Cd-Sn-As形成的化合物的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
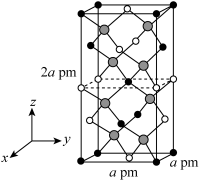
坐标原子 | x | y | z |
Cd | 0 | 0 | 0 |
Sn | 0 | 0 | 0.5 |
As | 0.25 | 0.25 | 0.125 |
①找出此晶胞中距离Cd(0,0,0)最远的As的位置
②该化合物的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】在“结构决定性质,性质决定应用”的指导下,为深入理解在研究学习过程中接触到的新材料新反应,某同学开始认真学习物质微观结构的知识。
元素是具有相同质子数的一类原子的总称,而同一种元素的几种中子数不同的原子互为同位素,如氢元素具有三种同位素 、
、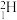 、
、 (左下角的数字为原子核内质子数;左上角的数字为原子核内质子数与中子数之和,即该原子的相对原子质量)某些同位素可以发生核反应,生成新的原子,如在恒星中常见的核聚变反应:
(左下角的数字为原子核内质子数;左上角的数字为原子核内质子数与中子数之和,即该原子的相对原子质量)某些同位素可以发生核反应,生成新的原子,如在恒星中常见的核聚变反应: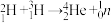 (
(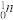 为中子)。该反应可释放大量的能量,因而如何在可控条件下利用该反应成为当下解决人类社会能源问题的一个焦点。
为中子)。该反应可释放大量的能量,因而如何在可控条件下利用该反应成为当下解决人类社会能源问题的一个焦点。
(1)科学家使 与Be的一种同位素发生核反应,制得一个中子和一个
与Be的一种同位素发生核反应,制得一个中子和一个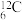 原子,请仿照上式写出该核聚变反应的反应式(注意反应前后质子数和中子数的守恒)
原子,请仿照上式写出该核聚变反应的反应式(注意反应前后质子数和中子数的守恒)_________________ 。
(2)一些同位素具有放射性,会发生 衰变。其原子核内的一个中子会释放出一个电子
衰变。其原子核内的一个中子会释放出一个电子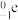 ,该原子核转变为质子数多一个的另一种元素的原子核。由于放射性可以被检测到,这类同位素常被用来“示踪”,以验证反应中原子的转移,常用的有
,该原子核转变为质子数多一个的另一种元素的原子核。由于放射性可以被检测到,这类同位素常被用来“示踪”,以验证反应中原子的转移,常用的有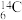 、
、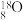 等。请写出
等。请写出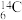 发生这类衰变反应得到的原子是
发生这类衰变反应得到的原子是______ (以类似“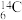 ”形式表示)。
”形式表示)。
(3)碳元素常见的同位素有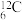 、
、 、
、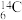 ,氧元素常见的同位素有
,氧元素常见的同位素有 、
、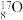 、
、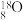 。由不同的同位素组成的CO共有
。由不同的同位素组成的CO共有______ 种; 可能有
可能有______ 种相对分子质量。
(4)元素的性质主要由原子核外最外层电子数决定。若两个分子或离子所含的原子总数、各原子最外层电子数之和均相等(注意离子电荷的影响),则它们互为等电子体,具有类似的结构,例如 与
与 。写出一种与CO互为等电子体的分子(写化学式)
。写出一种与CO互为等电子体的分子(写化学式)______ ;下列选项中与 结构不相似的为
结构不相似的为______ (填选项)。
A. B.
B. C.
C. D.
D.
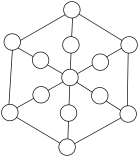
(5)氯元素有两种同位素。 的分子结构为如图所示的正四面体,碳原子位于正四面体的中心。则含
的分子结构为如图所示的正四面体,碳原子位于正四面体的中心。则含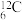 的
的 分子一共有
分子一共有______ 种。
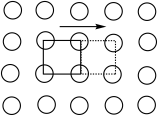
(6)一些固体结构中存在重复排列的结构单元。在二维层面重复单元为平行四边形,沿平行四边形的边所在直线方向平移它的边长距离,则结构完全重合,如图所示。请在图中画出面积最小的重复单元______ 。
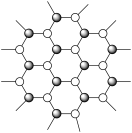
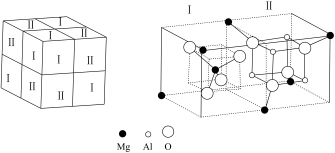
(7)在三维层面上,重复单元常为立方体,每个立方体顶点上的原子被8个立方体共用,棱上的被4个立方体共用,面上的被2个立方体共用(提示:一个原子被N个重复单元共用,则每个重复单元实际占有该原子的N分之一)。尖晶石为一类混合金属氧化物,重复单元如图所示,请写出尖晶石中Mg、Al、O的原子个数比______ 。
(8)某固体的重复结构单元如图所示。沿体对角线方向看下去,浅色原子的分布如图所示。请在图中用“●”表示出深色原子的位置。______ 。
元素是具有相同质子数的一类原子的总称,而同一种元素的几种中子数不同的原子互为同位素,如氢元素具有三种同位素
 、
、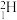 、
、 (左下角的数字为原子核内质子数;左上角的数字为原子核内质子数与中子数之和,即该原子的相对原子质量)某些同位素可以发生核反应,生成新的原子,如在恒星中常见的核聚变反应:
(左下角的数字为原子核内质子数;左上角的数字为原子核内质子数与中子数之和,即该原子的相对原子质量)某些同位素可以发生核反应,生成新的原子,如在恒星中常见的核聚变反应: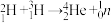 (
(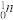 为中子)。该反应可释放大量的能量,因而如何在可控条件下利用该反应成为当下解决人类社会能源问题的一个焦点。
为中子)。该反应可释放大量的能量,因而如何在可控条件下利用该反应成为当下解决人类社会能源问题的一个焦点。(1)科学家使
 与Be的一种同位素发生核反应,制得一个中子和一个
与Be的一种同位素发生核反应,制得一个中子和一个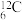 原子,请仿照上式写出该核聚变反应的反应式(注意反应前后质子数和中子数的守恒)
原子,请仿照上式写出该核聚变反应的反应式(注意反应前后质子数和中子数的守恒)(2)一些同位素具有放射性,会发生
 衰变。其原子核内的一个中子会释放出一个电子
衰变。其原子核内的一个中子会释放出一个电子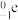 ,该原子核转变为质子数多一个的另一种元素的原子核。由于放射性可以被检测到,这类同位素常被用来“示踪”,以验证反应中原子的转移,常用的有
,该原子核转变为质子数多一个的另一种元素的原子核。由于放射性可以被检测到,这类同位素常被用来“示踪”,以验证反应中原子的转移,常用的有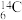 、
、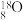 等。请写出
等。请写出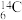 发生这类衰变反应得到的原子是
发生这类衰变反应得到的原子是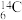 ”形式表示)。
”形式表示)。(3)碳元素常见的同位素有
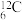 、
、 、
、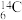 ,氧元素常见的同位素有
,氧元素常见的同位素有 、
、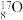 、
、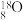 。由不同的同位素组成的CO共有
。由不同的同位素组成的CO共有 可能有
可能有(4)元素的性质主要由原子核外最外层电子数决定。若两个分子或离子所含的原子总数、各原子最外层电子数之和均相等(注意离子电荷的影响),则它们互为等电子体,具有类似的结构,例如
 与
与 。写出一种与CO互为等电子体的分子(写化学式)
。写出一种与CO互为等电子体的分子(写化学式) 结构不相似的为
结构不相似的为A.
 B.
B. C.
C. D.
D.
(5)氯元素有两种同位素。
 的分子结构为如图所示的正四面体,碳原子位于正四面体的中心。则含
的分子结构为如图所示的正四面体,碳原子位于正四面体的中心。则含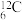 的
的 分子一共有
分子一共有
(6)一些固体结构中存在重复排列的结构单元。在二维层面重复单元为平行四边形,沿平行四边形的边所在直线方向平移它的边长距离,则结构完全重合,如图所示。请在图中画出面积最小的重复单元


(7)在三维层面上,重复单元常为立方体,每个立方体顶点上的原子被8个立方体共用,棱上的被4个立方体共用,面上的被2个立方体共用(提示:一个原子被N个重复单元共用,则每个重复单元实际占有该原子的N分之一)。尖晶石为一类混合金属氧化物,重复单元如图所示,请写出尖晶石中Mg、Al、O的原子个数比

(8)某固体的重复结构单元如图所示。沿体对角线方向看下去,浅色原子的分布如图所示。请在图中用“●”表示出深色原子的位置。


您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氮、铬、银及其相关化合物用途非常广泛。回答下列问题:
(1)在基态 原子的p能级上存在
原子的p能级上存在___________ 个自旋方向相同的电子,基态氮原子中占据最高能级的电子云轮廓图为___________ 形。
(2)钼( )在元素周期表中第5周期,价电子排布与铬相似,基态
)在元素周期表中第5周期,价电子排布与铬相似,基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(3)在离子晶体中,当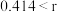 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子)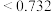 时,
时, 型化合物往往采用和
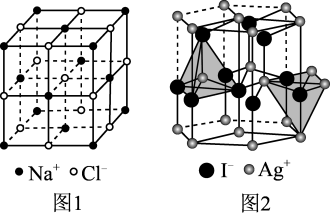
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知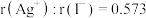 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为___________ ,造成 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是___________ (填标号)。
a.阳离子与阴离子半径比 b.电荷因素 c.键性因素
(4) 的熔点(
的熔点( )比
)比 的熔点(
的熔点(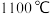 )低得多,这是因为
)低得多,这是因为___________ 。
(5) 的一种配合物结构如图所示:
的一种配合物结构如图所示:
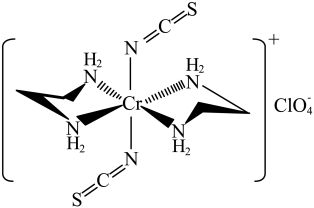
该配合物的配离子中,中心离子的配位数为___________ 。
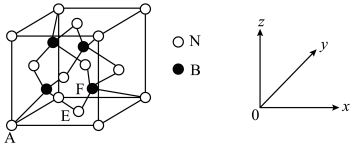
(6)氮化硼的用途也十分广泛,立方氮化硼的晶胞(类似金刚石的晶胞)如图所示。图中原子坐标参数为: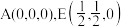 ,则F的原子坐标参数为
,则F的原子坐标参数为___________ ;若立方氮化硼中N和B原子间的最近距离为 ,晶胞密度为
,晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________ (用含a、 的代数式表示)。
的代数式表示)。
(1)在基态
 原子的p能级上存在
原子的p能级上存在(2)钼(
 )在元素周期表中第5周期,价电子排布与铬相似,基态
)在元素周期表中第5周期,价电子排布与铬相似,基态 原子的价电子排布式为
原子的价电子排布式为(3)在离子晶体中,当
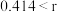 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子)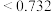 时,
时, 型化合物往往采用和
型化合物往往采用和 晶体相同的晶体结构(如下图1)。已知
晶体相同的晶体结构(如下图1)。已知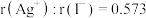 ,但在室温下,
,但在室温下, 的晶体结构如下图2所示,称为六方碘化银。
的晶体结构如下图2所示,称为六方碘化银。 的配位数为
的配位数为 晶体结构不同于
晶体结构不同于 晶体结构的原因不可能是
晶体结构的原因不可能是a.阳离子与阴离子半径比 b.电荷因素 c.键性因素

(4)
 的熔点(
的熔点( )比
)比 的熔点(
的熔点(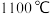 )低得多,这是因为
)低得多,这是因为(5)
 的一种配合物结构如图所示:
的一种配合物结构如图所示:
该配合物的配离子中,中心离子的配位数为
(6)氮化硼的用途也十分广泛,立方氮化硼的晶胞(类似金刚石的晶胞)如图所示。图中原子坐标参数为:
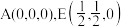 ,则F的原子坐标参数为
,则F的原子坐标参数为 ,晶胞密度为
,晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________ 。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________ ,以“肩并肩”方式形成的共价键数目为___________ 。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________ 。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495 kJ·mol-1,其第二电离能增幅较大的原因是___________ 。
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和___________ 。CrCl3·6NH3有三种异构体,分别是[Cr(NH)3)6]Cl3、___________ 、[Cr(NH)4Cl2] Cl·2NH3。
(5)NH4N3是在的高能量度材料,其晶胞构如图所示。N3-是直线型结构,N3-中氮原子的杂化类型是___________ 。NH4+的 VSEPR模型名称为___________ 。

(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏伽德罗常数的值为NA,则NH4N3的密度为___________ g·cm-3。
(1)基态氮原子的价电子排布式为
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和
(5)NH4N3是在的高能量度材料,其晶胞构如图所示。N3-是直线型结构,N3-中氮原子的杂化类型是

(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏伽德罗常数的值为NA,则NH4N3的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】钴单质及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态Co的价电子排布图为___________ ,Co和Fe的逐级电离能 如表,Fe的
如表,Fe的 大于Co的
大于Co的 原因是
原因是___________ 。
(2)维生素 是配合物,其配体是一种称为卟啉的大环有机化合物,中心离子是钴离子,结构如图1所示:
是配合物,其配体是一种称为卟啉的大环有机化合物,中心离子是钴离子,结构如图1所示:
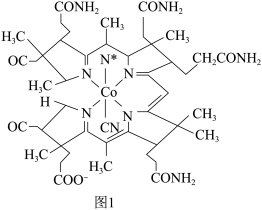
 的配位数为
的配位数为___________ ,与 形成配位键时,作配位原子的是
形成配位键时,作配位原子的是___________ 原子, 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为___________ ,与 互为等电子体的分子为
互为等电子体的分子为___________ (写一种即可)。
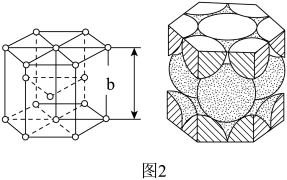
(3)金属钴晶体的晶胞是六棱柱形,其结构如图2所示,每个晶胞中含Co原子个数为___________ ;晶胞的底是正六边形,边长为a pm,设 为阿伏加德罗常数的值,晶胞的密度为
为阿伏加德罗常数的值,晶胞的密度为 ,则该晶胞的高b为
,则该晶胞的高b为___________ pm(列出计算式)。
(1)基态Co的价电子排布图为
 如表,Fe的
如表,Fe的 大于Co的
大于Co的 原因是
原因是| 元素 |  |  |  |  |  | … |
| Fe | 462.5 | 1561.9 | 2957 | 5290 | 7240 | |
| Co | 760.4 | 1648 | 3232 | 4950 | 7670 |
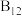 是配合物,其配体是一种称为卟啉的大环有机化合物,中心离子是钴离子,结构如图1所示:
是配合物,其配体是一种称为卟啉的大环有机化合物,中心离子是钴离子,结构如图1所示:
 的配位数为
的配位数为 形成配位键时,作配位原子的是
形成配位键时,作配位原子的是 中碳原子的杂化轨道类型为
中碳原子的杂化轨道类型为 互为等电子体的分子为
互为等电子体的分子为(3)金属钴晶体的晶胞是六棱柱形,其结构如图2所示,每个晶胞中含Co原子个数为
 为阿伏加德罗常数的值,晶胞的密度为
为阿伏加德罗常数的值,晶胞的密度为 ,则该晶胞的高b为
,则该晶胞的高b为
您最近一年使用:0次



