常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1 mol/L NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述正确的是( )
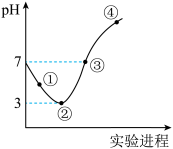

| A.用pH试纸测①处c(H+)约为②处c (H+)的两倍 |
| B.可依据②处数据计算所溶解的n(Cl2) |
| C.③处表示溶液中,c(Na+)= c(ClO-) + c(Cl-) |
| D.曲线③④段有离子反应:HClO+OH-=ClO-+H2O |
更新时间:2020-03-21 12:53:21
|
相似题推荐
多选题
|
较难
(0.4)
解题方法
【推荐1】实验室使用 传感器来测定某
传感器来测定某 和
和 混合溶液中
混合溶液中 的含量,用
的含量,用 盐酸滴定该混合溶液,得到如图曲线。滴定过程中,当滴入标准溶液的物质的量与待测组分的物质的量恰好符合化学反应式所表示的计量关系时,称反应达到了化学计量点,简称计量点。以下说法错误的是
盐酸滴定该混合溶液,得到如图曲线。滴定过程中,当滴入标准溶液的物质的量与待测组分的物质的量恰好符合化学反应式所表示的计量关系时,称反应达到了化学计量点,简称计量点。以下说法错误的是

 传感器来测定某
传感器来测定某 和
和 混合溶液中
混合溶液中 的含量,用
的含量,用 盐酸滴定该混合溶液,得到如图曲线。滴定过程中,当滴入标准溶液的物质的量与待测组分的物质的量恰好符合化学反应式所表示的计量关系时,称反应达到了化学计量点,简称计量点。以下说法错误的是
盐酸滴定该混合溶液,得到如图曲线。滴定过程中,当滴入标准溶液的物质的量与待测组分的物质的量恰好符合化学反应式所表示的计量关系时,称反应达到了化学计量点,简称计量点。以下说法错误的是
A.未滴定时该混合溶液中: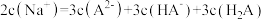 |
B.滴定过程中, 恒成立 恒成立 |
C.滴加 盐酸时,溶液中: 盐酸时,溶液中: |
D.滴加 盐酸时,溶液中: 盐酸时,溶液中: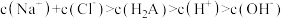 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol·L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是


| A.图中A点对应溶液的pH:a=1 |
| B.生成沉淀的最大质量m=2.33g |
| C.原混合液中c(HCl)=0.2mol·L-1 |
| D.当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐3】25℃时,向20mL0.1mol/LH2R溶液中滴加0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa=-lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21。下列有关说法不正确 的是


| A.溶液的导电性:点a弱于点b |
| B.离子浓度c(R2-):点c大于点d |
| C.H2R+R2-=2HR-平衡常数>105,反应趋于完全 |
D.点b时,y<7且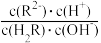 <1 <1 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐1】将等体积的
 溶液逐滴加入
溶液逐滴加入 的
的 溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中正确的是
溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中正确的是

 溶液逐滴加入
溶液逐滴加入 的
的 溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中正确的是
溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中正确的是A. |
B. |
C. |
D. |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温常压下,有关下列各溶液的描述中正确的是
A.25℃时,若测得 溶液 溶液 ,取该溶液10 ,取该溶液10 ,加入一定量水,测得混合溶液体积为100 ,加入一定量水,测得混合溶液体积为100 ,混合后溶液的 ,混合后溶液的 ,则 ,则 是弱酸 是弱酸 |
B.浓度均为0.1 的 的 、 、 混合溶液中: 混合溶液中: ,且 ,且 |
C.一定浓度的氨水加水稀释的过程中, 的比值和 的比值和 的比值均增大 的比值均增大 |
D. 的醋酸钠溶液与 的醋酸钠溶液与 盐酸溶液混合后溶液显酸性,则溶液中有关微粒的浓度关系为: 盐酸溶液混合后溶液显酸性,则溶液中有关微粒的浓度关系为: |
您最近一年使用:0次



